10-11高三上·北京石景山·期末
名校
1 . 已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g) +2H2O(l) ΔH1=﹣870.3 kJ·mol-1
②C(s) +O2(g) =CO2(g) ΔH2=﹣393.5 kJ·mol-1
③H2(g) + O2(g) =H2O(l) ΔH3=﹣285.8 kJ·mol-1
O2(g) =H2O(l) ΔH3=﹣285.8 kJ·mol-1
则反应2C(s) +2H2(g) +O2(g)=CH3COOH(l)的焓变ΔH为
①CH3COOH(l)+2O2(g)=2CO2(g) +2H2O(l) ΔH1=﹣870.3 kJ·mol-1
②C(s) +O2(g) =CO2(g) ΔH2=﹣393.5 kJ·mol-1
③H2(g) +
 O2(g) =H2O(l) ΔH3=﹣285.8 kJ·mol-1
O2(g) =H2O(l) ΔH3=﹣285.8 kJ·mol-1则反应2C(s) +2H2(g) +O2(g)=CH3COOH(l)的焓变ΔH为
| A.﹣488.3 kJ·mol-1 | B.﹣224.15 kJ·mol-1 |
| C.488.3 kJ·mol-1 | D.244.15 kJ·mol-1 |
您最近一年使用:0次
2021-11-17更新
|
1511次组卷
|
90卷引用:山西省祁县第二中学校2019-2020学年高二上学期期中考试化学试题
山西省祁县第二中学校2019-2020学年高二上学期期中考试化学试题(已下线)2011届浙江金华一中高三上学期期中考试化学试卷(已下线)2010-2011学年云南省昆明一中高二下学期期中考试化学试卷(已下线)2011-2012学年山东省济南外国语学校高二上学期期中考试化学(理)试卷(已下线)2011-2012学年陕西省宝鸡中学高一下学期期中考试化学试卷(已下线)2012-2013学年重庆市重庆一中高二上学期期中考试理科化学试卷(已下线)2014-2015学年吉林省汪清县第六中学高二上学期期中考试化学试卷(已下线)2014秋安徽省黄山市屯溪一中高二上学期期中考试化学试卷2015-2016学年四川省雅安中学高二上期中考试化学试卷2015-2016学年辽宁省五校协作体高一下学期期中考试化学试卷2016-2017学年内蒙古集宁一中高二上期中化学试卷山东省济南第一中学2017-2018学年高二上学期期中考试化学试题黑龙江省哈尔滨三中2017-2018学年高二上学期11月第一次验收考试化学试题【校级联考】福建省长汀、连城一中等六校2018-2019学年高二年上学期期中考联考化学试题黑龙江省伊春市第二中学2018届高三上学期期中考试化学试题安徽省肥东县第二中学2019-2020学年高二上学期期中考试化学试题辽宁省葫芦岛市第八高级中学2019-2020学年高二上学期期中考试化学试题山东省新泰市第二中学2019-2020学年高二上学期期中考试化学试题甘肃省临夏中学2019-2020学年高二上学期期中考试化学(理)试题山西省实验中学2020届高三化学复习针对性试题集(四)(已下线)【南昌新东方】9.湾里一中 梁莎青海省海西蒙古族藏族自治州德令哈市海西州高级中学2020-2021学年高二上学期期中考试化学试题广东省清远市第一中学2021-2022学年高二上学期期中调研考试化学试题山东省泰安肥城市2021-2022学年高二上学期期中考试化学试题山西省太原市第五十六中学2021-2022学年高二上学期10月月考化学试题内蒙古包头市第四中学2021-2022学年高二上学期期中考试化学试题山西省太原市第五十六中学2022-2023学年高二上学期10月联考化学试题广东省江门广雅中学2022-2023学年高二上学期期中考试化学试题(已下线)北京市石景山区2010学年第一学期期末考试试卷(已下线)2010年长春外国语学校高二第一学期期末考试化学试卷(已下线)2011届江西省吉安市高三第三次模拟考试(理综)化学部分(已下线)2012届山东省枣庄十八中高三10月份质量检测化学试卷(已下线)2011-2012学年湖南省凤凰县华鑫中学高二上12月月考化学试卷(已下线)2012届北京市密云二中高三10月月考化学试卷(已下线)2010-2011学年安徽省怀宁县高河中学高二下学期第二次月考化学试卷(已下线)2012-2013学年辽宁省盘锦市第二高级中学高二9月月考化学试卷(已下线)2012-2013学年江西省九江一中高二第一次月考化学试卷(已下线)2012-2013学年广东省汕头市金山中学高二上学期期末考试化学试卷(已下线)2012-2013学年江苏省新马高级中学高二下学期期末考试化学试卷(已下线)2014年高二化学人教版选修四 4化学反应热的计算练习卷(已下线)2013-2014吉林省长春市十一中高二下学期期末考试化学试卷(已下线)2015届安徽望江中学同步课时练(人教选修4)1.3化学反应热的计算2014-2015黑龙江省鸡西市龙东南四校高二上学期期末联考化学试卷2015-2016学年宁夏育才中学高二上期末考试化学试卷2017届湖北省松滋市第一中学高三上学期9月月考化学试卷2016-2017学年广西宾阳中学高二上9月月考化学试卷2016-2017学年江西省宜春市奉新一中高二上月考一化学试卷苏教版2017届高三单元精练检测六化学试题苏教版2017届高三单元精练检测六化学试题甘肃省兰州第一中学2017-2018学年高二上学期第一次月考(9月)化学试题河南省南阳市七校2017-2018学年高二上学期第一次联考化学试题山东省济南市第一中学2017-2018学年高二10月阶段测试化学试题陕西省西安市长安区第一中学2017-2018学年高二上学期第二次月考化学试题人教版2017届高三单元精练检测六化学试题(已下线)2018年9月12日 《每日一题》一轮复习-反应热的计算安徽省凤阳县二中2018-2019学年高二下学期开学摸底考试化学试题(已下线)考点08 化学反应中的热效应——备战2019年浙江新高考化学考点(已下线)2019年4月14日《每日一题》三轮复习—— 每周一测【全国百强校】河北省张家口市第一中学2018-2019学年高一下学期4月月考化学试题【全国百强校】广东省中山市第一中学2018-2019学年高一下学期第二次(5月)段考化学试题(已下线)2019年8月30日 《每日一题》人教选修4——盖斯定律的应用河南省林州市第一中学2019-2020学年高二9月月考化学试题河南林州一中2019-2020学年高二上9月化学测试题辽宁省葫芦岛市第八高级中学2020届高三10月月考化学试题湖北省黄冈市2019-2020学年高二10月月考化学试题海南省东方市八所中学2019-2020学年高二上学期第一次月考化学试题宁夏育才中学2019-2020学年高二上学期第一次月考化学试题陕西省榆林市第二中学2020届高三第四次模拟考试化学试题吉林省油田第十一中学2019-2020学年高二上学期第一次月考化学试题2019年秋高三化学复习强化练习—— 盖斯定律及其应用河南省开封市五县联考2019-2020学年高二上学期期末考试化学试题湖北省咸宁市崇阳一中2019-2020学年高二3月月考化学试题内蒙古自治区呼和浩特市土默特左旗第一中学2019-2020学年高一下学期期末考试化学试题河南省安阳市林州市第一中学2020-2021学年高二上学期开学考试(实验班)化学试题(已下线)1.3.1+盖斯定律-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)河南省南阳市第十中学2020-2021学年高二上学期第一次月考化学试题江西宜春市第九中学2020-2021学年高二上学期第一次月考化学试题辽宁省营口市2020-2021学年高二上学期期末考试化学试题江西省抚州市崇仁第二中学2021-2022学年高二上学期第一次月考化学试题广东省深圳市宝安第一外国语学校2021-2022学年高二10月月考化学试题江西省南城第二中学2021-2022学年高二上学期第一次月考化学试题甘肃省庆阳市第六中学2021-2022学年高二上学期第一次月考化学(理)试题辽宁省本溪市第二高级中学2021-2022学年高二上学期期末考试化学试题陕西省渭南市咸林中学2021-2022学年高二上学期第三阶段检测化学试题陕西省渭南市富平县蓝光中学2021-2022学年高二上学期期末质量检测化学(理)试题新疆乌鲁木齐市第八中学2022-2023学年高二下学期第一次质量检测(开学摸底)化学试题广西南宁市2022-2023学年高二下学期开学考试化学试题四川省华蓥中学2023-2024学年高二上学期9月月考化学试题山东省海阳第一中学2023-2024学年高一下学期3月份月考化学试题陕西省西安市周至县第四中学2023-2024学年高二上学期1月期末化学试题
2 . 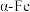 (Ⅲ)晶面铁原子簇是合成氨工业的一种新型高效催化剂,N2和H2在其表面首先变为活化分子,反应机理为:①
(Ⅲ)晶面铁原子簇是合成氨工业的一种新型高效催化剂,N2和H2在其表面首先变为活化分子,反应机理为:①

②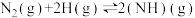

③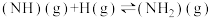

④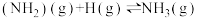

总反应为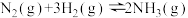

下列说法正确的是
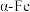 (Ⅲ)晶面铁原子簇是合成氨工业的一种新型高效催化剂,N2和H2在其表面首先变为活化分子,反应机理为:①
(Ⅲ)晶面铁原子簇是合成氨工业的一种新型高效催化剂,N2和H2在其表面首先变为活化分子,反应机理为:①

②
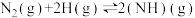

③
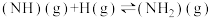

④
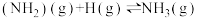

总反应为
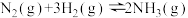

下列说法正确的是
A.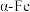 (Ⅲ)晶面铁原子簇能够有效降低合成氨反应的活化能和焓变 (Ⅲ)晶面铁原子簇能够有效降低合成氨反应的活化能和焓变 |
B.相同条件下,若1mol氢原子所具有的能量为E1,1 mol氢分子的能量为E2,则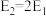 |
| C.反应①和总反应均为放热反应 |
D.总反应的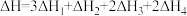 |
您最近一年使用:0次
名校
3 . 在载人航天器中,可以利用CO2与H2的反应,将航天员呼出的CO2转化为H2O等,然后通过电解水得到O2,从而实现O2的再生。已知:
①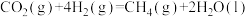

②
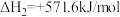
③
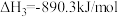
则x等于
①
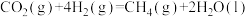

②

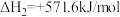
③

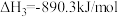
则x等于
| A.+252.9 | B.-252.9 | C.+1461.9 | D.-318.7 |
您最近一年使用:0次
2021-11-17更新
|
227次组卷
|
4卷引用:山西省怀仁市2021-2022学年高二上学期期中化学试题
4 . 关于化学反应与能量的说法正确的是
| A.氧化还原反应都会放出热量 |
B.化学反应的 ,不仅与反应体系的始态和终态有关,还与反应途径有关 ,不仅与反应体系的始态和终态有关,还与反应途径有关 |
| C.伴随能量变化的物质变化不一定是化学变化 |
| D.化学反应中能量变化的大小与反应物的质量多少无关 |
您最近一年使用:0次
5 . 接触法制硫酸生产中的关键工序是SO2的催化氧化:2SO2(g)+O2(g) 2SO3(g) △H=-196kJ·mol-1。钒催化剂参与反应的能量变化如图所示。下列说法正确的是
2SO3(g) △H=-196kJ·mol-1。钒催化剂参与反应的能量变化如图所示。下列说法正确的是
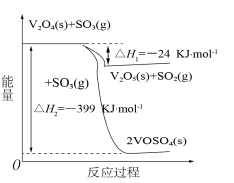
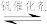 2SO3(g) △H=-196kJ·mol-1。钒催化剂参与反应的能量变化如图所示。下列说法正确的是
2SO3(g) △H=-196kJ·mol-1。钒催化剂参与反应的能量变化如图所示。下列说法正确的是
| A.钒催化剂改变了SO2催化氧化的反应热 |
| B.上述条件下加入2molSO2和1molO2发生反应,释放的能量等于196kJ |
| C.1molV2O4(s)的能量比2mol VOSO4(s)的能量多399kJ |
| D.2V2O5(s)+2SO2(g)=2VOSO4(s)+V2O4(s) △H=-351kJ·mol-1 |
您最近一年使用:0次
2021-11-14更新
|
326次组卷
|
3卷引用:山西省吕梁市柳林县2021-2022学年高二上学期期中考试化学试题
10-11高二上·山西临汾·期中
名校
解题方法
6 . 已知热化学反应方程式:Zn(s)+ O2(g)=ZnO(s) ΔH=-351.5kJ·mol-1;Hg(l)+
O2(g)=ZnO(s) ΔH=-351.5kJ·mol-1;Hg(l)+ O2(g)=HgO(s) ΔH=-90.84kJ·mol-1,则热化学反应方程式:Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为
O2(g)=HgO(s) ΔH=-90.84kJ·mol-1,则热化学反应方程式:Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为
 O2(g)=ZnO(s) ΔH=-351.5kJ·mol-1;Hg(l)+
O2(g)=ZnO(s) ΔH=-351.5kJ·mol-1;Hg(l)+ O2(g)=HgO(s) ΔH=-90.84kJ·mol-1,则热化学反应方程式:Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为
O2(g)=HgO(s) ΔH=-90.84kJ·mol-1,则热化学反应方程式:Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为| A.ΔH=+260.66kJ·mol-1 | B.ΔH=+442.34kJ·mol-1 |
| C.ΔH=-442.34kJ·mol-1 | D.ΔH=-260.66kJ·mol-1 |
您最近一年使用:0次
2021-11-08更新
|
147次组卷
|
27卷引用:2010年山西省临汾一中高二上学期期中考试化学试题
(已下线)2010年山西省临汾一中高二上学期期中考试化学试题(已下线)2011-2012学年江西省兴国县将军中学高二上学期期中考试化学试卷(已下线)2011-2012学年福建省厦门一中高二上学期期中考试化学试卷(已下线)2011-2012学年辽宁省抚顺县高级中学高一下学期期中考试化学试卷(已下线)2012-2013学年浙江省桐乡一中高二下学期期中考试化学试卷2015-2016学年吉林省吉林五十五中高二上学期期中(理)化学试卷甘肃省天水市武山县三校2020-2021学年高二上学期期中联考化学试题 (已下线)必考点01 化学反应的热效应-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)云南省红河县一中2021-2022学年高二上学期期中考试化学试题(已下线)2012-2013学年新疆兵团农二师华山中学高二上学期期末考试化学试卷(已下线)2014届贵州省六校联盟高三第一次联考化学试卷2015-2016北京大学附中宇华教育集团高二12月化学卷2015-2016北京大学附中宇华教育集团高一12月化学卷2015-2016学年陕西省黄陵中学高二上学期期末考试化学试卷2015-2016学年安徽省安庆市怀宁县高河中学高二上期末化学试卷甘肃省武威第五中学2018-2019学年高二上学期期末考试化学试题宁夏青铜峡市高级中学(吴忠中学分校)2019-2020学年高二上学期第一次月考化学试题福建省华安一中、龙海二中2019-2020学年高二上学期第一次联考化学试题甘肃省古浪县第二中学2019-2020学年高二12月基础知识竞赛化学试题【懂做原理题】2020届高三化学选修4二轮专题练——盖斯定律的应用【选择提升24题】黑龙江省绥化地区肇东第四中学2020-2021学年高二上学期期末考试化学试题湖南省常德市石门县第六中学2020-2021学年高二上学期期末考试(合格考)化学试题吉林省大安市第六中学2021-2022学年高二上学期第一次月考化学试题湖南省长沙铁路第一中学2021-2022学年高二上学期第一次阶段性考试化学试题海南省海口嘉勋高级中学2021-2022学年高二上学期10月月考化学试题黑龙江省鸡西市第四中学2022-2023学年高二上学期第一次月考化学试题安徽省芜湖市无为襄安中学2022-2023高二上学期第一次月考化学试题
名校
解题方法
7 . 已知:
①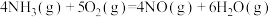
②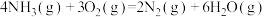
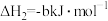
③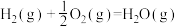

④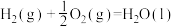

下列叙述正确的是
①
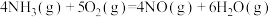
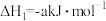
②
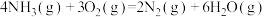
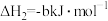
③
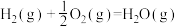

④
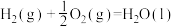

下列叙述正确的是
A.由上述热化学方程式可知 |
| B.上述四个反应中,反应物的总能量均大于生成物的总能量 |
C.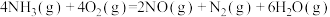 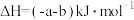 |
D.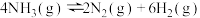  |
您最近一年使用:0次
2021-08-06更新
|
437次组卷
|
4卷引用:山西省实验中学2022-2023学年高一下学期期中考试化学试题
8 . 已知下列热化学方程式:
2Zn(s)+O2(g)=2ZnO(s) ΔH1=-702.2 kJ·mol-1;
Hg(l)+ O2(g)=HgO(s) ΔH2=-90.7 kJ·mol-1。
O2(g)=HgO(s) ΔH2=-90.7 kJ·mol-1。
由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH3中ΔH3的值是
2Zn(s)+O2(g)=2ZnO(s) ΔH1=-702.2 kJ·mol-1;
Hg(l)+
 O2(g)=HgO(s) ΔH2=-90.7 kJ·mol-1。
O2(g)=HgO(s) ΔH2=-90.7 kJ·mol-1。由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH3中ΔH3的值是
| A.-260.4 kJ·mol-1 | B.-254.6 kJ·mol-1 |
| C.-438.9 kJ·mol-1 | D.-441.8 kJ·mol-1 |
您最近一年使用:0次
2021-07-26更新
|
707次组卷
|
55卷引用:山西省忻州二中2018-2019学年高二上学期期中考试化学试题
山西省忻州二中2018-2019学年高二上学期期中考试化学试题(已下线)2010—2011学年浙江省嘉兴一中高二下学期期中考试化学试卷(已下线)2011学年浙江省瑞安十校高二第二学期期中联考化学试卷(已下线)2014-2015学年山东安丘市实验中学期中考试高二化学模拟(B)卷2015-2016学年青海西宁第十四中学高二上期中考试化学卷广东省肇庆市实验中学2017-2018学年高二上学期期中考试化学(理)试题甘肃省岷县一中2018-2019学年高二上学期期中考试化学试题江西省上饶市第二中学2018-2019学年高二上学期期中考试化学试题黑龙江省鸡西市第十九中学2019届高三上学期期中考试化学试题【全国百强校】河南省实验中学2018-2019学年高二上学期期中考试化学试题宁夏青铜峡市高级中学2019-2020学年高二上学期期中考试化学试题辽宁省辽河油田第二高级中学2019-2020学年高二上学期期中考试化学试题江西省吉安市吉水二中、新干二中、吉安县二中、永丰二中、泰和二中五校2019-2020学年高二期中联考化学试题甘肃省临夏中学2019-2020学年高二上学期期中考试化学(理)试题甘肃省白银市会宁县第二中学2017-2018学年高二上学期期中考试理科化学试题山西省临猗县临晋中学2020-2021学年高二9月月考化学试题甘肃省兰州市第四片区2020-2021学年高二上学期期中考试化学(理)试题甘肃省张掖市第二中学2020-2021学年高二上学期期中考试化学试题天津市滨海新区汉沽第六中学2020-2021学年高二上学期期中化学试题河南省汤阴县五一中学2019-2020学年高二上学期期中考试化学试题新疆乌鲁木齐第四中学2021-2022学年高二上学期期中考试化学试题北京市第三十一中学2021-2022学年高二上学期期中考试化学试题海南省三亚华侨学校(南新校区)2021-2022学年高二上学期期中考试化学试题甘肃省兰州市教育局第四片区联考2023-2024学年高二上学期期中考试化学试题云南省保山市智源高级中学2023-2024学年高一下学期4月期中考试化学试题(已下线)2010年福建省厦门市杏南中学高二上学期10月月考理科化学卷(已下线)2011-2012学年广东省汕头市达濠中学高二上学期期末考试化学试卷(已下线)2014-2015学年广东阳东县第二中学高二10月月考化学(理)试卷(已下线)2015届内蒙古巴彦淖尔市第一中学高三10月月考化学试卷2015-2016学年青海省高级中学高二上9月质检化学试卷云南省峨山彝族自治县第一中学2017-2018学年高二12月月考(理)化学试题福建省泉州市泉港区第一中学2017-2018学年高二下学期第一次(4月)月考化学试题河南省郑州市第106中学2018-2019学年高二上学期第一次月考化学试题【全国百强校】四川省南充市阆中中学2018-2019学年高二上学期1月质量检测化学试题山东省济宁市微山县第二中学2019-2020学年高二10月月考化学试题福建省泉州第十六中学2019-2020学年高二10月份月考化学试题四川省广安市岳池县第一中学2019-2020学年高二上学期第一次月考化学试题山东省济南外国语学校2019-2020学年高二下学期3月份“空中课堂”阶段性测试化学试题河南省安阳市林州市第一中学2019-2020学年高二下学期4月月考化学试题北京市海淀区中关村中学2019-2020学年高二下学期期末练习化学试题甘肃省白银市靖远县第四中学2021届高三上学期10月月考化学试题陕西省渭南市临渭区尚德中学2020-2021学年高二上学期第一次月考化学试题黑龙江省哈尔滨市第六中学2020-2021学年高二10月月考化学试题(已下线)练习3 化学反应热的计算-2020-2021学年【补习教材·寒假作业】高二化学(人教版)河北省唐山市2020-2021学年高二上学期期末考试化学试题海南省三亚华侨学校(南新校区)2020-2021学年高二下学期开学考试化学试题贵州省龙里县九八五实验学校2020-2021学年高二上学期1月月考化学试题(已下线)第17讲 化学能与热能(精讲)-2022年一轮复习讲练测(已下线)专题18 化学反应与能量(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练福建省泉州现代中学2021-2022学年高二上学期9月月考化学试题黑龙江省哈尔滨市第六中学校2021-2022学年高二上学期10月阶段性总结化学试题山东省新泰市第二中学2021-2022学年上学期高二阶段性测试(一)化学试题重庆市沙坪坝实验中学校2021-2022学年高二上学期10月月考化学试题重庆市沙坪坝实验中学校2021-2022学年高二上学期12月月考化学试题江西省瑞金市第二中学2021-2022学年高二上学期第一次月考化学试题
名校
9 . Na2CO3(aq)与盐酸反应过程中的能量变化示意图如图,下列选项正确的是
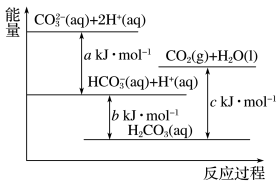

| A.H2CO3(aq)=CO2(g)+H2O(l)为放热反应 |
B.CO (aq)+H+(aq)=HCO (aq)+H+(aq)=HCO (aq)∆H=a kJ·mol-1 (aq)∆H=a kJ·mol-1 |
C.HCO (aq)+H+(aq)=CO2(g)+H2O (l)∆H=(c-b) kJ·mol-1 (aq)+H+(aq)=CO2(g)+H2O (l)∆H=(c-b) kJ·mol-1 |
D.CO (aq)+2H+(aq)=CO2(g)+H2O(l)∆H=(a+b-c) kJ·mol-1 (aq)+2H+(aq)=CO2(g)+H2O(l)∆H=(a+b-c) kJ·mol-1 |
您最近一年使用:0次
2020-12-22更新
|
517次组卷
|
12卷引用:山西大学附属中学校2022-2023学年高二上学期11月期中考试化学试题
山西大学附属中学校2022-2023学年高二上学期11月期中考试化学试题河北省衡水中学2016-2017学年高一下学期期中考试化学试题河北省深州中学2017-2018高一下学期期中考试化学试题【全国百强校】陕西省西安市长安区第一中学2018-2019学年高二(实验班)上学期期中考试化学试题河北省实验中学2021届高三上学期期中考试化学试题天津市南开中学2020-2021学年高一下学期期中考试化学试题2017届浙江省宁波市高三新高考选考适应性考试化学试卷(已下线)2018年10月15日 《每日一题》人教选修4-热化学方程式的书写与正误判断安徽省滁州市明光县明光中学2020-2021学年高二上学期第一次月考化学试题(已下线)小题必刷23 焓变与热化学方程式——2021年高考化学一轮复习小题必刷(通用版)第一章 本章复习提升2陕西省武功县普集高级中学2023-2024学年高二上学期10月月考化学试题
名校
10 . 已知反应:2NO(g)+Br2(g)=2NOBr(g) △H=-akJ·mol-1(a>0),其反应机理如下:
①NO(g)+Br2(g)=NOBr2(g) △H1快反应;
②NO(g)+NOBr2(g)=2NOBr(g) △H2慢反应。
下列说法不正确的是( )
①NO(g)+Br2(g)=NOBr2(g) △H1快反应;
②NO(g)+NOBr2(g)=2NOBr(g) △H2慢反应。
下列说法不正确的是( )
| A.△H=△H1+△H2 |
| B.该反应的速率主要取决于反应① |
| C.NOBr2是该反应的中间产物,不是催化剂 |
| D.恒容时,增大Br2(g)的浓度能增加单位体积活化分子总数,加快反应速率 |
您最近一年使用:0次
2020-11-24更新
|
537次组卷
|
7卷引用:山西省太原市2020-2021学年高二上学期期中质量监测化学(理)试题
山西省太原市2020-2021学年高二上学期期中质量监测化学(理)试题(已下线)选择性必修1 期中检测(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)湖北省孝感市2021-2022学年高二上学期期中联考化学试题浙江省温州市平阳县万全综合高级中学2021-2022学年高二上学期期中考试化学试题选择性必修1 专题2 第一单元综合训练 天津市静海区第一中学2023-2024学年高二上学期12月月考化学试题广东省惠州市龙门县高级中学2023-2024学年高二上学期12月月考化学试题



