解题方法
1 . 环戊二烯( )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。已知:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。已知:
① (g)=
(g)= (g)+H2(g)△H1=+100.3kJ·mol-1
(g)+H2(g)△H1=+100.3kJ·mol-1
则反应 (g)+I2(g)=
(g)+I2(g)= (g)+2HI(g)的△H等于( )
(g)+2HI(g)的△H等于( )
| A.+89.3kJ·mol-1 | B.-89.3kJ·mol-1 |
| C.+111.3kJ·mol-1 | D.-111.3kJ·mol-1 |
您最近一年使用:0次
2020-11-24更新
|
407次组卷
|
3卷引用:山西省太原市2020-2021学年高二上学期期中质量监测化学(理)试题
2 . 下列叙述或表示方法不正确的是
| A.盖斯定律实质上是能量守恒定律的体现 |
B.在稀溶液中: ,含0.5 mol H2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ ,含0.5 mol H2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ |
| C.相同条件下,如果1mol氧原子所具有的能量为E1,1mol氧分子所具有的能量为E2,则2E1= E2 |
| D.化学键的断裂和形成是化学反应中能量变化的根本原因 |
您最近一年使用:0次
3 . 嫦娥二号卫星采用“长三丙火箭”进行发射,其第三级推进器使用的燃料是液态氢。已知在25℃时,2 g H2(g)与O2(g)完全反应生成H2O(g)时放热241.8KJ。则下列有关判断正确的是
| A.H2(g)的燃烧热是-241.8KJ/mol |
B.25℃时,H2(g)+ O2(g)=H2O(l) ΔH<-241.8KJ/mol O2(g)=H2O(l) ΔH<-241.8KJ/mol |
| C.25℃时,22.4L H2 完全燃烧生成H2O(g)放出的热量为241.8KJ |
D.已知H2O(g)=H2O(l) ΔH=-44KJ/mol,则H2O(l)=H2(g)+ O2(g) ΔH=+241.8KJ/mol O2(g) ΔH=+241.8KJ/mol |
您最近一年使用:0次
名校
解题方法
4 . 下列说法或表示方法不正确的是
| A.盖斯定律实质上是能量守恒定律的体现 |
| B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) △H = -57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ |
| C.由一定条件下石墨合成金刚石吸热,可知石墨比金刚石稳定 |
| D.在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H = –285.8kJ/mol |
您最近一年使用:0次
2020-11-12更新
|
326次组卷
|
17卷引用:山西省晋中市平遥县第二中学2018-2019学年高二上学期期中考试化学试题
山西省晋中市平遥县第二中学2018-2019学年高二上学期期中考试化学试题安徽省池州市第一中学2019-2020学年高二上学期期中考试化学试题山西大学附属中学2019-2020学年高二10月月考化学试题河北省唐山市河北唐山外国语学校2020-2021学年高二上学期期中考试(理科)化学试题河北省尚义县第一中学2020-2021学年高二上学期期中考试化学试题湖北省巴东县第二高级中学2020-2021学年高二上学期期中考试化学试题河北省唐山市遵化市2021-2022学年高二上学期期中考试化学试题2014-2015学年山东省微山一中高二下学期期末考试化学试卷云南省曲靖市罗平县第三中学2020届高二下学期开学考试化学试题四川省成都外国语学校2020-2021学年高二10月月考化学试题(已下线)小题必刷24 盖斯定律及反应热计算——2021年高考化学一轮复习小题必刷(通用版)甘肃省天水市第六中学2019-2020学年高二上学期期末考试化学试题(普通班)内蒙古自治区第二地质中学2020-2021学年高二下学期第二次阶段检测化学试题陕西省宝鸡市金台区2021-2022学年高二上学期期末考试化学(理)试题吉林省辽源市等2地高中友好学校2022-2023学年高二上学期期末联考化学试题安徽省安庆市怀宁县第二中学2022-2023学年高二上学期期末考试化学试题吉林省辽源、通化等2市2022-2023学年高二上学期1月期末考试化学试题
19-20高三·浙江·阶段练习
解题方法
5 . 氢碘酸和氯水反应的能量关系如图所示。
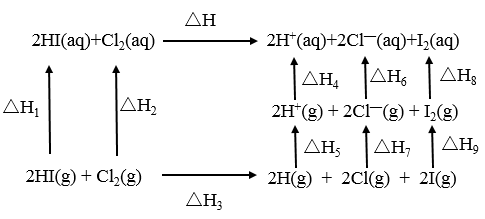
下列说法正确的是

下列说法正确的是
| A.已知HI气体溶于水放热,则ΔH1 <0 |
| B.ΔH = ΔH1 +ΔH2 + ΔH3 +ΔH4 +ΔH5 +ΔH6+ΔH7 +ΔH8 +ΔH9 |
| C.已知ΔH <0,则ΔH3 <0 |
| D.ΔH9 >0 |
您最近一年使用:0次
名校
6 . 我国学者研究了均相 NO- CO 的反应历程,反应路径中每一阶段内各驻点的能最均为相对于此阶段内反应物能量的能量之差,下列说法正确的是
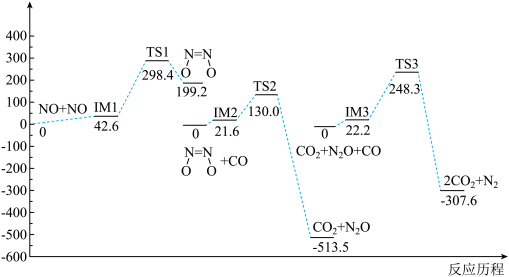

A.2NO(g)+ 2CO(g)  N2(g) +2CO2(g) ΔH>O N2(g) +2CO2(g) ΔH>O |
| B.均相NO—CO反应经历了三个过渡态和六个中间体 |
| C.整个反应分为三个基元反应阶段,总反应速率由第一阶段反应决定 |
D.NO二聚体(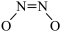 )比N2O分子更难与CO发生反应 )比N2O分子更难与CO发生反应 |
您最近一年使用:0次
7 . 1mol白磷转化为红磷放热18.39kJ,已知:
P4(白磷,s)+5O2(g)=2P2O5(s) ΔH= -akJ·mol-1(a>0);
4P(红磷,s)+5O2(g)=2P2O5(s) ΔH=-bkJ·mol-1(b>0);
则a和b的关系是( )
P4(白磷,s)+5O2(g)=2P2O5(s) ΔH= -akJ·mol-1(a>0);
4P(红磷,s)+5O2(g)=2P2O5(s) ΔH=-bkJ·mol-1(b>0);
则a和b的关系是( )
| A.a<b | B.a>b | C.a=b | D.无法确定 |
您最近一年使用:0次
2020-09-11更新
|
232次组卷
|
29卷引用:2014-2015学年山西省曲沃中学校高二上学期期中化学试卷
2014-2015学年山西省曲沃中学校高二上学期期中化学试卷(已下线)2011-2012学年天津一中高二上学期期中考试化学试卷(已下线)2011-2012学年辽宁省抚顺县高级中学高一下学期期中考试化学试卷(已下线)2011-2012学年天津市天津一中高二上学期期中考试化学试卷山西省运城市康杰中学2017-2018学年高二上学期第一次月考化学试题山西省汾阳市第二高级中学2018-2019学年高二上学期第二次半月考化学试题江西省上饶市第二中学2018-2019学年高二上学期期中考试化学试题内蒙古呼和浩特开来中学2019-2020学年高二上学期期中考试化学试题吉林省长春市第二十九中学2019-2020学年高一下学期期中考试化学试题(理)甘肃省庆阳市第六中学2020-2021学年高二上学期期中考试化学(理)试题(已下线)2011-2012学年吉林省长春外国语学校高二第二次月考化学试卷(已下线)2011-2012学年云南大理云龙一中高二上学期期末考试化学试卷(已下线)2011-2012学年安徽省安工大附中、红星中学高二3月联考化学试卷(已下线)2011-2012学年安徽省舒城晓天中学高二下学期质量测试2化学试卷2014-2015河北省正定中学高一下学期第一次月考化学试卷2016-2017学年山东省德州市陵城一中高二上10月月考化学试卷河北省安平中学2016-2017学年高一下学期升级考试化学试题山东省枣庄市第八中学南校区高二10月份月考化学试题山东省枣庄市第八中学东校区2017-2018学年高二10月月考化学试题福建省三明市第一中学2017-2018学年高二上学期第一次月考化学试题河北省邢台第三中学2017-2018学年高二9月月考化学试题山东省锦泽技工学校2017-2018学年高二10月月考化学试题陕西煤铜川市炭建设公司第一中学2018-2019学年高二上学期10月月考化学试题(已下线)2018年10月20日 《每日一题》人教选修4-周末培优吉林省实验中学2019-2020学年高二上学期第一次月考化学试题广东省惠来县葵潭中学2019-2020学年高二上学期第二次月考化学试题新疆吾尔自治区哈密市第十五中学2019-2020学年高一下学期期末考试化学试题甘肃省临夏中学2019-2020学年高二上学期第一次月考化学试题安徽省蚌埠田家炳中学2020-2021学年高二10月月考化学试题
10-11高二上·福建福州·期中
名校
解题方法
8 . 在一定温度下,CO和CH4燃烧的热化学方程式分别为
2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890kJ/mol
1molCO和3molCH4组成的混合气体,在相同条件下完全燃烧时,释放的热量为( )
2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890kJ/mol
1molCO和3molCH4组成的混合气体,在相同条件下完全燃烧时,释放的热量为( )
| A.2912kJ | B.2953kJ | C.3236kJ | D.3867kJ |
您最近一年使用:0次
2020-01-23更新
|
780次组卷
|
37卷引用:2015-2016学年山西省右玉一中高一下学期期中考试化学试卷
2015-2016学年山西省右玉一中高一下学期期中考试化学试卷(已下线)2010年福建省福州市八县(市)协作校第一学期期中联考高二理科化学试卷(已下线)2011-2012学年浙江省东阳市南马高中高一下学期期中考试化学试卷(已下线)2013-2014学年浙江省平阳中学高一下学期期中考试化学试卷2014-2015学年福建省泉州一中高二上学期期中考试化学试卷2014-2015学年河北省唐山市开滦第二中学高一下学期期中化学试卷河北省唐山市滦县二中2017-2018学年高二期中考试化学(理)试卷福建省长泰县第一中学2017-2018学年高二上学期期中考试(理)化学试题浙江省温州市求知中学2018-2019学年高二上学期期中考试(选考)化学试题江西省宜春市宜丰县第二中学2019-2020学年高二上学期期中考试化学试题福建省莆田市涵江区莆田第七中学2020-2021学年高二上学期期中考试化学试题(Ⅰ)山西省太原市第五十六中学2021-2022学年高二上学期10月月考化学试题山西省太原市第五十六中学2022-2023学年高二上学期10月联考化学试题(已下线)2010-2011年江苏省扬州中学高一下学期期末考试化学试卷(已下线)2013-2014学年贵州省遵义四中高二上学期期末考试化学试卷(已下线)2015安徽望江中学同步课时练(人教选修4)第一章检测试卷2016-2017学年西藏拉萨中学高二上第一次月考化学试卷2016-2017学年贵州省思南中学高二上半期考试化学卷吉林省辽源市田家炳高级中学2018-2019学年高二9月月考化学试题贵州省遵义市航天高级中学2018-2019学年高二(理)上学期第一次月考化学试题【全国百强校】贵州省遵义航天高级中学2018-2019学年高二上学期第一次月考化学试题黑龙江省齐齐哈尔市第八中学2019-2020学年高二9月月考化学试题山东省新泰二中2019-2020学年高二上学期第一次阶段性考试化学试题吉林省东辽五中2019-2020学年高二上学期9月月考化学试题安徽省滁州市定远县育才学校2019-2020学年高二(实验班)上学期第三次月考化学试题甘肃省古浪县第二中学2019-2020学年高二上学期基础知识竞赛化学试题陕西省宝鸡市渭滨区2019—2020学年高二上学期期末考试化学试题四川省南充市阆中中学2020届高三化学选择题专项训练(9)(已下线)第01章 化学反应与能量(B卷提升篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)河南省三门峡市第一高级中学2020-2021学年高二上学期9月月考化学试题陕西省延安市第一中学2020-2021学年高二上学期第一次月考化学试题青海省西宁市海湖中学2020-2021学年高二上学期第一阶段测试化学试题宁夏长庆高级中学2020-2021学年高二上学期第一次月考化学试题广东省湛江市雷州市第二中学2020-2021学年高二上学期第一次月考化学试题辽宁省阜新市第二高级中学2020-2021学年高二上学期第二次月考化学试题贵州省贵阳市清镇养正学校2020-2021学年高二上学期第一次月考化学试题1.1.2反应热的测量与计算 课前
9 . 氯原子对O3的分解有催化作用:
O3+Cl=ClO+O2∆H1
ClO+O=Cl+O2∆H2
大气臭氧层的分解反应是O3+O=2O2∆H,该反应的能量变化如图,下列叙述正确的是()
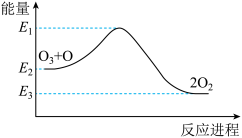
O3+Cl=ClO+O2∆H1
ClO+O=Cl+O2∆H2
大气臭氧层的分解反应是O3+O=2O2∆H,该反应的能量变化如图,下列叙述正确的是()

| A.反应O3+O=2O2的∆H=E2-E3 |
| B.O3+O=2O2的逆反应的活化能为E3-E1 |
| C.∆H=∆H1+∆H2 |
| D.2O2=O3+O是放热反应 |
您最近一年使用:0次
名校
10 . 下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

下列说法不正确的是( )

下列说法不正确的是( )
A.通过计算,可知系统(Ⅰ)制备氢气的热化学方程式为:H2O(l)= H2(g)+1/2O2(g) ΔH = 286 kJ· mol-1 |
| B.通过计算,可知系统(Ⅱ)制备氢气的热化学方程式为:H2S(g)=H2(g)+S(s) ΔH =20kJ·mol-1 |
C.若反应H2(g)+1/2O2(g)=H2O(g) ΔH = -a kJ · mol-1, 则a>286  |
| D.制得等量H2所需能量较少的是热化学硫碘循环硫化氢分解法 |
您最近一年使用:0次
2019-08-11更新
|
966次组卷
|
4卷引用:山西省太原市2019-2020学年高二上学期期中测评化学试题
山西省太原市2019-2020学年高二上学期期中测评化学试题浙江省稽阳2018-2019学年高三联考化学试题江西省吉安市遂川中学2019—2020学年高二上学期第一次月考化学试题(B)(已下线)课时28 焓变与热化学方程式-2022年高考化学一轮复习小题多维练(全国通用)



