名校
解题方法
1 . 甲醇(CH3OH)是一种基本的有机化工原料,主要用于塑料、医药、农药、合成蛋白质等工业。
I.工业上常用一氧化碳(CO)和氢气(H2)合成甲醇。一定温度下,在容积为2L的某恒容密闭容器中充入一氧化碳和氢气两种气体进行反应,反应过程中各成分的相关数据如图所示。

回答下列问题:
(1)该反应的化学方程为___________ 。
(2)从反应开始至10min内,(恰好达平衡时间内)CO的消耗速率为___________ 。
(3)反应达平衡时,H2的转化率为___________ ,容器内CH3OH与CO的物质的量之比n(CH3OH):n(CO)=___________ 。
II.工业上常用天然气作为制备CH3OH的原料。已知:
①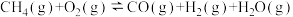 △H=-321.5kJ/mol
△H=-321.5kJ/mol
②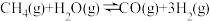 △H=+250.3kJ/mol
△H=+250.3kJ/mol
③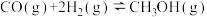 △H=-90.0kJ/mol
△H=-90.0kJ/mol
(4)CH4(g)与O2(g)化合生成CH3OH(g)的热化学方程式是___________ 。
III.CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、氧气和KOH溶液构成。回答下列问题:
(5)该电池的负极反应为___________ 。
I.工业上常用一氧化碳(CO)和氢气(H2)合成甲醇。一定温度下,在容积为2L的某恒容密闭容器中充入一氧化碳和氢气两种气体进行反应,反应过程中各成分的相关数据如图所示。

回答下列问题:
(1)该反应的化学方程为
(2)从反应开始至10min内,(恰好达平衡时间内)CO的消耗速率为
(3)反应达平衡时,H2的转化率为
II.工业上常用天然气作为制备CH3OH的原料。已知:
①
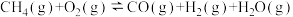 △H=-321.5kJ/mol
△H=-321.5kJ/mol②
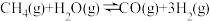 △H=+250.3kJ/mol
△H=+250.3kJ/mol③
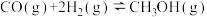 △H=-90.0kJ/mol
△H=-90.0kJ/mol(4)CH4(g)与O2(g)化合生成CH3OH(g)的热化学方程式是
III.CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、氧气和KOH溶液构成。回答下列问题:
(5)该电池的负极反应为
您最近一年使用:0次
2 . 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了普遍关注,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示。
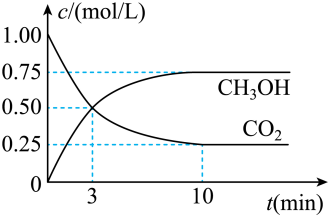
(1)应开始到平衡,H2的平均反应速率v(H2)=___________ mol/(L·min),H2的转化率为___________ 。
(2)能判断该反应是否达到化学平衡状态的依据是___________ 。
a.容器中压强不变 b.混合气体中c(CO2)=c(H2O)
c.混合气体的平均分子量不变 d.混合气体的密度不变
(3)下列措施中能使活化分子百分数增大的是___________ 。
A.升高温度 B.增大反应物浓度 C.增大压强 D.使用正催化剂
(4)一种新型燃料电池,一极通入空气,另一极通入甲醇气体;燃料电池内部是熔融的K2CO3,在其内部可以传导CO 。在电池内部CO
。在电池内部CO 移向
移向___________ ,该电池的负极反应为___________ 。
(5)氮氧化物的污染也受到高度重视,硝酸厂常用催化还原法处理尾气:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g) △H=-483.5kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+133kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是___________ 。
 CH3OH(g)+H2O(g) △H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)应开始到平衡,H2的平均反应速率v(H2)=
(2)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中c(CO2)=c(H2O)
c.混合气体的平均分子量不变 d.混合气体的密度不变
(3)下列措施中能使活化分子百分数增大的是
A.升高温度 B.增大反应物浓度 C.增大压强 D.使用正催化剂
(4)一种新型燃料电池,一极通入空气,另一极通入甲醇气体;燃料电池内部是熔融的K2CO3,在其内部可以传导CO
 。在电池内部CO
。在电池内部CO 移向
移向(5)氮氧化物的污染也受到高度重视,硝酸厂常用催化还原法处理尾气:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g) △H=-483.5kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+133kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是
您最近一年使用:0次
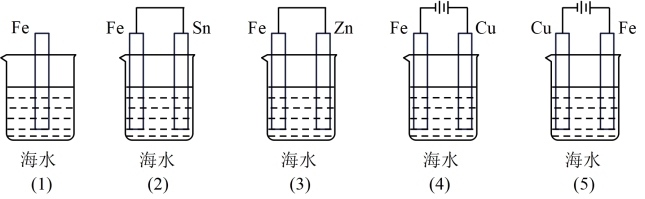
3 . Ⅰ.钢铁容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一、可采用电化学防护技术减缓海水中钢铁设施的腐蚀,下图是钢铁桥墩部分防护原理示意图。
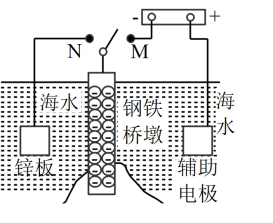
(1)K 与 M 连接时钢铁桥墩的电化学防护方法为___________ 。
(2)K与N连接时,钢铁桥墩为___________ 极(填"正"、"负"、"阴"或"阳"),电极反应式为___________ 。
(3)下列各情况中,Fe片腐蚀由快到慢的顺序是___________ 。
(4)已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) ΔH = +234.1 kJ/mol
C(s)+O2(g)=CO2(g) ΔH = -393.5 kJ/mol。
根据以上信息,则Fe(s)与O2(g)反应生成Fe2O3(s)的热化学方程式是__________ 。
Ⅱ.经研究发现青铜器的腐蚀竟然都跟原电池有关。如图为青铜器在潮湿环境中发生电化学腐蚀的示意图。
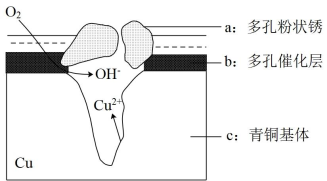
(1)腐蚀过程中,负极是___________ (填图中字母"a"或"b"或"c");
(2)环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为___________ 。
(3)若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为___________ L(标准状况)。

(1)K 与 M 连接时钢铁桥墩的电化学防护方法为
(2)K与N连接时,钢铁桥墩为
(3)下列各情况中,Fe片腐蚀由快到慢的顺序是

(4)已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) ΔH = +234.1 kJ/mol
C(s)+O2(g)=CO2(g) ΔH = -393.5 kJ/mol。
根据以上信息,则Fe(s)与O2(g)反应生成Fe2O3(s)的热化学方程式是
Ⅱ.经研究发现青铜器的腐蚀竟然都跟原电池有关。如图为青铜器在潮湿环境中发生电化学腐蚀的示意图。

(1)腐蚀过程中,负极是
(2)环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为
(3)若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为
您最近一年使用:0次
2021-06-17更新
|
180次组卷
|
2卷引用:黑龙江省鹤岗市第一中学2020-2021学年高一6月月考化学试题
4 . (1)在恒容的密闭容器中,气体X与气体Y反应可生成气体Z,反应过程中,X、Y、Z三种气体的浓度(c)随时间(t)的变化关系如图_______ ,若t0=10s,用X表示的该反应速率为_______ ;若向容器中充入He,该反应速率_______ (填“加快”或“减慢”或“不变”)
(2)一种新型催化剂用于NO和CO的反应:2NO+2CO⇌2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
①a=_______ 。
②能验证温度对化学反应速率规律的是实验_______ (填实验序号)。
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线_______ (填“甲”或“乙”)。_______ (任写一条)。
(3)已知:P(s,白磷)=P(s,黑磷),每1molP(s,白磷)发生反应,放出39.3kJ的热量,P(s,白磷)=P(s,红磷),每1molP(s,白磷)发生反应,放出17.6kJ的热量,由此推知,其中最稳定的磷单质是_______ (填“黑磷”或“红磷”)。
(4)丙烷氧气燃料电池在碱性电解质环境中放电时丙烷在_______ (填“正”或“负”)极发生的电极反应式为_______ ,电路中每转移0.4mol电子,标准状况下消耗O2的体积是_______ L。

(2)一种新型催化剂用于NO和CO的反应:2NO+2CO⇌2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
| 实验编号 | t(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.2×10−3 | 5.80×10−3 | 82 |
| Ⅱ | 280 | 1.2×10−3 | b | 124 |
| Ⅲ | 350 | a | 5.80×10−3 | 82 |
②能验证温度对化学反应速率规律的是实验
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线

(3)已知:P(s,白磷)=P(s,黑磷),每1molP(s,白磷)发生反应,放出39.3kJ的热量,P(s,白磷)=P(s,红磷),每1molP(s,白磷)发生反应,放出17.6kJ的热量,由此推知,其中最稳定的磷单质是
(4)丙烷氧气燃料电池在碱性电解质环境中放电时丙烷在
您最近一年使用:0次
2021-06-15更新
|
385次组卷
|
4卷引用:四川省广安友谊中学高2020-2021学年高一下学期6月月考化学试题
四川省广安友谊中学高2020-2021学年高一下学期6月月考化学试题天津市第四十三中学2020-2021学年高一下学期期末考试化学试题(已下线)重难点04 化学反应速率及平衡图表问题的分析 平衡状态的判断-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(天津专用)(已下线)专题03 化学反应的速率与限度-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(天津专用)
解题方法
5 . CH4—CO2催化重整是减少温室气体排放的重要途径。已知以下的热化学反应方程式:
C(s)+2H2(g)=CH4(g) △H1=-75kJ/mol
C(s)+O2(g)=CO2(g) △H2=-394kJ/mol
C(s)+ O2(g)=CO(g) △H3=-111kJ/mol
O2(g)=CO(g) △H3=-111kJ/mol
写出催化重整反应CH4(g)和CO2(g)生成CO(g)和H2(g)的热化学方程式:___________ 。
C(s)+2H2(g)=CH4(g) △H1=-75kJ/mol
C(s)+O2(g)=CO2(g) △H2=-394kJ/mol
C(s)+
 O2(g)=CO(g) △H3=-111kJ/mol
O2(g)=CO(g) △H3=-111kJ/mol写出催化重整反应CH4(g)和CO2(g)生成CO(g)和H2(g)的热化学方程式:
您最近一年使用:0次
6 . 已知: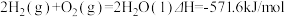 ①
①
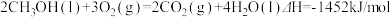 ②
②
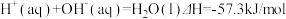
下列说法正确的是
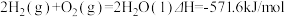 ①
①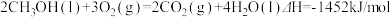 ②
②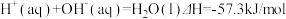
下列说法正确的是
| A.H2(g)的燃烧热为571.6kJ/mol |
| B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
C.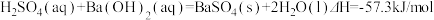 |
D.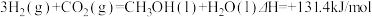 |
您最近一年使用:0次
2021-06-14更新
|
309次组卷
|
3卷引用:四川省南充西南大学实验学校2020-2021学年高一下学期6月月考化学试题
四川省南充西南大学实验学校2020-2021学年高一下学期6月月考化学试题(已下线)第一章 第三节 化学反应热的计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)辽宁省大石桥市第三高级中学等三校2022-2023学年高一下学期5月期中联考化学试题
解题方法
7 . 断开1molAB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称A-B键的键能E:
请回答下列问题:
(1)如图表示某反应的能量变化关系,则此反应_______ (填“吸热”或“放热”)反应,其中∆H=_______ (用含有a、b的关系式表示)

(2)若图中表示反应2H2(g)+O2(g)=2H2O(g) ∆H=-241.8kJ·mol-1,x=_______ ;若忽略温度和压强对反应热的影响,当反应中有1mol电子转移时,反应的热量变化为_______ 。
(3)处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S。
已知:2CO(g)+O2(g)=2CO2(g) ∆H=-283.0kJ·mol-1
S(s)+O2(g)=SO2(g) ∆H=-296.0kJ·mol-1
写出CO和SO2转化为单质硫的反应热化学方程式是_______ 。
| 化学键 | H—H | Cl—Cl | O=O | C—Cl | C—H | O—H | H—Cl |
| E/KJ·mol-1 | 436 | 247 | x | 330 | 413 | 463 | 431 |
(1)如图表示某反应的能量变化关系,则此反应

(2)若图中表示反应2H2(g)+O2(g)=2H2O(g) ∆H=-241.8kJ·mol-1,x=
(3)处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S。
已知:2CO(g)+O2(g)=2CO2(g) ∆H=-283.0kJ·mol-1
S(s)+O2(g)=SO2(g) ∆H=-296.0kJ·mol-1
写出CO和SO2转化为单质硫的反应热化学方程式是
您最近一年使用:0次
8 . 分别填空(1)已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1
写出FeO(s)被CO还原成Fe和CO2的热化学方程式___________
(2)书写下列物质的电子式:NH4Cl___________ HClO___________ Ca(OH)2 ___________ Na2O2 ___________
(3)将Mg、Cu组成的2.64g混合物投入适量稀硝酸中恰好完全反应,并收集还原产物NO气体(还原产物只有一种)。然后向反应后的溶液中加入一定量NaOH溶液,金属离子恰好沉淀完全,沉淀质量为4.68g,则反应过程中收集到NO气体(标况下)体积为___________
(4)在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出 650kJ的热量,反应的热化学方程式为___________
(5)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为___________
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1
写出FeO(s)被CO还原成Fe和CO2的热化学方程式
(2)书写下列物质的电子式:NH4Cl
(3)将Mg、Cu组成的2.64g混合物投入适量稀硝酸中恰好完全反应,并收集还原产物NO气体(还原产物只有一种)。然后向反应后的溶液中加入一定量NaOH溶液,金属离子恰好沉淀完全,沉淀质量为4.68g,则反应过程中收集到NO气体(标况下)体积为
(4)在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出 650kJ的热量,反应的热化学方程式为
(5)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为
您最近一年使用:0次
解题方法
9 . 根据能量变化示意图,下列说法不正确的是
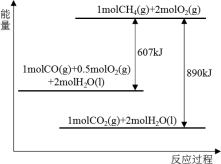

| A.2molCO(g)与1molO2(g)完全反应生成2molCO2(g)时要释放566kJ的能量 |
| B.1molCH4(g)与2molO2(g)具有的总能量高于1molCO2(g)与2molH2O(l) |
| C.1molCH4(g)完全燃烧生成气态水时释放的能量小于890kJ |
| D.16kg液化天然气完全燃烧释放的能量为890000kJ |
您最近一年使用:0次
解题方法
10 . 大气中SO2、H2S的资源化利用具有重要意义。回答下列问题:
(1)土壤中的微生物可将大气中的H2S经两步反应氧化成SO ,两步反应的能量变化如图所示。则1molH2S(g)全部氧化成SO
,两步反应的能量变化如图所示。则1molH2S(g)全部氧化成SO (aq)的热化学方程式为
(aq)的热化学方程式为___ 。
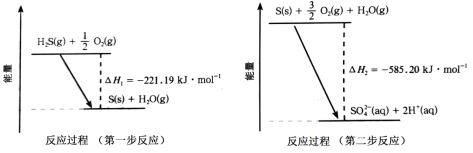
(2)如图甲所示为质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。
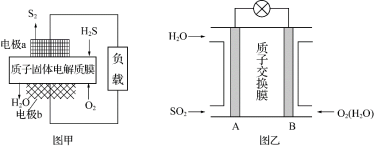
b电极为___ 极(填“正”或“负”),其电极反应式为___ 。
(3)图乙为SO2—空气质子交换膜燃料电池,可以利用大气所含的SO2快速启动。
①该电池中质子的流动方向为___ (填“从A到B”或“从B到A”)。
②负极的电极反应式为___ 。
③用该电池处理32gSO2,理论上需要消耗O2的体积为___ L(标准状况)。
(1)土壤中的微生物可将大气中的H2S经两步反应氧化成SO
 ,两步反应的能量变化如图所示。则1molH2S(g)全部氧化成SO
,两步反应的能量变化如图所示。则1molH2S(g)全部氧化成SO (aq)的热化学方程式为
(aq)的热化学方程式为
(2)如图甲所示为质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。

b电极为
(3)图乙为SO2—空气质子交换膜燃料电池,可以利用大气所含的SO2快速启动。
①该电池中质子的流动方向为
②负极的电极反应式为
③用该电池处理32gSO2,理论上需要消耗O2的体积为
您最近一年使用:0次



