名校
1 . 完成下列小题
(1)①下列说法不正确的是_____ (填序号)。
A.因为二氧化硅的相对分子质量比二氧化碳大,所以沸点: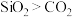
B.稳定性: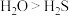 ,水分子更稳定的原因是水分子间存在氢键
,水分子更稳定的原因是水分子间存在氢键
C. 与CO为等电子体,结构相似
与CO为等电子体,结构相似
②复兴号高铁车体材质用到Mn、Co等元素。Mn的一种配合物化学式为[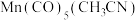 ],下列说法正确的是
],下列说法正确的是_____ (填字母标号)。
A. 与Mn原子配位时,提供孤电子对的是C原子
与Mn原子配位时,提供孤电子对的是C原子
B.Mn原子的配位数为6
C. 中C原子的杂化类型为
中C原子的杂化类型为 、
、
(2)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,下列物质中,属于顺磁性物质的是_____(填标号)。
(3)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是_____ (填标号);第三电离能的变化图是_____ (填标号)。

(4)锰与镓同周期, 催化
催化 分解:
分解: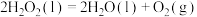
 ,其反应机理如图:
,其反应机理如图:

已知反应Ⅱ为: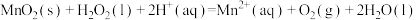
 ,写出反应Ⅰ的热化学方程式
,写出反应Ⅰ的热化学方程式_____ (焓变用 和
和 表示):。
表示):。
(5)单层石墨被称为石墨烯。最近有研究发现Li原子可以以可逆的方式渗入两层石墨烯的层间并规则分布,这是一种潜在的蓄电池材料。如图中所示为一种可能的结构,锂原子以黑球表示,请在图中画出这种材料的一个晶胞(以Li原子顶点)_____ ,并指出该材料中锂原子与碳原子的数量之比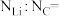
_____ 。
(1)①下列说法不正确的是
A.因为二氧化硅的相对分子质量比二氧化碳大,所以沸点:
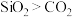
B.稳定性:
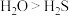 ,水分子更稳定的原因是水分子间存在氢键
,水分子更稳定的原因是水分子间存在氢键C.
 与CO为等电子体,结构相似
与CO为等电子体,结构相似②复兴号高铁车体材质用到Mn、Co等元素。Mn的一种配合物化学式为[
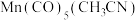 ],下列说法正确的是
],下列说法正确的是A.
 与Mn原子配位时,提供孤电子对的是C原子
与Mn原子配位时,提供孤电子对的是C原子B.Mn原子的配位数为6
C.
 中C原子的杂化类型为
中C原子的杂化类型为 、
、
(2)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,下列物质中,属于顺磁性物质的是_____(填标号)。
A. | B. | C. | D. |
(3)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是

(4)锰与镓同周期,
 催化
催化 分解:
分解: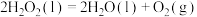
 ,其反应机理如图:
,其反应机理如图:
已知反应Ⅱ为:
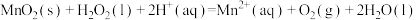
 ,写出反应Ⅰ的热化学方程式
,写出反应Ⅰ的热化学方程式 和
和 表示):。
表示):。(5)单层石墨被称为石墨烯。最近有研究发现Li原子可以以可逆的方式渗入两层石墨烯的层间并规则分布,这是一种潜在的蓄电池材料。如图中所示为一种可能的结构,锂原子以黑球表示,请在图中画出这种材料的一个晶胞(以Li原子顶点)
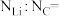

您最近一年使用:0次
名校
解题方法
2 . 利用工业废气中的 合成基础化工原料甲醇
合成基础化工原料甲醇 ,是
,是 资源化的重要方法,涉及的主要化学反应有:
资源化的重要方法,涉及的主要化学反应有:
反应ⅰ: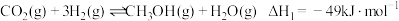
反应ⅱ: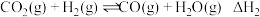
(1)反应ⅱ的化学平衡常数表达式为_______ 。
(2)已知: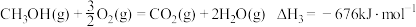 。利用
。利用 和
和 计算
计算 时,还需要利用
时,还需要利用_______ 反应的 。通过计算得出
。通过计算得出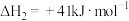 。
。
(3)控制反应条件(均使用了催化剂),研究投料比(反应物的物质的量之比)、压强、温度对反应体系的影响。
产率 和选择性S的定义:
和选择性S的定义: ,
,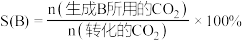
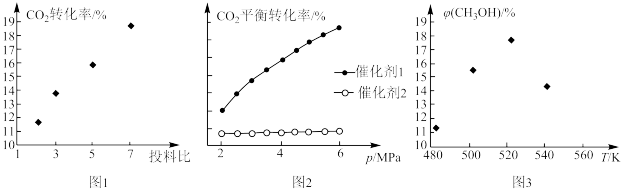
①图1中,投料比是指_______ (填“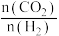 ”或“
”或“ ”);当投料比为5时,
”);当投料比为5时, 的转化率约为16%,
的转化率约为16%,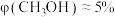 ,则
,则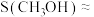
_______ 。
②图2中,在催化剂2的作用下,发生的主要反应是_______ (填“ⅰ”或“ⅱ”)。
③图3中,当温度高于 时,甲醇的产率随温度升高而减小,原因可能有
时,甲醇的产率随温度升高而减小,原因可能有_______ (写出2条)。
(4)一定条件下,向体积为 的恒容密闭容器中通入
的恒容密闭容器中通入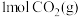 和
和 ,发生上述反应,t秒后达到平衡。此时容器中
,发生上述反应,t秒后达到平衡。此时容器中 为
为 ,
, 为
为 。
。
①平衡后 的浓度为
的浓度为_______  (用含a、b、V的代数式表示,下同)。
(用含a、b、V的代数式表示,下同)。
②用 的浓度变化表示
的浓度变化表示 秒内反应ⅱ的反应速率,
秒内反应ⅱ的反应速率,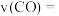
_______  。
。
③该条件下反应ⅰ的化学平衡常数为_______ 。
 合成基础化工原料甲醇
合成基础化工原料甲醇 ,是
,是 资源化的重要方法,涉及的主要化学反应有:
资源化的重要方法,涉及的主要化学反应有:反应ⅰ:
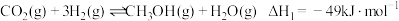
反应ⅱ:
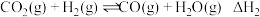
(1)反应ⅱ的化学平衡常数表达式为
(2)已知:
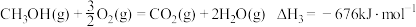 。利用
。利用 和
和 计算
计算 时,还需要利用
时,还需要利用 。通过计算得出
。通过计算得出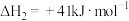 。
。(3)控制反应条件(均使用了催化剂),研究投料比(反应物的物质的量之比)、压强、温度对反应体系的影响。
产率
 和选择性S的定义:
和选择性S的定义: ,
,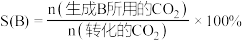

①图1中,投料比是指
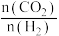 ”或“
”或“ ”);当投料比为5时,
”);当投料比为5时, 的转化率约为16%,
的转化率约为16%,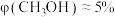 ,则
,则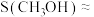
②图2中,在催化剂2的作用下,发生的主要反应是
③图3中,当温度高于
 时,甲醇的产率随温度升高而减小,原因可能有
时,甲醇的产率随温度升高而减小,原因可能有(4)一定条件下,向体积为
 的恒容密闭容器中通入
的恒容密闭容器中通入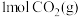 和
和 ,发生上述反应,t秒后达到平衡。此时容器中
,发生上述反应,t秒后达到平衡。此时容器中 为
为 ,
, 为
为 。
。①平衡后
 的浓度为
的浓度为 (用含a、b、V的代数式表示,下同)。
(用含a、b、V的代数式表示,下同)。②用
 的浓度变化表示
的浓度变化表示 秒内反应ⅱ的反应速率,
秒内反应ⅱ的反应速率,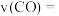
 。
。③该条件下反应ⅰ的化学平衡常数为
您最近一年使用:0次
2023-01-06更新
|
195次组卷
|
3卷引用:北京市丰台区2022-2023学年高二上学期期末考试化学试题
名校
解题方法
3 . 油气开采、石油化工、煤化工等行业的废气中均含有硫化氢,需要将其回收处理并加以利用。
Ⅰ.高温热分解法: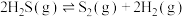
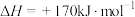
(1)该反应的化学平衡常数表达式为_______ 。
(2)升高温度,该反应的化学平衡常数_______ (填“变大”“变小”或“不变”)。
(3)工业上,通常在等温、等压条件下将 与Ar的混合气体通入反应器,发生
与Ar的混合气体通入反应器,发生 热分解反应,达到平衡状态后,若继续向反应器中通入Ar,
热分解反应,达到平衡状态后,若继续向反应器中通入Ar, 的平衡转化率会
的平衡转化率会_______ (填“增大”“减小”或“不变”),利用平衡常数与浓度商的关系说明理由:_______ 。
Ⅱ.克劳斯法:
已知:
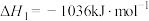

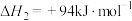
(4)用克劳斯法处理 ,若生成1mol
,若生成1mol ,放出热量
,放出热量_______ kJ。
(5)用克劳斯法处理 时,研究人员对反应条件对
时,研究人员对反应条件对 产率的影响进行了如下研究。
产率的影响进行了如下研究。
①其他条件相同时,相同时间内, 产率随温度的变化如图1所示。由图1可见,随着温度升高,
产率随温度的变化如图1所示。由图1可见,随着温度升高, 产率先增大后减小,原因是
产率先增大后减小,原因是_______ 。

②其他条件相同时,相同时间内, 产率随
产率随 值的变化如图2所示。
值的变化如图2所示。 值过高不利于提高
值过高不利于提高 产率,可能的原因是
产率,可能的原因是_______ 。

Ⅰ.高温热分解法:
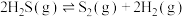
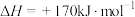
(1)该反应的化学平衡常数表达式为
(2)升高温度,该反应的化学平衡常数
(3)工业上,通常在等温、等压条件下将
 与Ar的混合气体通入反应器,发生
与Ar的混合气体通入反应器,发生 热分解反应,达到平衡状态后,若继续向反应器中通入Ar,
热分解反应,达到平衡状态后,若继续向反应器中通入Ar, 的平衡转化率会
的平衡转化率会Ⅱ.克劳斯法:

已知:

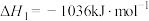

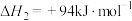
(4)用克劳斯法处理
 ,若生成1mol
,若生成1mol ,放出热量
,放出热量(5)用克劳斯法处理
 时,研究人员对反应条件对
时,研究人员对反应条件对 产率的影响进行了如下研究。
产率的影响进行了如下研究。①其他条件相同时,相同时间内,
 产率随温度的变化如图1所示。由图1可见,随着温度升高,
产率随温度的变化如图1所示。由图1可见,随着温度升高, 产率先增大后减小,原因是
产率先增大后减小,原因是
②其他条件相同时,相同时间内,
 产率随
产率随 值的变化如图2所示。
值的变化如图2所示。 值过高不利于提高
值过高不利于提高 产率,可能的原因是
产率,可能的原因是
您最近一年使用:0次
2023-01-06更新
|
781次组卷
|
6卷引用:北京海淀区2022-2023学年高二上学期期末考试化学试题
名校
解题方法
4 . 生产钛的方法之一是将金红石( )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。 转化为
转化为 有直接氯化法和碳氯化法,相关能量示意图如下所示。下列说法
有直接氯化法和碳氯化法,相关能量示意图如下所示。下列说法不正确 的是
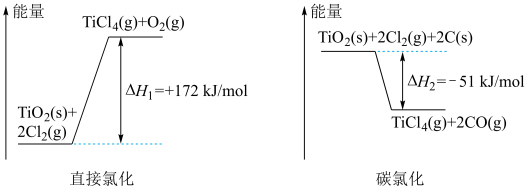
 )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。 转化为
转化为 有直接氯化法和碳氯化法,相关能量示意图如下所示。下列说法
有直接氯化法和碳氯化法,相关能量示意图如下所示。下列说法
| A.将反应物固体粉碎可以加快直接氯化,碳氯化的反应速率 |
B.可推知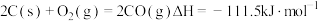 |
| C.判断直接氯化反应能否自发进行需要综合考虑体系的焓变和熵变 |
D.对于碳氯化反应,温度升高,平衡时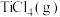 的产率变小 的产率变小 |
您最近一年使用:0次
2023-01-06更新
|
191次组卷
|
2卷引用:北京市朝阳区2022-2023学年高二上学期期末考试化学试题
名校
解题方法
5 . 合成氨是人类科学技术上的一项重大突破,氨的用途广泛。
已知:
 kJ·mol
kJ·mol

 kJ·mol
kJ·mol


(1)
_______ kJ·mol-1(用含a、b的代数式表示)
(2)目前工业合成氨的主要方法是HaberBosch法:通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
①该反应放热,但仍选择较高温度,原因是_______ 。
②理论上,为了增大平衡时 的转化率,可采取的措施是
的转化率,可采取的措施是_______ (写出1条)。
③将物质的量之比为1∶3的 和
和 充入2 L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
充入2 L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
该条件下 的转化率为
的转化率为_______ ,平衡常数
_______ (可用分数表示)。
④若按以下浓度投料,其它反应条件与③相同,起始时反应进行的方向为_______ (填“正向”、“逆向”或“无法判断”)。
(3)图1是某压强下 和
和 按物质的量之比1∶3投料进行反应,反应混合物中
按物质的量之比1∶3投料进行反应,反应混合物中 的物质的量分数随温度的变化曲线。I是平衡时的曲线,II是不同温度下反应经过相同时间测得的曲线,下列说法正确的是
的物质的量分数随温度的变化曲线。I是平衡时的曲线,II是不同温度下反应经过相同时间测得的曲线,下列说法正确的是_______ 。
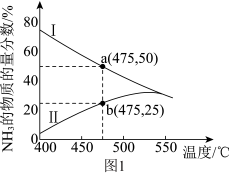
a.图中a点,容器内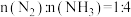
b.图中b点,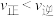
c.400~530℃,II中 的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大
的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大
(4)电化学气敏传感器可用于检测环境中 的含量,其工作原理如图2所示。
的含量,其工作原理如图2所示。

①反应消耗的 与
与 的物质的量之比为
的物质的量之比为_______ 。
②a极的电极反应式为_______ 。
已知:

 kJ·mol
kJ·mol

 kJ·mol
kJ·mol


(1)

(2)目前工业合成氨的主要方法是HaberBosch法:通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
①该反应放热,但仍选择较高温度,原因是
②理论上,为了增大平衡时
 的转化率,可采取的措施是
的转化率,可采取的措施是③将物质的量之比为1∶3的
 和
和 充入2 L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
充入2 L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:| 物质 |  |  |  |
平衡时物质的量 | 0.2 | 0.6 | 0.2 |
 的转化率为
的转化率为
④若按以下浓度投料,其它反应条件与③相同,起始时反应进行的方向为
| 物质 |  |  |  |
起始浓度(mol·L ) ) | 0.5 | 1.5 | 0.5 |
 和
和 按物质的量之比1∶3投料进行反应,反应混合物中
按物质的量之比1∶3投料进行反应,反应混合物中 的物质的量分数随温度的变化曲线。I是平衡时的曲线,II是不同温度下反应经过相同时间测得的曲线,下列说法正确的是
的物质的量分数随温度的变化曲线。I是平衡时的曲线,II是不同温度下反应经过相同时间测得的曲线,下列说法正确的是
a.图中a点,容器内
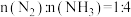
b.图中b点,
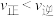
c.400~530℃,II中
 的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大
的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大(4)电化学气敏传感器可用于检测环境中
 的含量,其工作原理如图2所示。
的含量,其工作原理如图2所示。
①反应消耗的
 与
与 的物质的量之比为
的物质的量之比为②a极的电极反应式为
您最近一年使用:0次
名校
解题方法
6 . 两种方法对某工业废气(主要成分为 )进行回收利用。
)进行回收利用。
(1)自驱动光电催化法,原理如图,步骤如下:

Ⅰ.常温下,左池中的电解液是稀硫酸和少量KI的混合溶液,右池中的是稀硫酸。
Ⅱ.持续光照条件下, 表面会产生光生空穴(
表面会产生光生空穴( )和光生电子,光生空穴会氧化
)和光生电子,光生空穴会氧化 :
: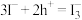
左池溶液逐渐由无色变为棕色时,通入工业废气,溶液突然褪色变混,停止通气,滤出固体,待溶液由无色再次变棕时,再次通入工业废气,并不断循环。
Ⅲ.实验过程中,右池持续通入 。
。
①结合化学用语解释Ⅱ中溶液颜色变化的原因:_________ 。
②结合化学用语分析实验中右池溶液pH的变化趋势并说明理由:_________ 。
③装置中总反应的化学方程式是_________ 。
④实验中S的产率和电解效率接近100%。但 的电解效率明显偏小,可能的原因有
的电解效率明显偏小,可能的原因有_________ (写出两点)。电解效率 的定义:
的定义:
(2)热解 法制
法制 。将
。将 和
和 的混合气体导入石英管反应器热解(一边进料,另一边出料),发生反应:
的混合气体导入石英管反应器热解(一边进料,另一边出料),发生反应: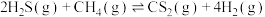 。
。
①该反应可看成由反应Ⅰ和反应Ⅱ分两步进行,并且第Ⅱ步是决速步。画出由反应原料经两步生成产物的反应过程能量示意图_________ 。

反应Ⅰ:
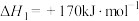
反应Ⅱ: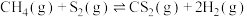
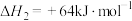
②常压下,按体积之比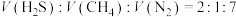 投料,不同温度时,其他条件不变,反应相同时间后,测得
投料,不同温度时,其他条件不变,反应相同时间后,测得 和
和 体积分数(
体积分数( )如下表:
)如下表:
ⅰ.1150℃时, 的体积分数是
的体积分数是_________ 。
ⅱ.在950℃~1150℃范围内, 的体积分数随温度升高会发生变化,写出该变化规律并分析原因
的体积分数随温度升高会发生变化,写出该变化规律并分析原因_________ 。
(3)对比上述两种方法,说明哪种方法更具优势并说明理由:_________ 。
 )进行回收利用。
)进行回收利用。(1)自驱动光电催化法,原理如图,步骤如下:

Ⅰ.常温下,左池中的电解液是稀硫酸和少量KI的混合溶液,右池中的是稀硫酸。
Ⅱ.持续光照条件下,
 表面会产生光生空穴(
表面会产生光生空穴( )和光生电子,光生空穴会氧化
)和光生电子,光生空穴会氧化 :
: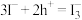
左池溶液逐渐由无色变为棕色时,通入工业废气,溶液突然褪色变混,停止通气,滤出固体,待溶液由无色再次变棕时,再次通入工业废气,并不断循环。
Ⅲ.实验过程中,右池持续通入
 。
。①结合化学用语解释Ⅱ中溶液颜色变化的原因:
②结合化学用语分析实验中右池溶液pH的变化趋势并说明理由:
③装置中总反应的化学方程式是
④实验中S的产率和电解效率接近100%。但
 的电解效率明显偏小,可能的原因有
的电解效率明显偏小,可能的原因有 的定义:
的定义:
(2)热解
 法制
法制 。将
。将 和
和 的混合气体导入石英管反应器热解(一边进料,另一边出料),发生反应:
的混合气体导入石英管反应器热解(一边进料,另一边出料),发生反应: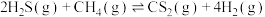 。
。①该反应可看成由反应Ⅰ和反应Ⅱ分两步进行,并且第Ⅱ步是决速步。画出由反应原料经两步生成产物的反应过程能量示意图

反应Ⅰ:

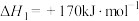
反应Ⅱ:
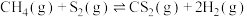
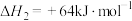
②常压下,按体积之比
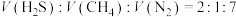 投料,不同温度时,其他条件不变,反应相同时间后,测得
投料,不同温度时,其他条件不变,反应相同时间后,测得 和
和 体积分数(
体积分数( )如下表:
)如下表:| 温度/℃ | 950 | 1000 | 1050 | 1100 | 1150 |
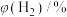 | 0.5 | 1.5 | 3.6 | 5.5 | 8.5 |
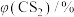 | 0.0 | 0.0 | 0.1 | 0.4 | 1.8 |
 的体积分数是
的体积分数是ⅱ.在950℃~1150℃范围内,
 的体积分数随温度升高会发生变化,写出该变化规律并分析原因
的体积分数随温度升高会发生变化,写出该变化规律并分析原因(3)对比上述两种方法,说明哪种方法更具优势并说明理由:
您最近一年使用:0次
名校
解题方法
7 . 以CO和 为原料合成甲醇是工业上的成熟方法,直接以
为原料合成甲醇是工业上的成熟方法,直接以 为原料生产甲醇是目前的研究热点。我国科学家用
为原料生产甲醇是目前的研究热点。我国科学家用 人工合成淀粉时,第一步就需要将
人工合成淀粉时,第一步就需要将 转化为甲醇。
转化为甲醇。
已知:①
 kJ·mol
kJ·mol
②
 kJ·mol
kJ·mol
③
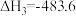 kJ·mol
kJ·mol
下列说法不正确 的是
 为原料合成甲醇是工业上的成熟方法,直接以
为原料合成甲醇是工业上的成熟方法,直接以 为原料生产甲醇是目前的研究热点。我国科学家用
为原料生产甲醇是目前的研究热点。我国科学家用 人工合成淀粉时,第一步就需要将
人工合成淀粉时,第一步就需要将 转化为甲醇。
转化为甲醇。已知:①

 kJ·mol
kJ·mol
②

 kJ·mol
kJ·mol
③

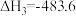 kJ·mol
kJ·mol
下列说法
A.若温度不变,反应①中生成1 mol  时,放出的热量大于90.5 kJ 时,放出的热量大于90.5 kJ |
B. 与 与 合成甲醇的热化学方程式为: 合成甲醇的热化学方程式为:  kJ·mol kJ·mol |
C.通过电解制 和选用高效催化剂,可降低 和选用高效催化剂,可降低 与 与 合成甲醇反应的焓变 合成甲醇反应的焓变 |
D.以 和 和 为原料合成甲醇,同时生成 为原料合成甲醇,同时生成 ,该反应需要吸收能量 ,该反应需要吸收能量 |
您最近一年使用:0次
2022-11-27更新
|
929次组卷
|
7卷引用:北京市东城区一六六中学2022-2023学年高三上学期期中考试化学试题
北京市东城区一六六中学2022-2023学年高三上学期期中考试化学试题北京市海淀区2021-2022学年高三上学期期中考试化学试题北京市第二十二中学2021-2022学年高三上学期12月阶段性测试理科化学试题(已下线)2023年北京卷高考真题变式题(选择题11-14)天津市静海区第一中学2021-2022学年高三上学期12月调研考试化学试题(已下线)考点17 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)化学反应的热效应
名校
解题方法
8 . 研究 的综合利用、实现
的综合利用、实现 资源化,是能源领域的重要发展方向。
资源化,是能源领域的重要发展方向。
(1)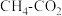 催化重整反应为
催化重整反应为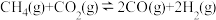 。
。
已知 ,
, 时,
时, 和
和 的燃烧热如下表:
的燃烧热如下表:
①该催化重整反应的
___________  。
。
②催化重整过程还存在积碳反应: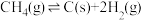 ,催化剂的活性会因积碳反应而降低。适当通入过量
,催化剂的活性会因积碳反应而降低。适当通入过量 可以有效缓解积碳,结合方程式解释其原因:
可以有效缓解积碳,结合方程式解释其原因:___________ 。
③相同时间内测得选用不同催化剂时 的转化率随反应温度的变化如图1所示:
的转化率随反应温度的变化如图1所示:
ⅰ、a点所处的状态___________ 化学平衡状态(填“是”或“不是”)。
ⅱ、 的转化率:
的转化率: ,原因是
,原因是___________ 。
(2)以二氧化钛表面覆盖的 为催化剂,可以将
为催化剂,可以将 和
和 直接转化成乙酸。
直接转化成乙酸。
①催化剂的催化效率与乙酸的生成速率随温度的变化关系如图2所示。 时,温度升高而乙酸的生成速率降低的原因是
时,温度升高而乙酸的生成速率降低的原因是___________ 。
②为了提高该反应中 的平衡转化率,可以采取的措施是
的平衡转化率,可以采取的措施是___________ (写出两种)。
(3)在电解质水溶液中, 可被电化学还原为
可被电化学还原为 。在三种不同催化剂(a、b、c)上
。在三种不同催化剂(a、b、c)上 电还原为
电还原为 的反应进程中(
的反应进程中( 被还原为
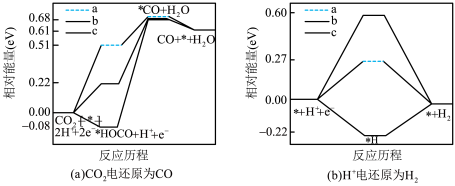
被还原为 的反应可同时发生),相对能量变化如图。由此判断,
的反应可同时发生),相对能量变化如图。由此判断, 电还原为
电还原为 从易到难的顺序为
从易到难的顺序为___________ (用a、b、c字母排序)。
 的综合利用、实现
的综合利用、实现 资源化,是能源领域的重要发展方向。
资源化,是能源领域的重要发展方向。(1)
 催化重整反应为
催化重整反应为 。
。已知
 ,
, 时,
时, 和
和 的燃烧热如下表:
的燃烧热如下表:| 可燃物 |  |  |  |
 |  |  |  |

 。
。②催化重整过程还存在积碳反应:
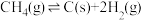 ,催化剂的活性会因积碳反应而降低。适当通入过量
,催化剂的活性会因积碳反应而降低。适当通入过量 可以有效缓解积碳,结合方程式解释其原因:
可以有效缓解积碳,结合方程式解释其原因:③相同时间内测得选用不同催化剂时
 的转化率随反应温度的变化如图1所示:
的转化率随反应温度的变化如图1所示:ⅰ、a点所处的状态
ⅱ、
 的转化率:
的转化率: ,原因是
,原因是
(2)以二氧化钛表面覆盖的
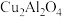 为催化剂,可以将
为催化剂,可以将 和
和 直接转化成乙酸。
直接转化成乙酸。①催化剂的催化效率与乙酸的生成速率随温度的变化关系如图2所示。
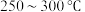 时,温度升高而乙酸的生成速率降低的原因是
时,温度升高而乙酸的生成速率降低的原因是②为了提高该反应中
 的平衡转化率,可以采取的措施是
的平衡转化率,可以采取的措施是(3)在电解质水溶液中,
 可被电化学还原为
可被电化学还原为 。在三种不同催化剂(a、b、c)上
。在三种不同催化剂(a、b、c)上 电还原为
电还原为 的反应进程中(
的反应进程中( 被还原为
被还原为 的反应可同时发生),相对能量变化如图。由此判断,
的反应可同时发生),相对能量变化如图。由此判断, 电还原为
电还原为 从易到难的顺序为
从易到难的顺序为
您最近一年使用:0次
2022-11-07更新
|
366次组卷
|
2卷引用:北京市北京师范大学附属实验中学2022-2023学年高三上学期期中考试化学试题
名校
9 . 将 富集、活化、转化为具有高附加值的化学品对实现碳中和有重要意义。
富集、活化、转化为具有高附加值的化学品对实现碳中和有重要意义。
(1)一种富集烟气中 的方法示意图如下:
的方法示意图如下:

写出“解吸”过程产生 的化学方程式:
的化学方程式:_______ 。
(2) 性质稳定,使其活化是实现转化的重要前提。
性质稳定,使其活化是实现转化的重要前提。
①使用过渡金属作催化剂,提供空轨道接受_______ (填“C”或“O”)原子的孤电子对,破坏 的结构使其活化。
的结构使其活化。
②采用电化学、光化学等手段,使
_______ (填“提供”或“接受”)电子转化为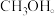
(3) 与
与 在催化剂作用下可转化为
在催化剂作用下可转化为 ,体系中发生的主要反应如下:
,体系中发生的主要反应如下:
i.
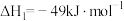
ii.

研究表明,CO与 也能生成
也能生成 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:_______ 。
(4)在催化剂作用下,将1mol 、3mol
、3mol 投入反应器,反应温度对
投入反应器,反应温度对 平衡转化率
平衡转化率 、
、 选择性
选择性 的影响如下。
的影响如下。
已知:

① 随温度升高逐渐增大、
随温度升高逐渐增大、 随温度升高逐渐减小的原因是
随温度升高逐渐减小的原因是_______ 。
②在240℃达到平衡时,体系_______ (填“吸收”或“放出”)的热量为_______ kJ(除了反应ⅰ和ⅱ不考虑其他反应)。
 富集、活化、转化为具有高附加值的化学品对实现碳中和有重要意义。
富集、活化、转化为具有高附加值的化学品对实现碳中和有重要意义。(1)一种富集烟气中
 的方法示意图如下:
的方法示意图如下:
写出“解吸”过程产生
 的化学方程式:
的化学方程式:(2)
 性质稳定,使其活化是实现转化的重要前提。
性质稳定,使其活化是实现转化的重要前提。①使用过渡金属作催化剂,提供空轨道接受
 的结构使其活化。
的结构使其活化。②采用电化学、光化学等手段,使

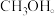
(3)
 与
与 在催化剂作用下可转化为
在催化剂作用下可转化为 ,体系中发生的主要反应如下:
,体系中发生的主要反应如下:i.

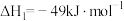
ii.


研究表明,CO与
 也能生成
也能生成 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:(4)在催化剂作用下,将1mol
 、3mol
、3mol 投入反应器,反应温度对
投入反应器,反应温度对 平衡转化率
平衡转化率 、
、 选择性
选择性 的影响如下。
的影响如下。已知:


①
 随温度升高逐渐增大、
随温度升高逐渐增大、 随温度升高逐渐减小的原因是
随温度升高逐渐减小的原因是②在240℃达到平衡时,体系
您最近一年使用:0次
2022-11-04更新
|
215次组卷
|
3卷引用:北京市朝阳区2022-2023学年高三上学期期中考试化学试题
名校
10 . 2022北京冬奥会采用氢气作为火炬燃料,选择氢能汽车作为赛事交通服务用车,充分体现了绿色奥运的理念。已知:
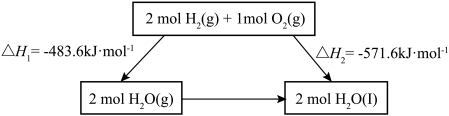
下列说法不正确 的是

下列说法
| A.氢气既可以通过燃烧反应提供热能,也可以设计成燃料电池提供电能 |
B. 的过程中, 的过程中, , , |
C.断裂2mol 和1mol 和1mol 中化学键所需能量大于断裂2mol 中化学键所需能量大于断裂2mol 中化学键所需能量 中化学键所需能量 |
D.化学反应的 ,只与反应体系的始态和终态有关,与反应途径无关 ,只与反应体系的始态和终态有关,与反应途径无关 |
您最近一年使用:0次
2022-11-04更新
|
615次组卷
|
9卷引用:北京市朝阳区2022-2023学年高三上学期期中考试化学试题



