名校
1 . Cl2是一种重要的化工原料,以HCl为原料,用O2氧化制取Cl2,可提高效益,减少污染。反应如下:
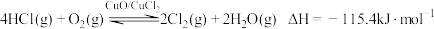
上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。
其基本原理如下图所示:
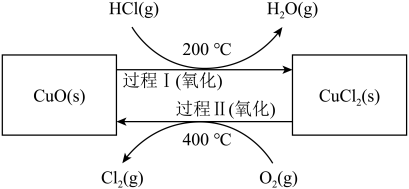
过程Ⅰ的反应为: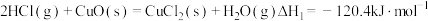
(1)用电子式表示HCl的形成过程_______ 。
(2)过程Ⅱ反应的热化学方程式为_______ 。
(3)过程Ⅰ流出的气体通过稀NaOH溶液(含少量酚酞)进行检测,氯化初期主要为不含HCl的气体,判断氧化结束时溶液的现象为_______ 。
(4)相同条件下,若将氯化温度升高到300℃,溶液中出现上述现象的时间将缩短,其原因为_______ 。
(5)实验测得在不同压强下,总反应的HCl平衡转化率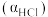 随温度变化的曲线如下图:
随温度变化的曲线如下图:
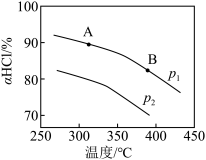
①平衡常数比较:K(A)_______ K(B)(填“>”、“<”或“=”,下同)。
②压强比较:p1_______ p2。理由是_______ 。
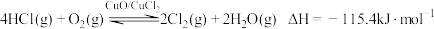
上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。
其基本原理如下图所示:

过程Ⅰ的反应为:
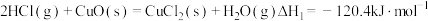
(1)用电子式表示HCl的形成过程
(2)过程Ⅱ反应的热化学方程式为
(3)过程Ⅰ流出的气体通过稀NaOH溶液(含少量酚酞)进行检测,氯化初期主要为不含HCl的气体,判断氧化结束时溶液的现象为
(4)相同条件下,若将氯化温度升高到300℃,溶液中出现上述现象的时间将缩短,其原因为
(5)实验测得在不同压强下,总反应的HCl平衡转化率
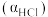 随温度变化的曲线如下图:
随温度变化的曲线如下图:
①平衡常数比较:K(A)
②压强比较:p1
您最近一年使用:0次
名校
2 . 中国科学家在淀粉人工光合成方面取得重大突破性进展,该实验方法首先将CO2催化还原为CH3OH。已知CO2催化加氢的主要反应有:
① CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH1=- 49.4 kJ/mol
CH3OH(g) + H2O(g) ΔH1=- 49.4 kJ/mol
② CO2(g) + H2(g) CO(g) + H2O(g) ΔH2=+ 41.2 kJ/mol
CO(g) + H2O(g) ΔH2=+ 41.2 kJ/mol
其他条件不变时,在相同时间内温度对CO2催化加氢的影响如下图。下列说法不正确 的是
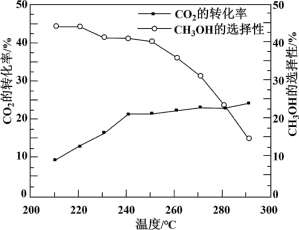
【注】CH3OH的选择性=
① CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) ΔH1=- 49.4 kJ/mol
CH3OH(g) + H2O(g) ΔH1=- 49.4 kJ/mol② CO2(g) + H2(g)
 CO(g) + H2O(g) ΔH2=+ 41.2 kJ/mol
CO(g) + H2O(g) ΔH2=+ 41.2 kJ/mol其他条件不变时,在相同时间内温度对CO2催化加氢的影响如下图。下列说法

【注】CH3OH的选择性=

A.CO(g) + 2H2(g) CH3OH(g) ΔH=- 90.6 kJ/mol CH3OH(g) ΔH=- 90.6 kJ/mol |
| B.使用催化剂,能降低反应的活化能,增大活化分子百分数 |
| C.其他条件不变,增大压强,有利于反应向生成CH3OH的方向进行 |
| D.220~240 ℃,升高温度,对反应②速率的影响比对反应①的小 |
您最近一年使用:0次
2023-02-16更新
|
613次组卷
|
13卷引用:北京市西城区2021~2022学年高三上学期期末考试化学试题
北京市西城区2021~2022学年高三上学期期末考试化学试题北京市第一六一中学2022-2023学年高三上学期10月月考化学试题北京市北京师范大学附属中学2022-2023学年高二上学期期中考试化学试题北京一零一中学2022-2023学年高三上学期统练六化学试题北京市第二十中学2022-2023学年高三下学期开学检测化学试题北京市一0一中学2022-2023学年高二下学期期中考试化学试题 北京市回民学校2023-2024学年高三上学期统练二化学试题北京市第十五中学2023-2024学年高二上学期期中考试化学试题北京市育才学校2023-2024学年高一上学期化学期中试题北京师范大学附属实验中学2023-2024学年高二下学期开学检测化学试题新疆阿克苏地区等2地新疆生产建设兵团第一师第二高级中学等2校2022-2023学年高三下学期2月月考化学试题福建省南平第一中学2023-2024学年高三上学期10月月考化学试题广东省广州市实验外语学校2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
3 .  会造成大气污染,在工业上采用多种方法进行处理。
会造成大气污染,在工业上采用多种方法进行处理。
Ⅰ.氧化法:烟气中的NO经 预处理后转化为
预处理后转化为 ,再用
,再用 悬浊液吸收
悬浊液吸收 。
。
已知:常温下, ,
, 。
。
(1)NO与 反应过程的能量变化如下:
反应过程的能量变化如下:
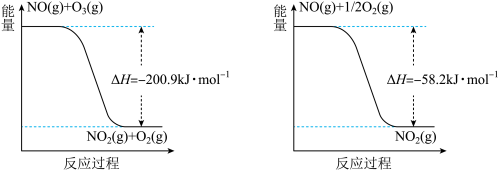
NO被 氧化的总反应是化合反应,该反应的热化学方程式为
氧化的总反应是化合反应,该反应的热化学方程式为_______ 。
(2)将 悬浊液静置,取上层清液,测得pH约为8,用化学用语解释原因为
悬浊液静置,取上层清液,测得pH约为8,用化学用语解释原因为_______ 。
(3)用 悬浊液吸收
悬浊液吸收 ,将其转化为
,将其转化为 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(4)在实际吸收 的过程中,通过向
的过程中,通过向 悬浊液中加入
悬浊液中加入 固体,提高
固体,提高 的吸收速率,从溶解平衡的角度解释其原因
的吸收速率,从溶解平衡的角度解释其原因_______ 。
Ⅱ.选择性非催化还原法:该反应不使用催化剂,但必须在高温有氧下利用 做还原剂与
做还原剂与 进行选择性反应:
进行选择性反应: 。不同温度(T)下,反应时间(t)与NO浓度的关系如下图所示。
。不同温度(T)下,反应时间(t)与NO浓度的关系如下图所示。
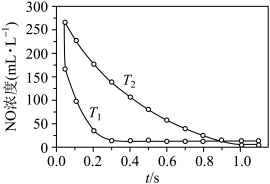
(5)判断该反应是吸热反应还是放热反应,并说明理由:_______ 。
(6)检测烟气中 含量的步骤如下:
含量的步骤如下:
i.将VL气样通入适量酸化的 溶液中,使
溶液中,使 完全被氧化为
完全被氧化为 ;
;
ii.加水稀释至100.00mL,量取20.00mL该溶液,与 标准溶液(过量)充分混合;
标准溶液(过量)充分混合;
iii.用 标准溶液滴定剩余的
标准溶液滴定剩余的 ,终点时消耗
,终点时消耗 。
。
滴定过程中发生下列反应:


烟气气样中 折合成
折合成 的含量为
的含量为_______  。
。
 会造成大气污染,在工业上采用多种方法进行处理。
会造成大气污染,在工业上采用多种方法进行处理。Ⅰ.氧化法:烟气中的NO经
 预处理后转化为
预处理后转化为 ,再用
,再用 悬浊液吸收
悬浊液吸收 。
。已知:常温下,
 ,
, 。
。(1)NO与
 反应过程的能量变化如下:
反应过程的能量变化如下:
NO被
 氧化的总反应是化合反应,该反应的热化学方程式为
氧化的总反应是化合反应,该反应的热化学方程式为(2)将
 悬浊液静置,取上层清液,测得pH约为8,用化学用语解释原因为
悬浊液静置,取上层清液,测得pH约为8,用化学用语解释原因为(3)用
 悬浊液吸收
悬浊液吸收 ,将其转化为
,将其转化为 ,该反应的化学方程式为
,该反应的化学方程式为(4)在实际吸收
 的过程中,通过向
的过程中,通过向 悬浊液中加入
悬浊液中加入 固体,提高
固体,提高 的吸收速率,从溶解平衡的角度解释其原因
的吸收速率,从溶解平衡的角度解释其原因Ⅱ.选择性非催化还原法:该反应不使用催化剂,但必须在高温有氧下利用
 做还原剂与
做还原剂与 进行选择性反应:
进行选择性反应: 。不同温度(T)下,反应时间(t)与NO浓度的关系如下图所示。
。不同温度(T)下,反应时间(t)与NO浓度的关系如下图所示。
(5)判断该反应是吸热反应还是放热反应,并说明理由:
(6)检测烟气中
 含量的步骤如下:
含量的步骤如下:i.将VL气样通入适量酸化的
 溶液中,使
溶液中,使 完全被氧化为
完全被氧化为 ;
;ii.加水稀释至100.00mL,量取20.00mL该溶液,与
 标准溶液(过量)充分混合;
标准溶液(过量)充分混合;iii.用
 标准溶液滴定剩余的
标准溶液滴定剩余的 ,终点时消耗
,终点时消耗 。
。滴定过程中发生下列反应:


烟气气样中
 折合成
折合成 的含量为
的含量为 。
。
您最近一年使用:0次
名校
解题方法
4 . 利用工业废气中的 合成基础化工原料甲醇
合成基础化工原料甲醇 ,是
,是 资源化的重要方法,涉及的主要化学反应有:
资源化的重要方法,涉及的主要化学反应有:
反应ⅰ: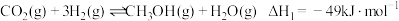
反应ⅱ: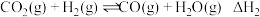
(1)反应ⅱ的化学平衡常数表达式为_______ 。
(2)已知: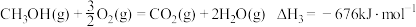 。利用
。利用 和
和 计算
计算 时,还需要利用
时,还需要利用_______ 反应的 。通过计算得出
。通过计算得出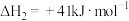 。
。
(3)控制反应条件(均使用了催化剂),研究投料比(反应物的物质的量之比)、压强、温度对反应体系的影响。
产率 和选择性S的定义:
和选择性S的定义: ,
,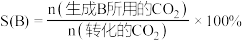
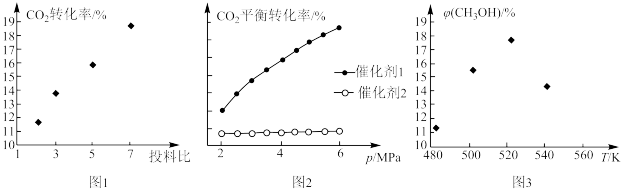
①图1中,投料比是指_______ (填“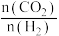 ”或“
”或“ ”);当投料比为5时,
”);当投料比为5时, 的转化率约为16%,
的转化率约为16%,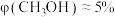 ,则
,则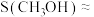
_______ 。
②图2中,在催化剂2的作用下,发生的主要反应是_______ (填“ⅰ”或“ⅱ”)。
③图3中,当温度高于 时,甲醇的产率随温度升高而减小,原因可能有
时,甲醇的产率随温度升高而减小,原因可能有_______ (写出2条)。
(4)一定条件下,向体积为 的恒容密闭容器中通入
的恒容密闭容器中通入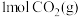 和
和 ,发生上述反应,t秒后达到平衡。此时容器中
,发生上述反应,t秒后达到平衡。此时容器中 为
为 ,
, 为
为 。
。
①平衡后 的浓度为
的浓度为_______  (用含a、b、V的代数式表示,下同)。
(用含a、b、V的代数式表示,下同)。
②用 的浓度变化表示
的浓度变化表示 秒内反应ⅱ的反应速率,
秒内反应ⅱ的反应速率,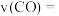
_______  。
。
③该条件下反应ⅰ的化学平衡常数为_______ 。
 合成基础化工原料甲醇
合成基础化工原料甲醇 ,是
,是 资源化的重要方法,涉及的主要化学反应有:
资源化的重要方法,涉及的主要化学反应有:反应ⅰ:
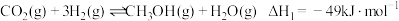
反应ⅱ:
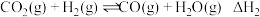
(1)反应ⅱ的化学平衡常数表达式为
(2)已知:
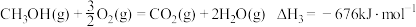 。利用
。利用 和
和 计算
计算 时,还需要利用
时,还需要利用 。通过计算得出
。通过计算得出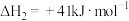 。
。(3)控制反应条件(均使用了催化剂),研究投料比(反应物的物质的量之比)、压强、温度对反应体系的影响。
产率
 和选择性S的定义:
和选择性S的定义: ,
,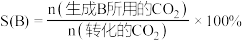

①图1中,投料比是指
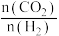 ”或“
”或“ ”);当投料比为5时,
”);当投料比为5时, 的转化率约为16%,
的转化率约为16%,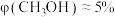 ,则
,则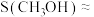
②图2中,在催化剂2的作用下,发生的主要反应是
③图3中,当温度高于
 时,甲醇的产率随温度升高而减小,原因可能有
时,甲醇的产率随温度升高而减小,原因可能有(4)一定条件下,向体积为
 的恒容密闭容器中通入
的恒容密闭容器中通入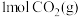 和
和 ,发生上述反应,t秒后达到平衡。此时容器中
,发生上述反应,t秒后达到平衡。此时容器中 为
为 ,
, 为
为 。
。①平衡后
 的浓度为
的浓度为 (用含a、b、V的代数式表示,下同)。
(用含a、b、V的代数式表示,下同)。②用
 的浓度变化表示
的浓度变化表示 秒内反应ⅱ的反应速率,
秒内反应ⅱ的反应速率,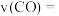
 。
。③该条件下反应ⅰ的化学平衡常数为
您最近一年使用:0次
2023-01-06更新
|
195次组卷
|
3卷引用:北京市丰台区2022-2023学年高二上学期期末考试化学试题
名校
解题方法
5 . 油气开采、石油化工、煤化工等行业的废气中均含有硫化氢,需要将其回收处理并加以利用。
Ⅰ.高温热分解法: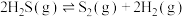
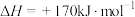
(1)该反应的化学平衡常数表达式为_______ 。
(2)升高温度,该反应的化学平衡常数_______ (填“变大”“变小”或“不变”)。
(3)工业上,通常在等温、等压条件下将 与Ar的混合气体通入反应器,发生
与Ar的混合气体通入反应器,发生 热分解反应,达到平衡状态后,若继续向反应器中通入Ar,
热分解反应,达到平衡状态后,若继续向反应器中通入Ar, 的平衡转化率会
的平衡转化率会_______ (填“增大”“减小”或“不变”),利用平衡常数与浓度商的关系说明理由:_______ 。
Ⅱ.克劳斯法:
已知:
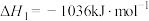

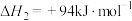
(4)用克劳斯法处理 ,若生成1mol
,若生成1mol ,放出热量
,放出热量_______ kJ。
(5)用克劳斯法处理 时,研究人员对反应条件对
时,研究人员对反应条件对 产率的影响进行了如下研究。
产率的影响进行了如下研究。
①其他条件相同时,相同时间内, 产率随温度的变化如图1所示。由图1可见,随着温度升高,
产率随温度的变化如图1所示。由图1可见,随着温度升高, 产率先增大后减小,原因是
产率先增大后减小,原因是_______ 。

②其他条件相同时,相同时间内, 产率随
产率随 值的变化如图2所示。
值的变化如图2所示。 值过高不利于提高
值过高不利于提高 产率,可能的原因是
产率,可能的原因是_______ 。

Ⅰ.高温热分解法:
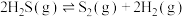
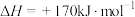
(1)该反应的化学平衡常数表达式为
(2)升高温度,该反应的化学平衡常数
(3)工业上,通常在等温、等压条件下将
 与Ar的混合气体通入反应器,发生
与Ar的混合气体通入反应器,发生 热分解反应,达到平衡状态后,若继续向反应器中通入Ar,
热分解反应,达到平衡状态后,若继续向反应器中通入Ar, 的平衡转化率会
的平衡转化率会Ⅱ.克劳斯法:

已知:

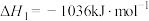

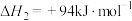
(4)用克劳斯法处理
 ,若生成1mol
,若生成1mol ,放出热量
,放出热量(5)用克劳斯法处理
 时,研究人员对反应条件对
时,研究人员对反应条件对 产率的影响进行了如下研究。
产率的影响进行了如下研究。①其他条件相同时,相同时间内,
 产率随温度的变化如图1所示。由图1可见,随着温度升高,
产率随温度的变化如图1所示。由图1可见,随着温度升高, 产率先增大后减小,原因是
产率先增大后减小,原因是
②其他条件相同时,相同时间内,
 产率随
产率随 值的变化如图2所示。
值的变化如图2所示。 值过高不利于提高
值过高不利于提高 产率,可能的原因是
产率,可能的原因是
您最近一年使用:0次
2023-01-06更新
|
781次组卷
|
6卷引用:北京海淀区2022-2023学年高二上学期期末考试化学试题
名校
解题方法
6 . 生产钛的方法之一是将金红石( )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。 转化为
转化为 有直接氯化法和碳氯化法,相关能量示意图如下所示。下列说法
有直接氯化法和碳氯化法,相关能量示意图如下所示。下列说法不正确 的是
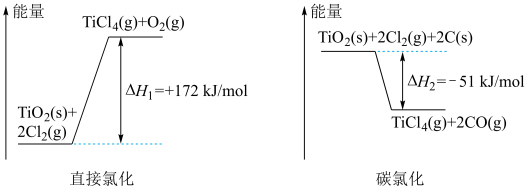
 )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。 转化为
转化为 有直接氯化法和碳氯化法,相关能量示意图如下所示。下列说法
有直接氯化法和碳氯化法,相关能量示意图如下所示。下列说法
| A.将反应物固体粉碎可以加快直接氯化,碳氯化的反应速率 |
B.可推知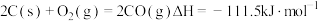 |
| C.判断直接氯化反应能否自发进行需要综合考虑体系的焓变和熵变 |
D.对于碳氯化反应,温度升高,平衡时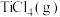 的产率变小 的产率变小 |
您最近一年使用:0次
2023-01-06更新
|
191次组卷
|
2卷引用:北京市朝阳区2022-2023学年高二上学期期末考试化学试题
名校
解题方法
7 .  、
、 下,①
下,①
②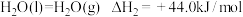
下列说法不正确 的是
 、
、 下,①
下,①
②
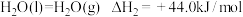
下列说法
| A.液态水变为水蒸气破坏的是分子间作用力 |
| B.水分解为氢气和氧气,断键吸收的总能量大于成键放出的总能量 |
C.标准状况下, 水中含共用电子对总数约为 水中含共用电子对总数约为 |
D. 、 、 下, 下,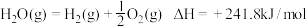 |
您最近一年使用:0次
2023-01-05更新
|
647次组卷
|
4卷引用:北京市石景山区2022-2023学年高三上学期期末考试化学试题
名校
解题方法
8 . 合成氨是人类科学技术上的一项重大突破,氨的用途广泛。
已知:
 kJ·mol
kJ·mol

 kJ·mol
kJ·mol


(1)
_______ kJ·mol-1(用含a、b的代数式表示)
(2)目前工业合成氨的主要方法是HaberBosch法:通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
①该反应放热,但仍选择较高温度,原因是_______ 。
②理论上,为了增大平衡时 的转化率,可采取的措施是
的转化率,可采取的措施是_______ (写出1条)。
③将物质的量之比为1∶3的 和
和 充入2 L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
充入2 L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
该条件下 的转化率为
的转化率为_______ ,平衡常数
_______ (可用分数表示)。
④若按以下浓度投料,其它反应条件与③相同,起始时反应进行的方向为_______ (填“正向”、“逆向”或“无法判断”)。
(3)图1是某压强下 和
和 按物质的量之比1∶3投料进行反应,反应混合物中
按物质的量之比1∶3投料进行反应,反应混合物中 的物质的量分数随温度的变化曲线。I是平衡时的曲线,II是不同温度下反应经过相同时间测得的曲线,下列说法正确的是
的物质的量分数随温度的变化曲线。I是平衡时的曲线,II是不同温度下反应经过相同时间测得的曲线,下列说法正确的是_______ 。
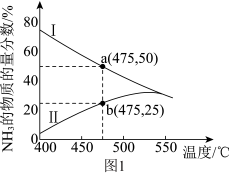
a.图中a点,容器内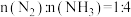
b.图中b点,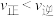
c.400~530℃,II中 的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大
的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大
(4)电化学气敏传感器可用于检测环境中 的含量,其工作原理如图2所示。
的含量,其工作原理如图2所示。

①反应消耗的 与
与 的物质的量之比为
的物质的量之比为_______ 。
②a极的电极反应式为_______ 。
已知:

 kJ·mol
kJ·mol

 kJ·mol
kJ·mol


(1)

(2)目前工业合成氨的主要方法是HaberBosch法:通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
①该反应放热,但仍选择较高温度,原因是
②理论上,为了增大平衡时
 的转化率,可采取的措施是
的转化率,可采取的措施是③将物质的量之比为1∶3的
 和
和 充入2 L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
充入2 L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:| 物质 |  |  |  |
平衡时物质的量 | 0.2 | 0.6 | 0.2 |
 的转化率为
的转化率为
④若按以下浓度投料,其它反应条件与③相同,起始时反应进行的方向为
| 物质 |  |  |  |
起始浓度(mol·L ) ) | 0.5 | 1.5 | 0.5 |
 和
和 按物质的量之比1∶3投料进行反应,反应混合物中
按物质的量之比1∶3投料进行反应,反应混合物中 的物质的量分数随温度的变化曲线。I是平衡时的曲线,II是不同温度下反应经过相同时间测得的曲线,下列说法正确的是
的物质的量分数随温度的变化曲线。I是平衡时的曲线,II是不同温度下反应经过相同时间测得的曲线,下列说法正确的是
a.图中a点,容器内
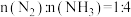
b.图中b点,
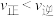
c.400~530℃,II中
 的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大
的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大(4)电化学气敏传感器可用于检测环境中
 的含量,其工作原理如图2所示。
的含量,其工作原理如图2所示。
①反应消耗的
 与
与 的物质的量之比为
的物质的量之比为②a极的电极反应式为
您最近一年使用:0次
名校
解题方法
9 . 研究 的综合利用、实现
的综合利用、实现 资源化,是能源领域的重要发展方向。
资源化,是能源领域的重要发展方向。
(1)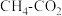 催化重整反应为
催化重整反应为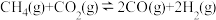 。
。
已知 ,
, 时,
时, 和
和 的燃烧热如下表:
的燃烧热如下表:
①该催化重整反应的
___________  。
。
②催化重整过程还存在积碳反应: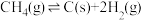 ,催化剂的活性会因积碳反应而降低。适当通入过量
,催化剂的活性会因积碳反应而降低。适当通入过量 可以有效缓解积碳,结合方程式解释其原因:
可以有效缓解积碳,结合方程式解释其原因:___________ 。
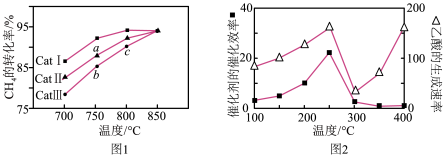
③相同时间内测得选用不同催化剂时 的转化率随反应温度的变化如图1所示:
的转化率随反应温度的变化如图1所示:
ⅰ、a点所处的状态___________ 化学平衡状态(填“是”或“不是”)。
ⅱ、 的转化率:
的转化率: ,原因是
,原因是___________ 。
(2)以二氧化钛表面覆盖的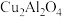 为催化剂,可以将
为催化剂,可以将 和
和 直接转化成乙酸。
直接转化成乙酸。
①催化剂的催化效率与乙酸的生成速率随温度的变化关系如图2所示。 时,温度升高而乙酸的生成速率降低的原因是
时,温度升高而乙酸的生成速率降低的原因是___________ 。
②为了提高该反应中 的平衡转化率,可以采取的措施是
的平衡转化率,可以采取的措施是___________ (写出两种)。
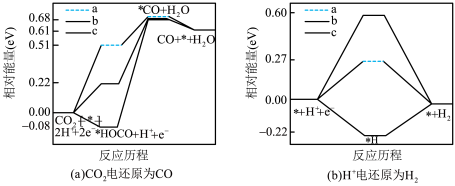
(3)在电解质水溶液中, 可被电化学还原为
可被电化学还原为 。在三种不同催化剂(a、b、c)上
。在三种不同催化剂(a、b、c)上 电还原为
电还原为 的反应进程中(
的反应进程中( 被还原为
被还原为 的反应可同时发生),相对能量变化如图。由此判断,
的反应可同时发生),相对能量变化如图。由此判断, 电还原为
电还原为 从易到难的顺序为
从易到难的顺序为___________ (用a、b、c字母排序)。
 的综合利用、实现
的综合利用、实现 资源化,是能源领域的重要发展方向。
资源化,是能源领域的重要发展方向。(1)
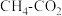 催化重整反应为
催化重整反应为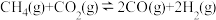 。
。已知
 ,
, 时,
时, 和
和 的燃烧热如下表:
的燃烧热如下表:| 可燃物 |  |  |  |
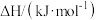 |  |  |  |

 。
。②催化重整过程还存在积碳反应:
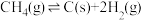 ,催化剂的活性会因积碳反应而降低。适当通入过量
,催化剂的活性会因积碳反应而降低。适当通入过量 可以有效缓解积碳,结合方程式解释其原因:
可以有效缓解积碳,结合方程式解释其原因:③相同时间内测得选用不同催化剂时
 的转化率随反应温度的变化如图1所示:
的转化率随反应温度的变化如图1所示:ⅰ、a点所处的状态
ⅱ、
 的转化率:
的转化率: ,原因是
,原因是
(2)以二氧化钛表面覆盖的
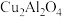 为催化剂,可以将
为催化剂,可以将 和
和 直接转化成乙酸。
直接转化成乙酸。①催化剂的催化效率与乙酸的生成速率随温度的变化关系如图2所示。
 时,温度升高而乙酸的生成速率降低的原因是
时,温度升高而乙酸的生成速率降低的原因是②为了提高该反应中
 的平衡转化率,可以采取的措施是
的平衡转化率,可以采取的措施是(3)在电解质水溶液中,
 可被电化学还原为
可被电化学还原为 。在三种不同催化剂(a、b、c)上
。在三种不同催化剂(a、b、c)上 电还原为
电还原为 的反应进程中(
的反应进程中( 被还原为
被还原为 的反应可同时发生),相对能量变化如图。由此判断,
的反应可同时发生),相对能量变化如图。由此判断, 电还原为
电还原为 从易到难的顺序为
从易到难的顺序为
您最近一年使用:0次
2022-11-07更新
|
366次组卷
|
2卷引用:北京市第八十中学2022-2023学年高三上学期期末测试化学试题
名校
10 . 2022北京冬奥会采用氢气作为火炬燃料,选择氢能汽车作为赛事交通服务用车,充分体现了绿色奥运的理念。已知:
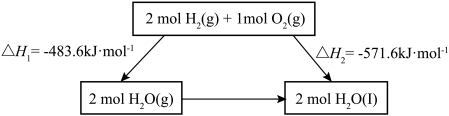
下列说法不正确 的是

下列说法
| A.氢气既可以通过燃烧反应提供热能,也可以设计成燃料电池提供电能 |
B. 的过程中, 的过程中, , , |
C.断裂2mol 和1mol 和1mol 中化学键所需能量大于断裂2mol 中化学键所需能量大于断裂2mol 中化学键所需能量 中化学键所需能量 |
D.化学反应的 ,只与反应体系的始态和终态有关,与反应途径无关 ,只与反应体系的始态和终态有关,与反应途径无关 |
您最近一年使用:0次
2022-11-04更新
|
615次组卷
|
9卷引用:北京师范大学附属中学2022-2023学年上学期高二化学期末试题



