1 . 反应Fe+H2SO4=FeSO4+H2↑的能量变化如图所示:
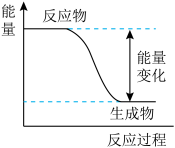
(1)该反应为___________ 反应(填“吸热”或“放热”)。
(2)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为___________ (填“正”或“负”)极,写出铜电极上发生的电极反应式___________ 。外电路中电流由___________ 流出(填电极材料名称)。
(3)若要使该反应的反应速率加快,下列生成物措施可行的是___________。

(1)该反应为
(2)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为
(3)若要使该反应的反应速率加快,下列生成物措施可行的是___________。
| A.改铁片为铁粉 | B.改稀硫酸为98%的浓硫酸 |
| C.加水 | D.滴加几滴CuSO4溶液 |
您最近一年使用:0次
解题方法
2 . 在25℃、101kpa的条件下,请回答下列有关问题:_______ (填“吸收”或“放出”,下同)436kJ的能量;由Cl2→Cl+Cl,当断裂1mol Cl2中的共价键时,要______ 243kJ的能量。
(2)对于反应H2(g)+Cl2(g)=2HCl(g),测得生成2molHCl(g)时,反应过程中放出183kJ的热量,则断开键所需的能量是________ kJ。

(2)对于反应H2(g)+Cl2(g)=2HCl(g),测得生成2molHCl(g)时,反应过程中放出183kJ的热量,则断开键所需的能量是
您最近一年使用:0次
3 . 回答下列问题:
I.硅是太阳能电池的重要材料,工业冶炼纯硅的原理是:
粗硅冶炼:①SiO2+2C Si+2CO
Si+2CO
精炼硅:②Si+3HCl SiHCl3+H2
SiHCl3+H2
③SiHCl3+H2 Si+3HCl
Si+3HCl
化学反应与能量变化如图所示,回答下列问题:
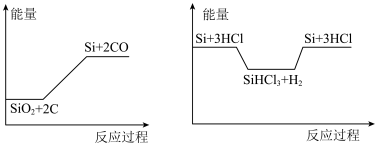
(1)①是______ 反应(填“吸热”或“放热”),反应②与反应③是否为可逆反应______ (填“是”或“否”)。
(2)0.5molSiHCl3发生反应③时,有______ mol极性键断裂。
(3)反应③破坏反应物的化学键所吸收的能量______ (填“大于”或“小于”或“等于”)形成生成物中化学键所放出的能量。
Ⅱ.化学电池的发明,改变了人们的生活。
(4)如图是银锌原电池装置的示意图。回答下列问题:
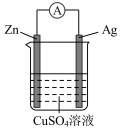
银电极上的电极反应式为_______ ,该原电池的总反应离子方程式为______ 。能证明化学能转化为电能的实验现象是______ 。
(5)如图是常见的锌锰干电池构造示意图。

已知:电池的总反应为Zn+2MnO2+2NH =Zn2++Mn2O3+2NH3+H2O。下列说法正确的是
=Zn2++Mn2O3+2NH3+H2O。下列说法正确的是______ (填字母)。
a.锌筒作负极 b.MnO2作正极 c.MnO2发生还原反应 d.NH4Cl发生氧化反应
I.硅是太阳能电池的重要材料,工业冶炼纯硅的原理是:
粗硅冶炼:①SiO2+2C
 Si+2CO
Si+2CO精炼硅:②Si+3HCl
 SiHCl3+H2
SiHCl3+H2③SiHCl3+H2
 Si+3HCl
Si+3HCl化学反应与能量变化如图所示,回答下列问题:

(1)①是
(2)0.5molSiHCl3发生反应③时,有
(3)反应③破坏反应物的化学键所吸收的能量
Ⅱ.化学电池的发明,改变了人们的生活。
(4)如图是银锌原电池装置的示意图。回答下列问题:

银电极上的电极反应式为
(5)如图是常见的锌锰干电池构造示意图。

已知:电池的总反应为Zn+2MnO2+2NH
 =Zn2++Mn2O3+2NH3+H2O。下列说法正确的是
=Zn2++Mn2O3+2NH3+H2O。下列说法正确的是a.锌筒作负极 b.MnO2作正极 c.MnO2发生还原反应 d.NH4Cl发生氧化反应
您最近一年使用:0次
4 . 汽车尾气中对人类健康造成危害的物质主要有碳氢化合物、一氧化碳和氮氧化物等,可用活性炭或一氧化碳还原氮氧化物,减少大气污染。回答下列问题:
(1)三元催化器可同时将汽车尾气中的三种污染物转化为无害物质。写出转化过程中 和CO反应的化学方程式
和CO反应的化学方程式_____________ 。该反应的能量变化关系如图所示:

判断其属于_______________ (填“放热反应”或“吸热反应”)。
(2)一定温度下,在一个10L的密闭容器中加入活性炭(足量)和1.0mol NO,发生反应的化学方程式为: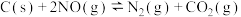 。NO、
。NO、 的物质的量随时间的变化如下表所示:
的物质的量随时间的变化如下表所示:
①各时间段反应速率最快的是_____ (填“0~5”“5~9”“9~10”)min,原因是________________ 。
② 0~5min内,反应速率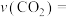
_______  ;
;
③ 按表中数据,反应一定达到化学平衡状态的时间段是_________ min~12min,此时,
容器中 的物质的量浓度是
的物质的量浓度是_______  。
。
(1)三元催化器可同时将汽车尾气中的三种污染物转化为无害物质。写出转化过程中
 和CO反应的化学方程式
和CO反应的化学方程式
判断其属于
(2)一定温度下,在一个10L的密闭容器中加入活性炭(足量)和1.0mol NO,发生反应的化学方程式为:
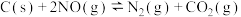 。NO、
。NO、 的物质的量随时间的变化如下表所示:
的物质的量随时间的变化如下表所示:物质的量/mol | 0 | 5min | 9min | 10min | 12min |
NO | 1.0 | 0.58 | 0.42 | 0.40 | 0.40 |
| 0 | 0.21 | 0.29 | 0.30 | 0.30 |
② 0~5min内,反应速率
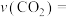
 ;
;③ 按表中数据,反应一定达到化学平衡状态的时间段是
容器中
 的物质的量浓度是
的物质的量浓度是 。
。
您最近一年使用:0次
5 . 已知反应2Al+3H2SO4=Al2(SO4)3+3H2↑的能量变化趋势如图所示:
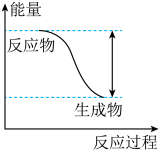
(1)该反应为______ (填“吸热”或“放热”)反应。
(2)若要使该反应的反应速率增大,下列措施可行的是_____ (填字母)。
(3)①若将上述反应设计成原电池,铜为原电池某一极材料,则铜为:_____ (填“正”或“负”)极,该极上发生的电极反应为:______ 。
②标况下当电池中共收集到2.24L氢气时,外电路共转移______ mol电子。

(1)该反应为
(2)若要使该反应的反应速率增大,下列措施可行的是
| A.改铝片为铝粉 | B.改稀硫酸为98%的浓硫酸 |
| C.升高温度 | D.使用催化剂 |
②标况下当电池中共收集到2.24L氢气时,外电路共转移
您最近一年使用:0次
名校
6 . 某化学兴趣小组进行如图所示实验,以检验化学反应中的能量变化。
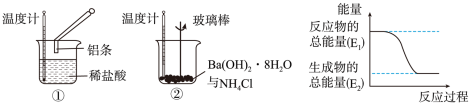
请回答下列问题:
(1)反应①的离子方程式是___________ ;反应②的化学方程式___________ 。
(2)②中的温度___________ (填“升高”或“降低”)。反应___________ (填“①”或“②”)的能量变化可用图表示。
(3)现有如下两个反应:
A.
B.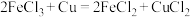
①A反应不能设计成原电池的原因是___________ 。
②利用B反应可设计成原电池,该电池负极的电极反应式为___________ ,可用作该电池正极材料的是___________ (填字母)。
a.碳棒 b.铁片 c.铜片 d.铂棒
(4)用 和
和 组合形成的质子交换膜燃料电池的结构如图:
组合形成的质子交换膜燃料电池的结构如图:
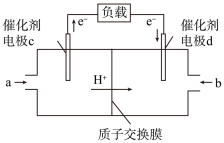
则d电极是燃料电池的___________ (填“正极”或“负极”),此电极的电极反应式为___________ 。

请回答下列问题:
(1)反应①的离子方程式是
(2)②中的温度
(3)现有如下两个反应:
A.

B.
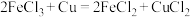
①A反应不能设计成原电池的原因是
②利用B反应可设计成原电池,该电池负极的电极反应式为
a.碳棒 b.铁片 c.铜片 d.铂棒
(4)用
 和
和 组合形成的质子交换膜燃料电池的结构如图:
组合形成的质子交换膜燃料电池的结构如图:
则d电极是燃料电池的
您最近一年使用:0次
2023-04-19更新
|
382次组卷
|
2卷引用:江苏省无锡市太湖高级中学2022-2023学年高一下学期期中考试化学试题
名校
7 .  在光照条件下与
在光照条件下与 反应,可得到各种氯代甲烷。
反应,可得到各种氯代甲烷。
(1)写出生成 的化学方程式是
的化学方程式是_______ 。
(2) 氯代的机理为自由基(带有单电子的原子或原子团,如
氯代的机理为自由基(带有单电子的原子或原子团,如 、
、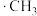 )反应,包括以下几步:
)反应,包括以下几步:
①写出由 生成
生成 过程中链传递的方程式:
过程中链传递的方程式:_______ ,_______ 。
②不同卤原子自由基(X·)均可夺取 中的H,反应通式:
中的H,反应通式: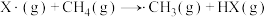 。
。
已知:25℃, 时,断裂
时,断裂 中
中 和
和 中
中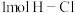 键分别需要吸收
键分别需要吸收 和
和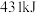 的能量。
的能量。
a.计算当X为 时,上述反应
时,上述反应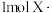 参与反应
参与反应_______ (“吸收”或“放出”)_______ kJ能量。
b.若X依次为F、 、
、 、I,则放出或吸收的能量随着原子序数增大逐渐
、I,则放出或吸收的能量随着原子序数增大逐渐_______ (填“增大”或“减小”),结合原子结构解释原因:_______ 。
③探究光照对 与
与 反应的影响,实验如下。
反应的影响,实验如下。
a.由B和D得出的结论是_______ 。
b.依据上述机理,解释C中几乎没有氯代甲烷的原因:_______ 。
(3)丙烷氯代反应中链传递的一步反应能量变化如下。
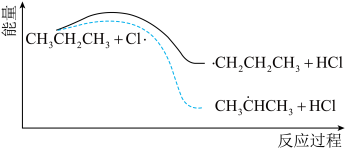
推知断裂 中
中 比断裂
比断裂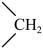 中
中 所需能量
所需能量_______ (填“大”或“小”)。
 在光照条件下与
在光照条件下与 反应,可得到各种氯代甲烷。
反应,可得到各种氯代甲烷。(1)写出生成
 的化学方程式是
的化学方程式是(2)
 氯代的机理为自由基(带有单电子的原子或原子团,如
氯代的机理为自由基(带有单电子的原子或原子团,如 、
、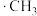 )反应,包括以下几步:
)反应,包括以下几步:| I.链引发 | II.链传递 | III.链终止 |
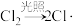 |  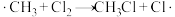 …… |   …… |
 生成
生成 过程中链传递的方程式:
过程中链传递的方程式:②不同卤原子自由基(X·)均可夺取
 中的H,反应通式:
中的H,反应通式: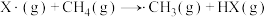 。
。已知:25℃,
 时,断裂
时,断裂 中
中 和
和 中
中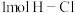 键分别需要吸收
键分别需要吸收 和
和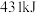 的能量。
的能量。a.计算当X为
 时,上述反应
时,上述反应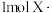 参与反应
参与反应b.若X依次为F、
 、
、 、I,则放出或吸收的能量随着原子序数增大逐渐
、I,则放出或吸收的能量随着原子序数增大逐渐③探究光照对
 与
与 反应的影响,实验如下。
反应的影响,实验如下。| 编号 | 操作 | 结果 |
| A | 将 与 与 混合后,光照 混合后,光照 | 得到氯代甲烷 |
| B | 将 先用光照,然后迅速在黑暗中与 先用光照,然后迅速在黑暗中与 混合 混合 | 得到氯代甲烷 |
| C | 将 先用光照,然后在黑暗中放置一段时间,再与 先用光照,然后在黑暗中放置一段时间,再与 混合 混合 | 几乎无氯代甲烷 |
| D | 将 先用光照,然后迅速在黑暗中与 先用光照,然后迅速在黑暗中与 混合 混合 | 几乎无氯代甲烷 |
b.依据上述机理,解释C中几乎没有氯代甲烷的原因:
(3)丙烷氯代反应中链传递的一步反应能量变化如下。

推知断裂
 中
中 比断裂
比断裂 中
中 所需能量
所需能量
您最近一年使用:0次
名校
8 . I.化学反应中伴随着能量变化,探究各种能量变化是一永恒的主题。
(1)下列变化属于放热反应的是_______ (填序号)。
a.生石灰溶于水 b.氢氧化钠固体溶于水 c.氢气与氯气化合
d.氯化铵固体与氢氧化钡晶体混合搅拌 e.过氧化钠溶于水
(2)下列图像分别表示有关反应的反应过程与能量变化的关系
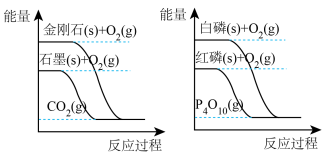
据此判断下列说法中正确的是_______ (填序号)。
a.等质量的石墨和金刚石完全燃烧释放的热量相同
b.白磷和红磷互为同素异形体,相同条件下白磷比红磷稳定
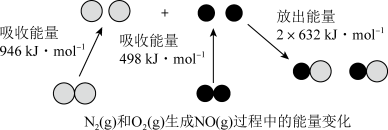
c.1mol (g)和1mol
(g)和1mol  (g)具有的总能量小于2mol NO(g)具有的总能量
(g)具有的总能量小于2mol NO(g)具有的总能量
II.如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:

(3)当电极a为Zn,电极b为Cu,电解质溶液为 溶液时,正极的电极反应式为
溶液时,正极的电极反应式为______ 。若初始时两电极质量相等,当电路中有2mol  通过时,两极的质量差为
通过时,两极的质量差为_______ g。
(4)当电极a为Al,电极b为Mg,电解质溶液为NaOH溶液时,该电池的负极反应式为______ 。当反应中收集到标准状况下336mL气体时,消耗负极的物质的量为_______ mol。
(1)下列变化属于放热反应的是
a.生石灰溶于水 b.氢氧化钠固体溶于水 c.氢气与氯气化合
d.氯化铵固体与氢氧化钡晶体混合搅拌 e.过氧化钠溶于水
(2)下列图像分别表示有关反应的反应过程与能量变化的关系


据此判断下列说法中正确的是
a.等质量的石墨和金刚石完全燃烧释放的热量相同
b.白磷和红磷互为同素异形体,相同条件下白磷比红磷稳定
c.1mol
 (g)和1mol
(g)和1mol  (g)具有的总能量小于2mol NO(g)具有的总能量
(g)具有的总能量小于2mol NO(g)具有的总能量II.如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:

(3)当电极a为Zn,电极b为Cu,电解质溶液为
 溶液时,正极的电极反应式为
溶液时,正极的电极反应式为 通过时,两极的质量差为
通过时,两极的质量差为(4)当电极a为Al,电极b为Mg,电解质溶液为NaOH溶液时,该电池的负极反应式为
您最近一年使用:0次
2023-04-12更新
|
727次组卷
|
4卷引用:辽宁省六校协作体2022-2023学年高一下学期4月月考化学试题
解题方法
9 . 写出下列反应的热化学方程式:
(1)1 mol C2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1 366.8 kJ热量:___________ 。
(2)1 mol C(石墨,s)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ热量:___________ 。
(3)1.7 g NH3(g)发生催化氧化反应生成气态产物,放出22.67 kJ的热量:___________ 。
(4)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,写出表示硫的燃烧热的热化学方程式:___________ 。
(5)如图是298 K、101 kPa时,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为___________ 。
(1)1 mol C2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1 366.8 kJ热量:
(2)1 mol C(石墨,s)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ热量:
(3)1.7 g NH3(g)发生催化氧化反应生成气态产物,放出22.67 kJ的热量:
(4)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,写出表示硫的燃烧热的热化学方程式:
(5)如图是298 K、101 kPa时,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为

您最近一年使用:0次
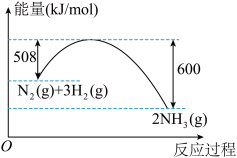
10 . 按要求完成下列填空。
(1)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2+3H2 2NH3。
2NH3。
①合成氨的反应中的能量变化如图所示。该反应是_____ 反应(填“吸热”或“放热”)。

②在一定条件下,将一定量的N2和H2的混合气体充入某密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是_____ (填字母)。
a.容器中N2、H2、NH3共存
b.N2、H2、NH3的物质的量之比为1∶3∶2
c.容器中的压强不随时间变化
d.N2、NH3浓度相等
(2)从断键和成键的角度分析上述反应中能量的变化,化学键的键能如表所示。
反应2H2(g)+O2(g)=2H2O(g)的ΔH=_____ 。生成1mol H2O(g)可以放出热量是_____ kJ。
(3)下列反应中,属于放热反应的是_____ ,属于吸热反应的是_____ 。
a.盐酸与烧碱溶液反应
b.Ba(OH)2•8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
c.氢气在氧气中燃烧生成水
d.高温煅烧石灰石使其分解
e.铝和盐酸反应
(1)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2+3H2
 2NH3。
2NH3。①合成氨的反应中的能量变化如图所示。该反应是

②在一定条件下,将一定量的N2和H2的混合气体充入某密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是
a.容器中N2、H2、NH3共存
b.N2、H2、NH3的物质的量之比为1∶3∶2
c.容器中的压强不随时间变化
d.N2、NH3浓度相等
(2)从断键和成键的角度分析上述反应中能量的变化,化学键的键能如表所示。
| 化学键 | H-H | O=O | H-O |
| 键能(kJ/mol) | 436 | 496 | 463 |
反应2H2(g)+O2(g)=2H2O(g)的ΔH=
(3)下列反应中,属于放热反应的是
a.盐酸与烧碱溶液反应
b.Ba(OH)2•8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
c.氢气在氧气中燃烧生成水
d.高温煅烧石灰石使其分解
e.铝和盐酸反应
您最近一年使用:0次



