1 . 化学在生产生活中无处不在。
 .某汽车安全气囊的气体发生剂主要含有叠氮化钠(
.某汽车安全气囊的气体发生剂主要含有叠氮化钠( )、三氧化二铁(
)、三氧化二铁( )、硝酸铵等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
)、硝酸铵等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)汽车受到猛烈碰撞时,点火器点火引发 迅速分解,生成氮气和金属钠,同时释放大量的热。下列关于该反应过程中的能量变化示意图正确的是
迅速分解,生成氮气和金属钠,同时释放大量的热。下列关于该反应过程中的能量变化示意图正确的是___________ (填字母),生成氮气的电子式为___________ 。 .
. 、
、 (甲醇)既是重要的化工原料,又是重要的能源物质。
(甲醇)既是重要的化工原料,又是重要的能源物质。
(2)将2.0 mol 和4.0 mol
和4.0 mol  通入容积为4 L的反应器,保持容器容积不变,在一定温度下发生反应
通入容积为4 L的反应器,保持容器容积不变,在一定温度下发生反应 ,测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用
,测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为___________ 。
(3)一定条件下,将1.0 mol 与2.0 mol
与2.0 mol  充入密闭容器中发生反应
充入密闭容器中发生反应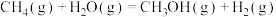 ,下列措施可以提高化学反应速率的是
,下列措施可以提高化学反应速率的是___________ (填字母)。
a.恒容条件下充入He b.增大体积 c.升高温度 d.保持恒容投入更多的 e.加入合适的催化剂
e.加入合适的催化剂
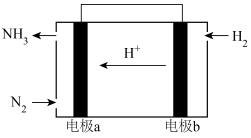
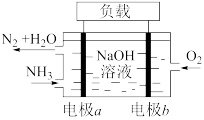
(4)用 设计燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为
设计燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为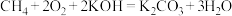 。
。 向B电极定向移动,则
向B电极定向移动,则___________ (填“A”或“B”)电极入口通甲烷,该电极反应的离子方程式为___________ 。
②当消耗甲烷的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为___________ 。
 .某汽车安全气囊的气体发生剂主要含有叠氮化钠(
.某汽车安全气囊的气体发生剂主要含有叠氮化钠( )、三氧化二铁(
)、三氧化二铁( )、硝酸铵等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
)、硝酸铵等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。(1)汽车受到猛烈碰撞时,点火器点火引发
 迅速分解,生成氮气和金属钠,同时释放大量的热。下列关于该反应过程中的能量变化示意图正确的是
迅速分解,生成氮气和金属钠,同时释放大量的热。下列关于该反应过程中的能量变化示意图正确的是A.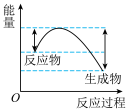 B.
B.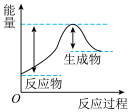 C.
C.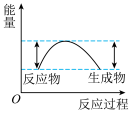
 .
. 、
、 (甲醇)既是重要的化工原料,又是重要的能源物质。
(甲醇)既是重要的化工原料,又是重要的能源物质。(2)将2.0 mol
 和4.0 mol
和4.0 mol  通入容积为4 L的反应器,保持容器容积不变,在一定温度下发生反应
通入容积为4 L的反应器,保持容器容积不变,在一定温度下发生反应 ,测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用
,测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为(3)一定条件下,将1.0 mol
 与2.0 mol
与2.0 mol  充入密闭容器中发生反应
充入密闭容器中发生反应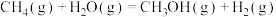 ,下列措施可以提高化学反应速率的是
,下列措施可以提高化学反应速率的是a.恒容条件下充入He b.增大体积 c.升高温度 d.保持恒容投入更多的
 e.加入合适的催化剂
e.加入合适的催化剂(4)用
 设计燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为
设计燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为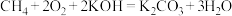 。
。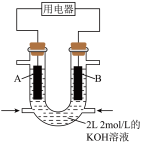
 向B电极定向移动,则
向B电极定向移动,则②当消耗甲烷的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为
您最近一年使用:0次
名校
解题方法
2 . 某温度下CO2加氢制甲醇的总反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g)(该反应为放热反应),在固定容积为2.0 L的密闭容器中充入0.8 mol的CO2和2.4 mol的H2,测得CO2和CH3OH的物质的量随时间变化如图。请回答:
CH3OH(g)+H2O(g)(该反应为放热反应),在固定容积为2.0 L的密闭容器中充入0.8 mol的CO2和2.4 mol的H2,测得CO2和CH3OH的物质的量随时间变化如图。请回答:_______ (填“大于”“小于”或“等于”)生成物的化学键形成要放出的能量。
(2)2 min末时v正_______ (填“<”“>”或“=”)v逆。
(3)恒温恒容条件下,能说明反应已达平衡状态的是_______ 。
A.混合气体的密度保持不变
B.消耗1molCO2的同时消耗1molCH3OH
C.容器中CH3OH浓度与H2O浓度之比为1∶1
D.CO2(g)体积分数保持不变
E.v(H2) = 3v(CH3OH)
(4)该反应平衡时H2的转化率为_______ 。
(5)二氧化碳加氢制甲醇一般认为可通过两步反应来实现,物质变化与体系能量变化如题图所示。 CO(g)+H2O(g)。
CO(g)+H2O(g)。
②_______ (用化学方程式表示)。
总反应可表示为CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH_______ (填“>”或“<”)0。
 CH3OH(g)+H2O(g)(该反应为放热反应),在固定容积为2.0 L的密闭容器中充入0.8 mol的CO2和2.4 mol的H2,测得CO2和CH3OH的物质的量随时间变化如图。请回答:
CH3OH(g)+H2O(g)(该反应为放热反应),在固定容积为2.0 L的密闭容器中充入0.8 mol的CO2和2.4 mol的H2,测得CO2和CH3OH的物质的量随时间变化如图。请回答: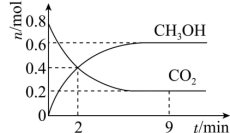
(2)2 min末时v正
(3)恒温恒容条件下,能说明反应已达平衡状态的是
A.混合气体的密度保持不变
B.消耗1molCO2的同时消耗1molCH3OH
C.容器中CH3OH浓度与H2O浓度之比为1∶1
D.CO2(g)体积分数保持不变
E.v(H2) = 3v(CH3OH)
(4)该反应平衡时H2的转化率为
(5)二氧化碳加氢制甲醇一般认为可通过两步反应来实现,物质变化与体系能量变化如题图所示。
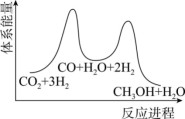
 CO(g)+H2O(g)。
CO(g)+H2O(g)。②
总反应可表示为CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
您最近一年使用:0次
名校
解题方法
3 . 能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。 请回答下列问题。
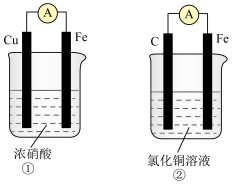
(1)某同学做如下实验,以检验反应中的能量变化。___________ 热反应;(b)中温度降低,由此可以判断(b)中反应是___________ 热反应。
②写出铝与盐酸反应的离子方程式___________ 。
③根据能量守恒定律,(b)中反应物的总能量应该___________ 其生成物的总能量。(填“大于”、“小于”、“等于”)
(2)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。
①当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,正极的电极反应式为___________ ,当电路中有0.2mol电子通过时,负极的质量减少___________ g。
②当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置___________ (填“能”或“不能”)形成原电池。
③将锌片和银片浸入硫酸铜溶液中组成原电池,两电极间连接一个电流表。
锌片上发生的电极反应为___________ ;
银片上发生的电极反应为___________ 。
(1)某同学做如下实验,以检验反应中的能量变化。
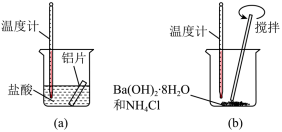
②写出铝与盐酸反应的离子方程式
③根据能量守恒定律,(b)中反应物的总能量应该
(2)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。
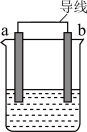
①当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,正极的电极反应式为
②当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置
③将锌片和银片浸入硫酸铜溶液中组成原电池,两电极间连接一个电流表。
锌片上发生的电极反应为
银片上发生的电极反应为
您最近一年使用:0次
名校
解题方法
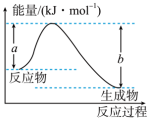
4 . 任何化学反应都伴随着能量的变化,化学能可转化为热能、电能等。回答下列有关问题:
(1)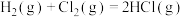 的反应过程如图所示:
的反应过程如图所示:___________ (填“放热”或“吸热”)反应,生成2molHCl(g)吸收或放出的热量为___________ 。
(2)下列变化中属于吸热反应的是___________ (填标号)。
①液态水汽化 ②生石灰与水反应
③ ④
④ 与固体
与固体 混合
混合
(3)用如图装置推算铜锌原电池工作时产生的电流量。供选择的电极材料有纯铜片和纯锌片。则 a 电极的电极反应式为___________ ,当量筒中收集到 336mL(标准状况下)气体时,通过导线的电子的物质的量为___________ 。___________ 极(填“正”或“负”)。___________ (填“①”或“②”)该装置中的正极的电极反应式为___________ ;电子从___________ (填电极材料)流向___________ (填电极材料)
(1)
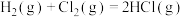 的反应过程如图所示:
的反应过程如图所示: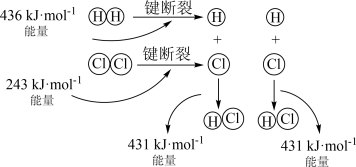
(2)下列变化中属于吸热反应的是
①液态水汽化 ②生石灰与水反应
③
 ④
④ 与固体
与固体 混合
混合(3)用如图装置推算铜锌原电池工作时产生的电流量。供选择的电极材料有纯铜片和纯锌片。则 a 电极的电极反应式为
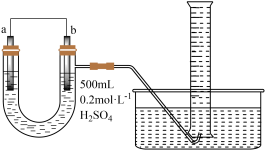
您最近一年使用:0次
名校
解题方法
5 . Ⅰ.断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A—B的键能。下表列出了一些化学键的键能(E):
请回答下列问题:
(1)如图表示某反应的能量变化关系,则此反应_______ (填“吸收”或“放出”)_______ kJ能量(用含有a、b的关系式表示)。 O2(g)=H2O(g)放出241.8 kJ能量,则根据所给键能数据可得x=
O2(g)=H2O(g)放出241.8 kJ能量,则根据所给键能数据可得x=_______ 。
(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃时利用空气中的氧气与氯化氢反应制氯气。反应的化学方程式为_______ 。
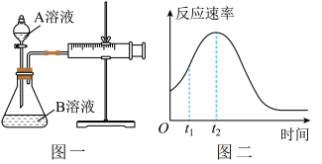
Ⅱ.用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
(4)该实验探究的是_______ 因素对化学反应速率的影响。如下图一,相同时间内针筒中所得的CO2体积大小关系是_______ (填实验序号)。 =
=_______ (假设混合液体积为50mL)。
(6)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定_______ 来比较化学反应速率。
(7)小组同学发现反应速率总是如上图二,其中t1~t2时间内速率变快的主要原因可能是①产物MnSO4是该反应的催化剂、②_______ 。
| 化学键 | H—H | Cl—Cl | O=O | C—Cl | C—H | O—H | H—Cl |
| E/(kJ·mol-1) | 436 | 247 | x | 330 | 413 | 463 | 431 |
(1)如图表示某反应的能量变化关系,则此反应
 O2(g)=H2O(g)放出241.8 kJ能量,则根据所给键能数据可得x=
O2(g)=H2O(g)放出241.8 kJ能量,则根据所给键能数据可得x=(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃时利用空气中的氧气与氯化氢反应制氯气。反应的化学方程式为
Ⅱ.用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol·L-1H2C2O4溶液 | 30mL 0.1 mol·L-1KMnO4溶液 |
| ② | 20mL 0.2mol·L-1H2C2O4溶液 | 30mL 0.1mol·L-1KMnO4溶液 |
 =
=(6)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定
(7)小组同学发现反应速率总是如上图二,其中t1~t2时间内速率变快的主要原因可能是①产物MnSO4是该反应的催化剂、②
您最近一年使用:0次
2024-04-25更新
|
190次组卷
|
2卷引用:广东省汕头市潮阳第一中学2023-2024学年高一下学期4月期中考试化学试题
名校
6 . 在生产和生活中,人们关注化学反应进行的快慢和程度,以提高生产效率和调控反应条件。
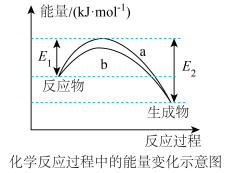
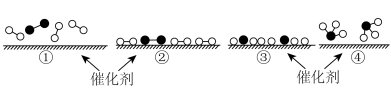
Ⅰ.合成氨的反应对人类解决粮食问题贡献巨大,反应为 。
。
(1)德国化学家F·Haber利用 和
和 在催化剂表面合成氨气而获得诺贝尔奖,该反应的能量变化及微观历程的示意图如下,用
在催化剂表面合成氨气而获得诺贝尔奖,该反应的能量变化及微观历程的示意图如下,用 、
、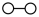 、
、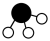 分别
分别 、
、 、
、 。
。_______ 。
A.氢气燃烧 B.氯化铵与 的反应
的反应
C.锌片与稀硫酸的反应 D.钠与冷水的反应
②下列说法正确的是_______ 。
A.使用催化剂,可以加快合成氨的反应速率
B.②→③过程,是吸热过程且只有H-H键断裂
C.③→④过程,N原子和H原子形成了含有极性键的
D.合成氨反应中,反应物断键吸收能量大于生成物成键释放的能量
(2)一定温度下,向恒容的密闭容器中充入一定量的 和
和 发生反应,测得各组分浓度随时间变化如图所示。
发生反应,测得各组分浓度随时间变化如图所示。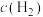 变化的曲线是
变化的曲线是_______ (填“A”“B”或“C”)。
②下列能说明该反应达到平衡状态的是_______ (填序号)。
a.容器中的压强不随时间变化
b.
c.容器中混合气体的密度不随时间变化
d.单位时间内生成3mol 的同时生成2mol
的同时生成2mol
e.容器内 的质量分数不变
的质量分数不变
(3)一定条件下,将2mol 和3mol
和3mol 通入2L的恒容密闭容器中,10min后达到化学平衡,测得
通入2L的恒容密闭容器中,10min后达到化学平衡,测得 的物质的量为2.4mol,则10min内
的物质的量为2.4mol,则10min内 的平均反应速率为
的平均反应速率为_______ , 的转化率是
的转化率是_______ ,混合气中 的物质的量分数是
的物质的量分数是_______ 。
Ⅱ.探究一定条件下反应物浓度对硫代硫酸钠( )与硫酸反应速率的影响。
)与硫酸反应速率的影响。
【查阅资料】
a. 易溶于水,能与硫酸发生反应:
易溶于水,能与硫酸发生反应: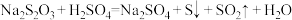
b.浊度计用于测量浑浊度的变化。产生的沉淀越多,浑浊度(单位为NTU)值越大。
【实验过程】
实验数据:
(4)选用浊度计进行测量,原因是 溶液与
溶液与 溶液反应生成了
溶液反应生成了_______ 。
(5)实验③中,x=_______ 。
(6)实验①、②、③的目的是_______ 。
(7)通过比较①、②、③与③、④、⑤两组实验,可推断:反应物浓度的改变对 与硫酸反应的化学反应速率的影响,
与硫酸反应的化学反应速率的影响, 溶液浓度的改变影响更大。该推断的证据是
溶液浓度的改变影响更大。该推断的证据是_______ 。
Ⅰ.合成氨的反应对人类解决粮食问题贡献巨大,反应为
 。
。(1)德国化学家F·Haber利用
 和
和 在催化剂表面合成氨气而获得诺贝尔奖,该反应的能量变化及微观历程的示意图如下,用
在催化剂表面合成氨气而获得诺贝尔奖,该反应的能量变化及微观历程的示意图如下,用 、
、 、
、 分别
分别 、
、 、
、 。
。
A.氢气燃烧 B.氯化铵与
 的反应
的反应C.锌片与稀硫酸的反应 D.钠与冷水的反应
②下列说法正确的是
A.使用催化剂,可以加快合成氨的反应速率
B.②→③过程,是吸热过程且只有H-H键断裂
C.③→④过程,N原子和H原子形成了含有极性键的

D.合成氨反应中,反应物断键吸收能量大于生成物成键释放的能量
(2)一定温度下,向恒容的密闭容器中充入一定量的
 和
和 发生反应,测得各组分浓度随时间变化如图所示。
发生反应,测得各组分浓度随时间变化如图所示。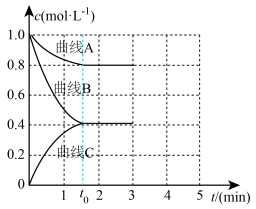
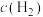 变化的曲线是
变化的曲线是②下列能说明该反应达到平衡状态的是
a.容器中的压强不随时间变化
b.

c.容器中混合气体的密度不随时间变化
d.单位时间内生成3mol
 的同时生成2mol
的同时生成2mol
e.容器内
 的质量分数不变
的质量分数不变(3)一定条件下,将2mol
 和3mol
和3mol 通入2L的恒容密闭容器中,10min后达到化学平衡,测得
通入2L的恒容密闭容器中,10min后达到化学平衡,测得 的物质的量为2.4mol,则10min内
的物质的量为2.4mol,则10min内 的平均反应速率为
的平均反应速率为 的转化率是
的转化率是 的物质的量分数是
的物质的量分数是Ⅱ.探究一定条件下反应物浓度对硫代硫酸钠(
 )与硫酸反应速率的影响。
)与硫酸反应速率的影响。【查阅资料】
a.
 易溶于水,能与硫酸发生反应:
易溶于水,能与硫酸发生反应: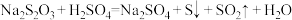
b.浊度计用于测量浑浊度的变化。产生的沉淀越多,浑浊度(单位为NTU)值越大。
【实验过程】
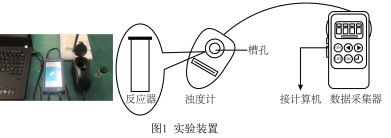
| 实验编号 |  溶液 溶液 |  溶液 溶液 | 蒸馏水 | ||
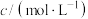 | V/mL |  | V/mL | V/mL | |
| ① | 0.1 | 1.5 | 0.1 | 3.5 | 10 |
| ② | 0.1 | 2.5 | 0.1 | 3.5 | 9 |
| ③ | 0.1 | 3.5 | 0.1 | 3.5 | x |
| ④ | 0.1 | 3.5 | 0.1 | 2.5 | 9 |
| ⑤ | 0.1 | 3.5 | 0.1 | 1.5 | 10 |
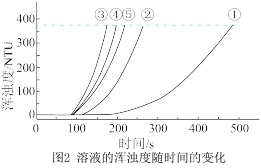
(4)选用浊度计进行测量,原因是
 溶液与
溶液与 溶液反应生成了
溶液反应生成了(5)实验③中,x=
(6)实验①、②、③的目的是
(7)通过比较①、②、③与③、④、⑤两组实验,可推断:反应物浓度的改变对
 与硫酸反应的化学反应速率的影响,
与硫酸反应的化学反应速率的影响, 溶液浓度的改变影响更大。该推断的证据是
溶液浓度的改变影响更大。该推断的证据是
您最近一年使用:0次
2024-04-25更新
|
289次组卷
|
2卷引用:广东省广州市育才中学2023-2024学年高一下学期 期中考试化学试题
7 . Ⅰ.工业上用CO生产燃料甲醇,一定条件下发生反应: 。图1表示反应中能量变化;图2表示一定温度下,在容积为2L的密闭容器中加入4molH2和一定量的CO后,CO和
。图1表示反应中能量变化;图2表示一定温度下,在容积为2L的密闭容器中加入4molH2和一定量的CO后,CO和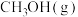 的浓度随时间变化。
的浓度随时间变化。
(1)在图1中,曲线________ (填“a”或“b”)表示使用了催化剂。
(2)该反应属于________ (填“吸热”或“放热”)反应。
(3)增大反应体系压强,则该反应化学平衡常数________ (填“增大”“减小”或“不变”)。根据图2计算该反应的化学平衡常数数值为K=________
Ⅱ.CuSO4溶液是一种重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用CuSO4溶液进行以下实验探究:
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是________ (填字母)。
a.溶液中Cu2+向阳极移动
b.粗铜接电源正极,发生还原反应
c.电解后CuSO4溶液的浓度减小
d.利用阳极泥可回收Ag、Pt、Au等金属
(5)图中,A是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在B中实现铁上镀铜:________ (填“CH4”或“O2),a处的电极反应式为________ 。
②当铜电极的质量减轻3.2g,则消耗的CH4在标准状况下的体积为________ 。
 。图1表示反应中能量变化;图2表示一定温度下,在容积为2L的密闭容器中加入4molH2和一定量的CO后,CO和
。图1表示反应中能量变化;图2表示一定温度下,在容积为2L的密闭容器中加入4molH2和一定量的CO后,CO和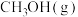 的浓度随时间变化。
的浓度随时间变化。 
(1)在图1中,曲线
(2)该反应属于
(3)增大反应体系压强,则该反应化学平衡常数
Ⅱ.CuSO4溶液是一种重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用CuSO4溶液进行以下实验探究:
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
a.溶液中Cu2+向阳极移动
b.粗铜接电源正极,发生还原反应
c.电解后CuSO4溶液的浓度减小
d.利用阳极泥可回收Ag、Pt、Au等金属
(5)图中,A是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在B中实现铁上镀铜:

②当铜电极的质量减轻3.2g,则消耗的CH4在标准状况下的体积为
您最近一年使用:0次
8 . 完成下列问题
(1)某种酱油的pH为5,则该酱油中的c(H+)=___________ 。
(2)在常温下,柠檬水的pH为3,其中的c(OH-)为___________ (填字母)。
a.0.1 mol∙L−1 b. c.
c.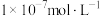 d.
d.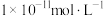
(3)明矾[化学式为 ]溶液呈
]溶液呈___________ 性(填“酸”“碱”或“中”),原因是___________ (用离子方程式表示)。
(4)某反应过程的能量变化如下图所示。请填写下列空白。___________ (填“a”或“b”)有催化剂参与。
②该反应为反应___________ (填“放热”或“吸热”),反应热为___________ 。
(5)在容积不变的密闭容器中,一定量的SO2、O2发生反应: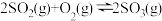 。温度分别为t1和t2时,
。温度分别为t1和t2时, 的体积分数随时间的变化如图所示。该反应的
的体积分数随时间的变化如图所示。该反应的
___________ 0(填“>”“<”或“=”,下同);若t1、t2时该反应的化学平衡常数分别为K1、K2,则K1___________ K2。
(1)某种酱油的pH为5,则该酱油中的c(H+)=
(2)在常温下,柠檬水的pH为3,其中的c(OH-)为
a.0.1 mol∙L−1 b.
 c.
c.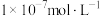 d.
d.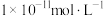
(3)明矾[化学式为
 ]溶液呈
]溶液呈(4)某反应过程的能量变化如下图所示。请填写下列空白。
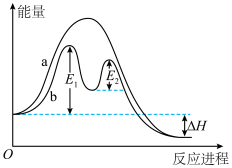
②该反应为反应
(5)在容积不变的密闭容器中,一定量的SO2、O2发生反应:
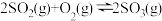 。温度分别为t1和t2时,
。温度分别为t1和t2时, 的体积分数随时间的变化如图所示。该反应的
的体积分数随时间的变化如图所示。该反应的
您最近一年使用:0次
解题方法
9 . 按要求回答下列问题:
(1)下列变化中属于吸热反应的是_______ 。
①铝片与稀盐酸的反应 ②将胆矾加热变为白色粉末 ③干冰汽化 ④氯酸钾分解制氧气 ⑤甲烷在氧气中的燃烧反应
(2)反应C(s)+H2O(g) CO(g)+H2(g)在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是_______ 。
①增加C的量
②将容器的体积缩小一半
③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器体积变大
(3)在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图:
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图:

①从3min到9min,v(CO2)=_______ (结果保留两位有效数字);a点时v(正)_______ v(逆)(填>、<或=)。
②若已知生成标准状况下2.24LCH3OH(g)时放出热量为4.9kJ,而上述反应的实际放热量总小于49kJ,其原因是_______ 。
(4)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示。
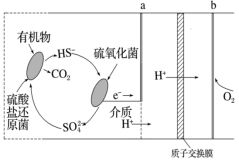
①该微生物燃料电池,负极为_______ (填“a”或“b”)。
②该电池正极电极反应式为_______ 。
③当电路中有0.5mol电子发生转移,则有_______ mol的H+通过质子交换膜。
(1)下列变化中属于吸热反应的是
①铝片与稀盐酸的反应 ②将胆矾加热变为白色粉末 ③干冰汽化 ④氯酸钾分解制氧气 ⑤甲烷在氧气中的燃烧反应
(2)反应C(s)+H2O(g)
 CO(g)+H2(g)在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是①增加C的量
②将容器的体积缩小一半
③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器体积变大
(3)在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图:
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图:
①从3min到9min,v(CO2)=
②若已知生成标准状况下2.24LCH3OH(g)时放出热量为4.9kJ,而上述反应的实际放热量总小于49kJ,其原因是
(4)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示。

①该微生物燃料电池,负极为
②该电池正极电极反应式为
③当电路中有0.5mol电子发生转移,则有
您最近一年使用:0次
10 . 按要求回答下列问题:
(1)下列过程中,既属于氧化还原反应,又属于吸热反应的是_______ 。
①甲烷的燃烧 ②水煤气的制备 ③石灰石受热分解 ④碘升华 ⑤金属的锈蚀
(2)一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应(产物均为气体),反应中各物质物质的量的变化如图所示。______________________ 。
②在0~6 s内,B的化学反应速率为________________ 。
③6s后容器内的压强与开始时压强之比为_____________ 。
(3)一定条件下,H2、CO在体积固定的绝热密闭容器中发生如下反应:2CO(g)+ 4H2(g)⇌ CH3OCH3(g)+H2O(g),
下列选项不能判断该反应达到平衡状态的依据的________________ 。
①密闭容器中CO的体积分数不变
②密闭容器中总压强不变
③密闭容器中混合气体的密度不变
④密闭容器中混合气体的平均相对分子质量不变
⑤体系内的温度不再变化
⑥单位时间内,断裂4mol H-H键,同时生成2mol H-O键
(4)潜艇中使用的液氨液氧燃料电池工作原理如图所示:_______ (填“正极”或“负极”),其电极反应为_____________________ 。
(1)下列过程中,既属于氧化还原反应,又属于吸热反应的是
①甲烷的燃烧 ②水煤气的制备 ③石灰石受热分解 ④碘升华 ⑤金属的锈蚀
(2)一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应(产物均为气体),反应中各物质物质的量的变化如图所示。

②在0~6 s内,B的化学反应速率为
③6s后容器内的压强与开始时压强之比为
(3)一定条件下,H2、CO在体积固定的绝热密闭容器中发生如下反应:2CO(g)+ 4H2(g)⇌ CH3OCH3(g)+H2O(g),
下列选项不能判断该反应达到平衡状态的依据的
①密闭容器中CO的体积分数不变
②密闭容器中总压强不变
③密闭容器中混合气体的密度不变
④密闭容器中混合气体的平均相对分子质量不变
⑤体系内的温度不再变化
⑥单位时间内,断裂4mol H-H键,同时生成2mol H-O键
(4)潜艇中使用的液氨液氧燃料电池工作原理如图所示:
您最近一年使用:0次



