解题方法
1 . 现代社会人类的一切活动都离不开能量,许多能量的利用与化学反应中的能量变化密切相关。
Ⅰ.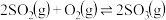 是工业制硫酸的主要反应之一,研究该反应的速率和限度有着重要的现实意义。
是工业制硫酸的主要反应之一,研究该反应的速率和限度有着重要的现实意义。
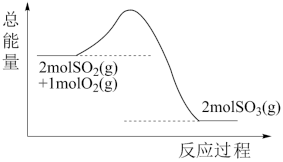
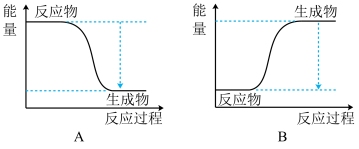
(1)反应过程的能量变化如图所示,该反应为_______ (填“放热”或“吸热”)反应。
(2)一定条件下,在2L密闭容器中加入4mol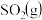 、6mol
、6mol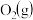 和2mol
和2mol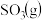 发生上述反应,在2min末达到平衡,测得
发生上述反应,在2min末达到平衡,测得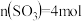 。
。
①0~2min内的平均反应速率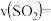
_______  。
。
②2min末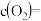
_______  。
。
③若其他条件不变,将容器的容积扩大至3L,该化学反应速率将_______ (填“增大”“不变”或“减小”)。
④恒温恒容下,能说明该反应达到化学平衡状态的是_______ (填字母序号)。
a.
b.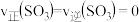
c.混合气体的压强不再变化
d.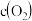 不再变化
不再变化
e.单位时间内生成nmol 的同时生成2nmol
的同时生成2nmol
Ⅱ.完成下列问题
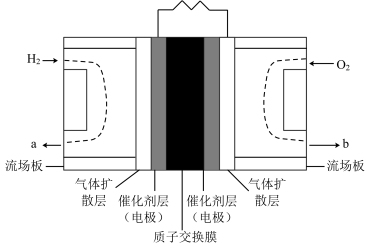
(3)氢氧燃料电池是公认的最适合载人航天器的化学能源。如图所示为第二代质子( )交换膜燃料电池,电池装置上加装冷凝水接收装置,应接在位置
)交换膜燃料电池,电池装置上加装冷凝水接收装置,应接在位置_______ (填“a”或“b”)处。正极电极反应式:_______ ;负极电极反应式:_______ 。
Ⅰ.
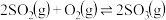 是工业制硫酸的主要反应之一,研究该反应的速率和限度有着重要的现实意义。
是工业制硫酸的主要反应之一,研究该反应的速率和限度有着重要的现实意义。
(1)反应过程的能量变化如图所示,该反应为
(2)一定条件下,在2L密闭容器中加入4mol
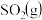 、6mol
、6mol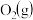 和2mol
和2mol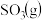 发生上述反应,在2min末达到平衡,测得
发生上述反应,在2min末达到平衡,测得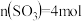 。
。①0~2min内的平均反应速率
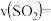
 。
。②2min末
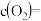
 。
。③若其他条件不变,将容器的容积扩大至3L,该化学反应速率将
④恒温恒容下,能说明该反应达到化学平衡状态的是
a.

b.
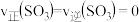
c.混合气体的压强不再变化
d.
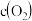 不再变化
不再变化e.单位时间内生成nmol
 的同时生成2nmol
的同时生成2nmol
Ⅱ.完成下列问题
(3)氢氧燃料电池是公认的最适合载人航天器的化学能源。如图所示为第二代质子(
 )交换膜燃料电池,电池装置上加装冷凝水接收装置,应接在位置
)交换膜燃料电池,电池装置上加装冷凝水接收装置,应接在位置
您最近一年使用:0次
2 . 现代社会的一切活动都离不开能量,化学反应在发生物质变化的同时伴随有能量变化,能量、速率与限度是认识和研究化学反应的重要视角。
I.化学能与热能之间可以相互转化。
子轩和紫萱两位同学做如下实验,以检验反应中的能量变化。
(1)实验发现反应后(a)中温度升高,由此可以判断(a)中发生的反应是_______ (填“吸”或“放”,下同)热反应;(b)中温度降低,由此可以判断(b)中发生的反应是_______ 热反应。
(2)根据能量守恒定律,(b)中反应物的总能量应该____ (填“低于”或“高于”)其生成物的总能量。
II.化学能与电能之间可以相互转化。
2020年上海进博会展览中,诸多氢能源汽车纷纷亮相。氢燃料电池被誉为氢能源汽车的心脏。某种氢燃料电池的内部结构如图所示。
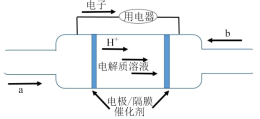

(3)_______ (填“a”或“b”)处通入氧气。
(4)该电池每消耗 氢气,电路中通过的电子数目为
氢气,电路中通过的电子数目为_______ 。
(5)左侧电极为电池的_______ (填“正极”或“负极”)。
(6)右侧的电极反应式为_______ 。
III.在2L的恒容密闭容器中充入 和
和 ,一定条件下发生反应:
,一定条件下发生反应: ,测得
,测得 和
和 的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
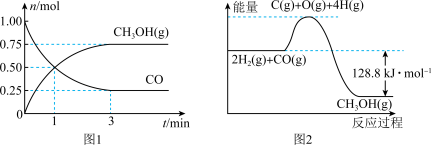
(7)从反应开始至达到平衡,以CO表示该反应的平均反应速率
_______  。下列措施能增大反应速率的是
。下列措施能增大反应速率的是_______ (填字母)。
A.升高温度 B.降低压强 C.减小 的浓度 D.加入合适的催化剂
的浓度 D.加入合适的催化剂
(8)下列描述能说明反应 达到平衡状态的是_______(填字母)。
达到平衡状态的是_______(填字母)。
(9)平衡时CO的体积分数为_______ (保留3位有效数字)。
(10)已知断开 和
和 中的化学键需要吸收的能量为
中的化学键需要吸收的能量为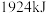 ,则断开
,则断开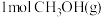 中的化学键需要吸收
中的化学键需要吸收_______  的能量。
的能量。
I.化学能与热能之间可以相互转化。
子轩和紫萱两位同学做如下实验,以检验反应中的能量变化。

(1)实验发现反应后(a)中温度升高,由此可以判断(a)中发生的反应是
(2)根据能量守恒定律,(b)中反应物的总能量应该
II.化学能与电能之间可以相互转化。
2020年上海进博会展览中,诸多氢能源汽车纷纷亮相。氢燃料电池被誉为氢能源汽车的心脏。某种氢燃料电池的内部结构如图所示。


(3)
(4)该电池每消耗
 氢气,电路中通过的电子数目为
氢气,电路中通过的电子数目为(5)左侧电极为电池的
(6)右侧的电极反应式为
III.在2L的恒容密闭容器中充入
 和
和 ,一定条件下发生反应:
,一定条件下发生反应: ,测得
,测得 和
和 的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
(7)从反应开始至达到平衡,以CO表示该反应的平均反应速率

 。下列措施能增大反应速率的是
。下列措施能增大反应速率的是A.升高温度 B.降低压强 C.减小
 的浓度 D.加入合适的催化剂
的浓度 D.加入合适的催化剂(8)下列描述能说明反应
 达到平衡状态的是_______(填字母)。
达到平衡状态的是_______(填字母)。| A.CO、H2和CH3OH三种物质的浓度相等 |
| B.密闭容器中混合气体的密度不随时间的变化而变化 |
| C.密闭容器中混合气体的总物质的量不随时间的变化而变化 |
D.单位时间内消耗 的同时生成 的同时生成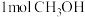 |
(10)已知断开
 和
和 中的化学键需要吸收的能量为
中的化学键需要吸收的能量为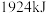 ,则断开
,则断开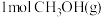 中的化学键需要吸收
中的化学键需要吸收 的能量。
的能量。
您最近一年使用:0次
2022-07-07更新
|
192次组卷
|
2卷引用:陕西省渭南市临渭区2021-2022学年高一下学期期末教学质量检测化学试卷
3 . 从能量变化和反应快慢等角度研究反应具有重要意义。下列实验可以检验反应中的能量变化。
(1)下图能正确表示实验(a)反应中能量变化的是___________ (填序号)。
实验(b)中发生反应的化学方程式为___________ 。
(2)若将实验(a)中的反应设计成原电池,正极反应为___________ ;若转移了0.6mol电子,参加反应的负极材料是___________ g。
(3)一定温度下,将3mol A气体和1mol B气体通入2L容积固定的密闭容器中,发生如下反应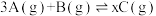 ,反应1min时测得剩余1.8mol A,C的浓度为0.4
,反应1min时测得剩余1.8mol A,C的浓度为0.4 ,则1min内,B的平均反应速率为
,则1min内,B的平均反应速率为___________  ;若反应经2min达到平衡,平衡时C的浓度
;若反应经2min达到平衡,平衡时C的浓度___________ 0.8 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。

(1)下图能正确表示实验(a)反应中能量变化的是

实验(b)中发生反应的化学方程式为
(2)若将实验(a)中的反应设计成原电池,正极反应为
(3)一定温度下,将3mol A气体和1mol B气体通入2L容积固定的密闭容器中,发生如下反应
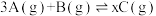 ,反应1min时测得剩余1.8mol A,C的浓度为0.4
,反应1min时测得剩余1.8mol A,C的浓度为0.4 ,则1min内,B的平均反应速率为
,则1min内,B的平均反应速率为 ;若反应经2min达到平衡,平衡时C的浓度
;若反应经2min达到平衡,平衡时C的浓度 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。
您最近一年使用:0次
2022-06-22更新
|
132次组卷
|
2卷引用:河南省郑州市巩义,中牟,登封等六县2021-2022学年高一下学期期末联考化学试题
名校
解题方法
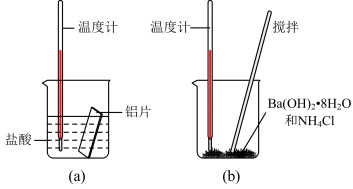
4 . Ⅰ.某实验小组同学进行如下实验,以检验化学反应中的能量变化。请回答下列问题:

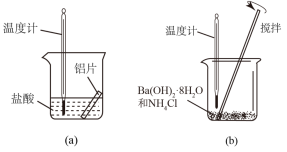
(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断Ba(OH)2•8H2O与NH4Cl的反应是_______ (填“放热反应”或“吸热反应”),反应过程_______ 的能量变化可用图2表示(填“①”或“②”)。
(2)现有如下两个反应:A、NaOH+HCl=NaCl+H2O;B、2FeCl3+Cu=2FeCl2+CuCl2,以上两个反应能设计成原电池的是_______ ,负极材料为:_______ ,电解质溶液为:_______ ,负极的电极反应式为:_______ 。
Ⅱ.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。利用如图装置可验证同主族元素非金属性的变化规律

(3)干燥管D的作用为_______ 。
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液_______ (填现象)即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用NaOH溶液吸收尾气。
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中可加_______ 溶液,观察到C中溶液_______ (填现象),即可证明,反应的离子方程式为:_______ ,但有的同学认为该实验不严谨,应在两装置间添加装有_______ 溶液的洗气瓶,目的是_______ 。

(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断Ba(OH)2•8H2O与NH4Cl的反应是
(2)现有如下两个反应:A、NaOH+HCl=NaCl+H2O;B、2FeCl3+Cu=2FeCl2+CuCl2,以上两个反应能设计成原电池的是
Ⅱ.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。利用如图装置可验证同主族元素非金属性的变化规律

(3)干燥管D的作用为
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中可加
您最近一年使用:0次
名校
5 . 某学习小组做如下实验,以检验反应中的能量变化_______ 热反应;
(2)若将(a)中的反应设计成原电池,其_______ 能转化为_______ 能,则负极反应式为_______ 。电路中通过 电子时,则
电子时,则_______ (填“正极”或“负极”)产生标况下氢气体积约_______
(3)(b)中温度降低,由此可以判断(b)中反应,断裂旧键吸收的能量_______ 形成新建释放的能量(填“大于”或“小于”);根据能量守恒定律,(b)中反应物的总能量应该_______ 其生成物的总能量(填“大于”或“小于”)。若将(b)中的反应设计成原电池,是否可行?_______ (填“是”或“否”)
(4)该小组反思原电池的原理,其中观点正确的是_______(填字母)。

(2)若将(a)中的反应设计成原电池,其
 电子时,则
电子时,则(3)(b)中温度降低,由此可以判断(b)中反应,断裂旧键吸收的能量
(4)该小组反思原电池的原理,其中观点正确的是_______(填字母)。
| A.原电池反应的过程中可能没有电子发生转移 |
| B.原电池装置需要2个电极 |
| C.电极一定不能参加反应 |
| D.氧化反应和还原反应可以拆开在两极发生 |
您最近一年使用:0次
6 . 根据所学知识回答下列有关问题。
(1)信息技术离不开芯片,现代芯片离不开高纯度的硅,工业上生产高纯硅的工艺流程如下:
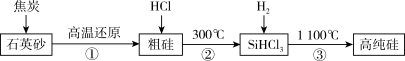
①硅除用于制造芯片外,在能量转化方面也有极为重要的用途,该用途是_______ (填一种),写出制备粗硅反应的化学方程式:_______ 。
②过程②是置换反应,则该反应中得到的单质为_______ (填化学式)。
(2)碳纳米材料是一种具有重要用途的新型无机非金属材料,其中 的化学性质与金刚石
的化学性质与金刚石_______ (填“相似”或“不同”),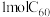 完全燃烧时需要消耗
完全燃烧时需要消耗_______ 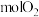 ,该反应会
,该反应会_______ (填“吸收”或“释放”)能量。
(1)信息技术离不开芯片,现代芯片离不开高纯度的硅,工业上生产高纯硅的工艺流程如下:

①硅除用于制造芯片外,在能量转化方面也有极为重要的用途,该用途是
②过程②是置换反应,则该反应中得到的单质为
(2)碳纳米材料是一种具有重要用途的新型无机非金属材料,其中
 的化学性质与金刚石
的化学性质与金刚石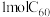 完全燃烧时需要消耗
完全燃烧时需要消耗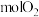 ,该反应会
,该反应会
您最近一年使用:0次
2022-04-13更新
|
327次组卷
|
2卷引用:河南省豫北名校2021-2022学年高一下学期中考试化学试题
7 . 化学反应与能量变化是化学研究的重要问题,根据相关材料分析回答:
(1)已知断开1mol下列物质中的化学键需要吸收的能量如下表:
根据以上数据判断:N2 + O2 = 2NO属于___________ 反应(填“放热”或“吸热”)。
(2)符合某些特征的化学反应理论上都可以设计成原电池。下列化学反应___________ (填字母)不能设计成原电池,原因是___________ 。
A.CH4+2O2=CO2+2H2O
B.Fe+CuSO4=FeSO4+Cu
C.2NaOH + H2SO4 = Na2SO4 + 2H2O
D.Pb+PbO2+2H2SO4=2PbSO4+2H2O
(3)把A、B、C、D四种金属按表中装置进行实验。
根据表中信息判断四种金属活动性由大到小的顺序是___________ ;写出装置乙中正极的电极反应式:___________ 。
(4)锂离子电池已经成为新一代实用的蓄电池,它具有能量密度大、电压高的特性。某锂离子电池放电时电极反应如下:
负极Li-e-= Li+,
正极Li1-xMnO2+xLi++xe-=LiMnO2
该锂离子电池放电时电池的反应方程式为___________ 。
(1)已知断开1mol下列物质中的化学键需要吸收的能量如下表:
| 物质 | N2 | O2 | NO |
| 吸收的能量 | 946kJ | 498 kJ | 632kJ |
根据以上数据判断:N2 + O2 = 2NO属于
(2)符合某些特征的化学反应理论上都可以设计成原电池。下列化学反应
A.CH4+2O2=CO2+2H2O
B.Fe+CuSO4=FeSO4+Cu
C.2NaOH + H2SO4 = Na2SO4 + 2H2O
D.Pb+PbO2+2H2SO4=2PbSO4+2H2O
(3)把A、B、C、D四种金属按表中装置进行实验。
| 装置 | 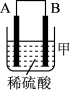 | 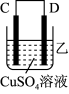 | 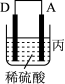 |
| 电子从A到B | C电极的质量增加 | 二价金属D不断溶解 |
根据表中信息判断四种金属活动性由大到小的顺序是
(4)锂离子电池已经成为新一代实用的蓄电池,它具有能量密度大、电压高的特性。某锂离子电池放电时电极反应如下:
负极Li-e-= Li+,
正极Li1-xMnO2+xLi++xe-=LiMnO2
该锂离子电池放电时电池的反应方程式为
您最近一年使用:0次
8 . I.扎西和央拉两位同学做如下实验,以检验反应中的能量变化。
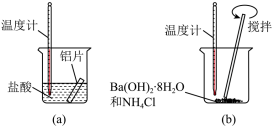
(1)实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是______ 热反应;(b)中温度降低,由此可以判断(b)中反应是_______ 热反应。
(2)根据能量守恒定律,(b)中反应物的总能量应该______ 其生成物的总能量。
II.
(3)下图表示一定条件下,A、B、C三种气体物质的量浓度随时间变化的情形,回答下列问题:
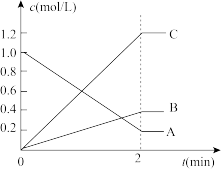
①该反应的反应物是___________ 。
②在0~2min,该反应用A表示的平均反应速率为_______ 。
③该反应的化学方程式为___________ 。

(1)实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是
(2)根据能量守恒定律,(b)中反应物的总能量应该
II.
(3)下图表示一定条件下,A、B、C三种气体物质的量浓度随时间变化的情形,回答下列问题:

①该反应的反应物是
②在0~2min,该反应用A表示的平均反应速率为
③该反应的化学方程式为
您最近一年使用:0次
9 . 完成下列问题:
(1)实验探究
结论:化学反应除了有新物质生成以外,还总会伴随着能量变化,通常主要表现为热能的变化,有的___________ 热量,有的___________ 热量。
(2)放热反应和吸热反应
(1)概念
①放热反应:___________ 热量的化学反应。
②吸热反应:___________ 热量的化学反应。
(2)常见的放热反应和吸热反应
(1)实验探究
| 实验操作 | 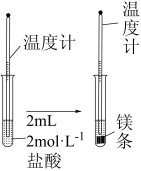 | 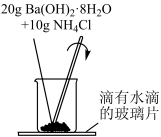 |
| 实验现象 | 有 | 闻到 |
| 实验结论 | 该反应产生 | 该反应产生NH3和H2O, |
| 化学方程式 |
(2)放热反应和吸热反应
(1)概念
①放热反应:
②吸热反应:
(2)常见的放热反应和吸热反应
| 放热反应 | 吸热反应 |
| ①所有燃烧反应 ②酸碱中和反应 ③大多数化合反应 ④活泼金属跟水或酸的反应 ⑤物质的缓慢氧化 | ①大多数分解反应 ②铵盐与碱的反应,如Ba(OH)2·8H2O或Ca(OH)2与NH4Cl反应 ③以C、H2、CO为还原剂的氧化还原反应,如C与H2O(g)反应,C与CO2反应 ④NaHCO3与盐酸的反应 |
您最近一年使用:0次
10 . 某化学兴趣小组进行了实验:向2支试管中分别加入0.5 g Na2CO3固体和0.5 gNaHCO3固体,再分别加入30 mL 0.3 mol·L-1盐酸,充分反应后,用手触摸试管,明显感觉到加Na2CO3固体的试管变热了,加NaHCO3固体的试管变冷了。甲同学由此得出结论:CO (aq) +2H+ (aq)=H2O(1) +CO2(g)△H1<0, HCO
(aq) +2H+ (aq)=H2O(1) +CO2(g)△H1<0, HCO (aq)+H+ (aq)=H2O(1) +CO2(g) △H2>0。回答下列问题:
(aq)+H+ (aq)=H2O(1) +CO2(g) △H2>0。回答下列问题:
(1)乙同学认为该实验不一定能得到甲同学的结论,你支持谁的观点?_____ (填“甲”或“乙”) ,理由是_______ 。
(2)查阅资料:
反应I :CO (aq) +2H+ (aq)=H2O(l) +CO2(g) △H1= -12.14kJ· mol-1;
(aq) +2H+ (aq)=H2O(l) +CO2(g) △H1= -12.14kJ· mol-1;
反应II :HCO (aq) +H+ (aq)=H2O(l) +CO2(g) △H2= +12.64 kJ·mol-1。
(aq) +H+ (aq)=H2O(l) +CO2(g) △H2= +12.64 kJ·mol-1。
向V mLc mol· L-1碳酸钠溶液中,逐滴加入2V mLc mol·L-1稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是 (填标号)。
(3)该化学兴趣小组用如图所示装置设计了实验,验证碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应。
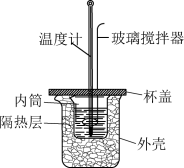
表格一:
表格二:
表格三:
实验操作:将试剂1与试剂2混合,测混合后溶液的温度,静置,冷却至定温,再将试剂3与之前的混合溶液混合,再测混合溶液的温度。
①实验中玻璃搅拌器的使用方法是_______________ 。
②表格二对应实验得出的结论是________________ 。
③反应III:Na2CO3(s) +2H+ (aq)=2Na+ (aq) +H2O(1) +CO2(g) △H3;
反应IV:NaHCO3(s)+ H+ (aq)=Na+ (aq) + H2O(l) +CO2(g) △H4。
则△H1______ (填“>”、“< ”或“=”,下同) △H3,△H2______ △H4。
 (aq) +2H+ (aq)=H2O(1) +CO2(g)△H1<0, HCO
(aq) +2H+ (aq)=H2O(1) +CO2(g)△H1<0, HCO (aq)+H+ (aq)=H2O(1) +CO2(g) △H2>0。回答下列问题:
(aq)+H+ (aq)=H2O(1) +CO2(g) △H2>0。回答下列问题:(1)乙同学认为该实验不一定能得到甲同学的结论,你支持谁的观点?
(2)查阅资料:
反应I :CO
 (aq) +2H+ (aq)=H2O(l) +CO2(g) △H1= -12.14kJ· mol-1;
(aq) +2H+ (aq)=H2O(l) +CO2(g) △H1= -12.14kJ· mol-1;反应II :HCO
 (aq) +H+ (aq)=H2O(l) +CO2(g) △H2= +12.64 kJ·mol-1。
(aq) +H+ (aq)=H2O(l) +CO2(g) △H2= +12.64 kJ·mol-1。向V mLc mol· L-1碳酸钠溶液中,逐滴加入2V mLc mol·L-1稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是 (填标号)。
A.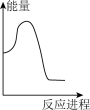 | B.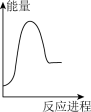 | C.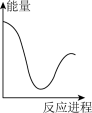 | D.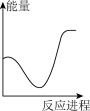 |

表格一:
试剂1 | 试剂2混合前温度/℃ | 混合后温度/℃ |
0.5 g Na2CO3 | 40mL HCl 19.0 | 21.7 |
0.5 g NaHCO3 | 40 mL HCl 19.0 | 18.1 |
表格二:
试剂1 | 试剂2混合 前温度/℃ | 溶解后温 度/℃ | 静置后的 温度/℃ | 试剂3混合 前温度/℃ | 混合后 温度/℃ |
0.5 g Na2CO3 | 10 mL H2O19.0 | 22. 3 | 19.0 | 10mL H2O 19.0 | 19.0 |
0.5 g NaHCO3 | 10 mL H2O19.0 | 17.5 | 19.0 | 10 mL H2O 19.0 | 19.0 |
表格三:
试剂1 | 试剂2混合 前温度/℃ | 溶解后温 度/℃ | 静置后的 温度/℃ | 试剂3混合 前温度/℃ | 混合后 温度/℃ |
0.5 g Na2CO3 | 10 mL H2O19.0 | 22.3 | 19.0 | 10mL HCl 19.0 | 20.5 |
0.5 g NaHCO3 | 10 mL H2O19.0 | 17.5 | 19.0 | 10 mL HCl19.0 | 18.3 |
实验操作:将试剂1与试剂2混合,测混合后溶液的温度,静置,冷却至定温,再将试剂3与之前的混合溶液混合,再测混合溶液的温度。
①实验中玻璃搅拌器的使用方法是
②表格二对应实验得出的结论是
③反应III:Na2CO3(s) +2H+ (aq)=2Na+ (aq) +H2O(1) +CO2(g) △H3;
反应IV:NaHCO3(s)+ H+ (aq)=Na+ (aq) + H2O(l) +CO2(g) △H4。
则△H1
您最近一年使用:0次



