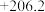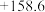1 . 工业生产和社会生活重要应用。
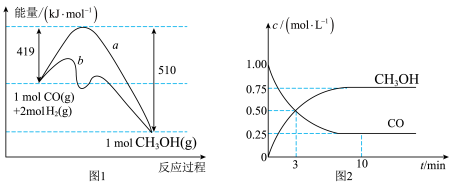
I.工业上用CO生产燃料甲醇,一定条件下发生反应: 。图1表示反应中能量变化;图2表示一定温度下,在容积为2L的密闭容器中加入
。图1表示反应中能量变化;图2表示一定温度下,在容积为2L的密闭容器中加入 和一定量的CO后,CO和
和一定量的CO后,CO和 的浓度随时间变化。
的浓度随时间变化。
请回答下列问题:
(1)在图1中,曲线_______ (填“a”或“b”)表示使用了催化剂。
(2)该反应属于_______ (填“吸热”或“放热”)反应。
(3)增大反应体系压强,则该反应化学平衡常数_______ (填“增大”“减小”或“不变”)。
II. 溶液是一种重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用
溶液是一种重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用 溶液进行以下实验探究:
溶液进行以下实验探究:
(4)以 溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是_______ (填字母)。
a.溶液中 向阳极移动 b.粗铜接电源正极,发生还原反应
向阳极移动 b.粗铜接电源正极,发生还原反应
c.电解后 溶液的浓度减小 d.利用阳极泥可回收Ag、Pt、Au等金属
溶液的浓度减小 d.利用阳极泥可回收Ag、Pt、Au等金属
(5)下图中,I是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在II中实现铁上镀铜:
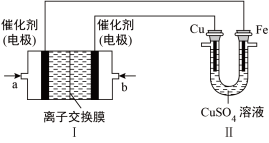
①b处通入的是_______ (填“ ”或“
”或“ ”),a处的电极反应式为
”),a处的电极反应式为_______ 。
②当铜电极的质量减轻3.2g,则消耗的 在标准状况下的体积为
在标准状况下的体积为_______ 。
I.工业上用CO生产燃料甲醇,一定条件下发生反应:
 。图1表示反应中能量变化;图2表示一定温度下,在容积为2L的密闭容器中加入
。图1表示反应中能量变化;图2表示一定温度下,在容积为2L的密闭容器中加入 和一定量的CO后,CO和
和一定量的CO后,CO和 的浓度随时间变化。
的浓度随时间变化。
请回答下列问题:
(1)在图1中,曲线
(2)该反应属于
(3)增大反应体系压强,则该反应化学平衡常数
II.
 溶液是一种重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用
溶液是一种重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用 溶液进行以下实验探究:
溶液进行以下实验探究:(4)以
 溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是a.溶液中
 向阳极移动 b.粗铜接电源正极,发生还原反应
向阳极移动 b.粗铜接电源正极,发生还原反应c.电解后
 溶液的浓度减小 d.利用阳极泥可回收Ag、Pt、Au等金属
溶液的浓度减小 d.利用阳极泥可回收Ag、Pt、Au等金属(5)下图中,I是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在II中实现铁上镀铜:

①b处通入的是
 ”或“
”或“ ”),a处的电极反应式为
”),a处的电极反应式为②当铜电极的质量减轻3.2g,则消耗的
 在标准状况下的体积为
在标准状况下的体积为
您最近一年使用:0次
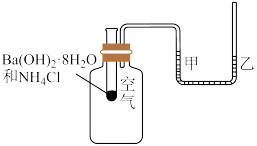
2 . 如图所示,在一个小烧杯里加入研细的20gBa(OH)2·8H2O晶体。将此小烧杯放在事先滴有3~4滴水的玻璃片上,然后向小烧杯中加入10gNH4Cl晶体,并用玻璃棒快速搅拌。

(1)该实验中观察到的现象除产生刺激性气味的气体及反应混合物呈糊状以外,还有_____ 。该反应_____ (填“是”或“不是”)氧化还原反应。
(2)该反应为_____ (填“吸”或“放”)热反应,说明反应物的总能量_____ (填“大于”或“小于”)生成物的总能量。
(3)实验中要用玻璃棒搅拌的原因是______ 。

(1)该实验中观察到的现象除产生刺激性气味的气体及反应混合物呈糊状以外,还有
(2)该反应为
(3)实验中要用玻璃棒搅拌的原因是
您最近一年使用:0次
3 . I.目前我国城市居民所用燃料一般为煤气与石油液化气两种。煤气的主要成分为一氧化碳与氢气,煤气主要是在高温下由煤炭与水蒸气反应制得的;石油液化气的主要成分是 。
。
请回答下列问题:
(1)由煤炭制备煤气的化学方程式为_______ ,该反应的△S_______ 0(填“>”或“<”)。
已知:C3H8(g)+ O2(g)=3CO(g)+4H2(g) △H=-227.7kJ/mol
O2(g)=3CO(g)+4H2(g) △H=-227.7kJ/mol
CO(g)+ O2(g)=CO2(g) △H=-283.0kJ/mol
O2(g)=CO2(g) △H=-283.0kJ/mol
H2(g)+ O2(g)=H2O(l) △H=-285.8kJ/mol
O2(g)=H2O(l) △H=-285.8kJ/mol
(2)C3H8(g)完全燃烧生成H2O(l)的热化学方程式为_______ 。
II.汽车尾气中的主要污染物是NOx(包括NO、 等氮氧化物)和CO。
等氮氧化物)和CO。
(3)汽车发动机工作时会引发N2和O2反应生成NO,其能量变化如图1所示,则图1中三种分子中最稳定的是_______ (填化学式)。
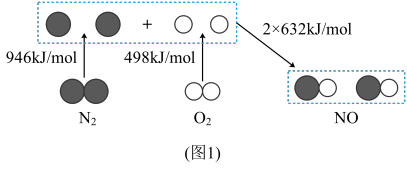
N2O和CO均是有害气体,可在Pt2O+表面转化为无害气体,其反应原理如下:N2O(g)+CO(g)=CO2(g)+N2(g) △H=QkJ/mol。有关能量变化过程如图2所示。
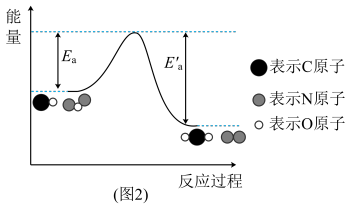
(4)图2中反应是_______ (填“放热”或“吸热”)反应。
(5)在反应体系中加入Pt2O+作为该反应的催化剂,则△H_______ QkJ/mol(选填“>”“<”或“=”)。
 。
。请回答下列问题:
(1)由煤炭制备煤气的化学方程式为
已知:C3H8(g)+
 O2(g)=3CO(g)+4H2(g) △H=-227.7kJ/mol
O2(g)=3CO(g)+4H2(g) △H=-227.7kJ/molCO(g)+
 O2(g)=CO2(g) △H=-283.0kJ/mol
O2(g)=CO2(g) △H=-283.0kJ/molH2(g)+
 O2(g)=H2O(l) △H=-285.8kJ/mol
O2(g)=H2O(l) △H=-285.8kJ/mol(2)C3H8(g)完全燃烧生成H2O(l)的热化学方程式为
II.汽车尾气中的主要污染物是NOx(包括NO、
 等氮氧化物)和CO。
等氮氧化物)和CO。(3)汽车发动机工作时会引发N2和O2反应生成NO,其能量变化如图1所示,则图1中三种分子中最稳定的是

N2O和CO均是有害气体,可在Pt2O+表面转化为无害气体,其反应原理如下:N2O(g)+CO(g)=CO2(g)+N2(g) △H=QkJ/mol。有关能量变化过程如图2所示。

(4)图2中反应是
(5)在反应体系中加入Pt2O+作为该反应的催化剂,则△H
您最近一年使用:0次
名校
解题方法
4 . 化学反应过程伴随着能量的变化。
(1)下列反应中属于吸热反应的有_______ (填序号)。
①燃烧木炭取暖② C与 (g)反应制取水煤气 ③煅烧石灰石(主要成分是
(g)反应制取水煤气 ③煅烧石灰石(主要成分是 )制生石灰 ④氯化铵晶体和
)制生石灰 ④氯化铵晶体和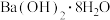 混合搅拌 ⑤食物因氧化而腐败
混合搅拌 ⑤食物因氧化而腐败
(2) 催化重整不仅可以得到合成气(CO和
催化重整不仅可以得到合成气(CO和 ),还对温室气体的减排具有重要意义。
),还对温室气体的减排具有重要意义。 催化重整反应为:
催化重整反应为: 。
。
已知:

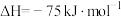
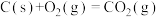
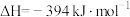
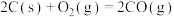
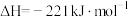
该催化重整反应的△H=_______  。
。
(3)利用 可制备乙烯及合成气(CO、
可制备乙烯及合成气(CO、 )。有关化学键键能(E)的数据如下表:
)。有关化学键键能(E)的数据如下表:
①已知
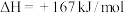 ,则a=
,则a=_______ 。
②已知 的燃烧热是890.31kJ/mol,表示
的燃烧热是890.31kJ/mol,表示 燃烧热的热化学方程式
燃烧热的热化学方程式_______ ;
③制备合成气反应历程分两步,
步骤I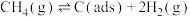 ;
;
步骤Ⅱ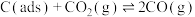 。上述反应中(ads)吸附性活性炭,反应历程的能量变化如图:
。上述反应中(ads)吸附性活性炭,反应历程的能量变化如图:

表示步骤I正反应的_______ ,决定制备合成气反应速率的是_______ (填“步骤I”或“步骤Ⅱ”)。
(1)下列反应中属于吸热反应的有
①燃烧木炭取暖② C与
 (g)反应制取水煤气 ③煅烧石灰石(主要成分是
(g)反应制取水煤气 ③煅烧石灰石(主要成分是 )制生石灰 ④氯化铵晶体和
)制生石灰 ④氯化铵晶体和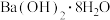 混合搅拌 ⑤食物因氧化而腐败
混合搅拌 ⑤食物因氧化而腐败(2)
 催化重整不仅可以得到合成气(CO和
催化重整不仅可以得到合成气(CO和 ),还对温室气体的减排具有重要意义。
),还对温室气体的减排具有重要意义。 催化重整反应为:
催化重整反应为: 。
。已知:

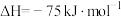
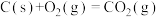
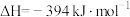
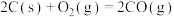
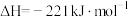
该催化重整反应的△H=
 。
。(3)利用
 可制备乙烯及合成气(CO、
可制备乙烯及合成气(CO、 )。有关化学键键能(E)的数据如下表:
)。有关化学键键能(E)的数据如下表:| 化学键 | H-H | C=C | C-C | C-H |
| E(kJ/mol) | 436 | a | 348 | 413 |

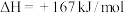 ,则a=
,则a=②已知
 的燃烧热是890.31kJ/mol,表示
的燃烧热是890.31kJ/mol,表示 燃烧热的热化学方程式
燃烧热的热化学方程式③制备合成气反应历程分两步,
步骤I
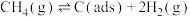 ;
;步骤Ⅱ
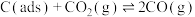 。上述反应中(ads)吸附性活性炭,反应历程的能量变化如图:
。上述反应中(ads)吸附性活性炭,反应历程的能量变化如图:
表示步骤I正反应的
您最近一年使用:0次
解题方法
5 . 反应 过程中的能量变化如下图所示,回答下列问题。
过程中的能量变化如下图所示,回答下列问题。_______ 热反应(填“吸”、“放”)。
②在反应体系中加入催化剂,反应速率增大,
_______ ,
_______ (填增大”、“减小”或“不变”)。
③当反应达到平衡时,升高温度,A的转化率_______ (填“增大”、“减小”或“不变”)。
(2)一定条件下,一氧化碳与氢气反应可以合成甲醇。已知:
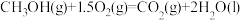
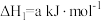
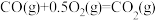
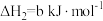
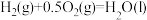
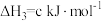
则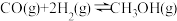

_______  (用a、b、c表示)。
(用a、b、c表示)。
(3)一定压强下,在容积为 的密闭容器中充入
的密闭容器中充入 与
与 ,在催化剂作用下发生反应:
,在催化剂作用下发生反应: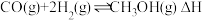 ,平衡转化率与温度、压强的关系如图所示。则
,平衡转化率与温度、压强的关系如图所示。则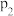
_______  (填“>”、“<”或“=”);
(填“>”、“<”或“=”);
 过程中的能量变化如下图所示,回答下列问题。
过程中的能量变化如下图所示,回答下列问题。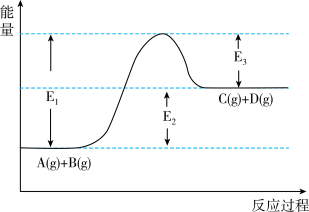
②在反应体系中加入催化剂,反应速率增大,


③当反应达到平衡时,升高温度,A的转化率
(2)一定条件下,一氧化碳与氢气反应可以合成甲醇。已知:
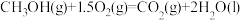
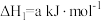
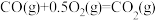
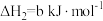
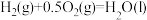
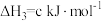
则
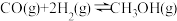

 (用a、b、c表示)。
(用a、b、c表示)。(3)一定压强下,在容积为
 的密闭容器中充入
的密闭容器中充入 与
与 ,在催化剂作用下发生反应:
,在催化剂作用下发生反应: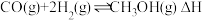 ,平衡转化率与温度、压强的关系如图所示。则
,平衡转化率与温度、压强的关系如图所示。则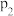
 (填“>”、“<”或“=”);
(填“>”、“<”或“=”);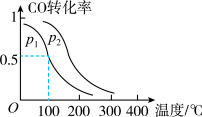
您最近一年使用:0次
名校
解题方法
6 . 为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:
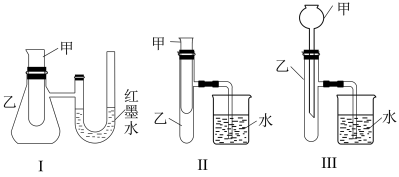
(1)某同学选用装置I进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,根据所学知识推测该反应属于_______ (填“吸热”或“放热”)反应,预测U形管中可观察到的现象是_______ 。
(2)选择装置II进行探究固体M在甲中溶于水的热效应。
①若M为 ,则实验过程中烧杯中可观察到的现象是
,则实验过程中烧杯中可观察到的现象是_______ 。
②若M为NaOH,则实验过程中烧杯中可观察到的现象为_______ 。
(3)上述3个装置中,不能用来证明“锌和稀硫酸反应是吸热反应还是放热反应”的是_______ (填序号)。理由是_______ 。
(4)至少有两种实验方法能证明过氧化钠与水的反应(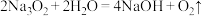 )是放热反应。
)是放热反应。
方法①:选择上述装置_______ (填“I”、“II”或“III”)进行实验。
方法②:取适量过氧化钠粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到_______ ,则说明该反应是放热反应。

(1)某同学选用装置I进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,根据所学知识推测该反应属于
(2)选择装置II进行探究固体M在甲中溶于水的热效应。
①若M为
 ,则实验过程中烧杯中可观察到的现象是
,则实验过程中烧杯中可观察到的现象是②若M为NaOH,则实验过程中烧杯中可观察到的现象为
(3)上述3个装置中,不能用来证明“锌和稀硫酸反应是吸热反应还是放热反应”的是
(4)至少有两种实验方法能证明过氧化钠与水的反应(
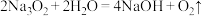 )是放热反应。
)是放热反应。方法①:选择上述装置
方法②:取适量过氧化钠粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到
您最近一年使用:0次
2022-11-21更新
|
284次组卷
|
2卷引用:上海市闵行(文绮)中学2022-2023学年高二上学期期中考试化学试题
解题方法
7 . 回答下列问题:
(1)用 催化加氢可制取乙烯:
催化加氢可制取乙烯: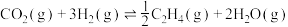 。若该反应体系的能量随反应过程变化关系如图所示,则该反应的△H=
。若该反应体系的能量随反应过程变化关系如图所示,则该反应的△H=______________ (用含a、b的式子表示)。

(2)甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整两个过程。向反应系统中同时通入甲烷、氧气和水蒸气,发生的主要化学反应如下表,则在初始阶段,蒸汽重整的反应速率______________ (填“大于”“小于”或“等于”)甲烷氧化的反应速率。
(3) 在Cu-ZnO催化下,可同时发生如下的反应Ⅰ、Ⅱ,其可作为解决温室效应及能源短缺问题的重要手段。
在Cu-ZnO催化下,可同时发生如下的反应Ⅰ、Ⅱ,其可作为解决温室效应及能源短缺问题的重要手段。
Ⅰ.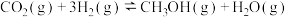
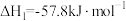
Ⅱ.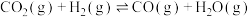
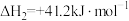
某温度时,若反应Ⅰ的速率 大于反应Ⅱ的速率
大于反应Ⅱ的速率 ,则下列反应过程的能量变化正确的是 (填字母)。
,则下列反应过程的能量变化正确的是 (填字母)。
(1)用
 催化加氢可制取乙烯:
催化加氢可制取乙烯: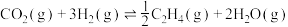 。若该反应体系的能量随反应过程变化关系如图所示,则该反应的△H=
。若该反应体系的能量随反应过程变化关系如图所示,则该反应的△H=
(2)甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整两个过程。向反应系统中同时通入甲烷、氧气和水蒸气,发生的主要化学反应如下表,则在初始阶段,蒸汽重整的反应速率
反应过程 | 化学方程式 | 焓变△H/( | 活化能E/( |
甲烷氧化 |
|
| 125.6 |
|
| 172.5 | |
蒸汽重整 |
|
| 240.1 |
|
| 243.9 |
 在Cu-ZnO催化下,可同时发生如下的反应Ⅰ、Ⅱ,其可作为解决温室效应及能源短缺问题的重要手段。
在Cu-ZnO催化下,可同时发生如下的反应Ⅰ、Ⅱ,其可作为解决温室效应及能源短缺问题的重要手段。Ⅰ.
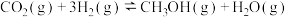
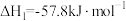
Ⅱ.
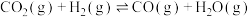
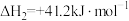
某温度时,若反应Ⅰ的速率
 大于反应Ⅱ的速率
大于反应Ⅱ的速率 ,则下列反应过程的能量变化正确的是 (填字母)。
,则下列反应过程的能量变化正确的是 (填字母)。A. | B. | C. | D.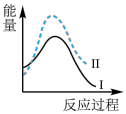 |
您最近一年使用:0次
名校
8 . 化学反应中均伴随有能量变化。
(1)下列反应中,反应物的总能量小于生成物的总能量的为_______(填标号)。
(2)已知25℃和 时,相关物质的相对能量如表所示:
时,相关物质的相对能量如表所示:
①表示 标准燃烧热的热化学方程式为
标准燃烧热的热化学方程式为_______ 。
②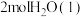 转化为
转化为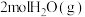 会
会_______ (填“吸收”或“放出”) _______  的热量。
的热量。
(3)已知:
I.
II.
根据盖斯定律计算
_______  。
。
(4)实验室用 盐酸与
盐酸与 溶液在如图所示装置中反应,通过测定该反应过程中放出的热量计算中和反应的反应热。该装置还缺少一种玻璃仪器,该仪器名称为
溶液在如图所示装置中反应,通过测定该反应过程中放出的热量计算中和反应的反应热。该装置还缺少一种玻璃仪器,该仪器名称为_______ ; 和
和 下,稀盐酸与稀
下,稀盐酸与稀 溶液反应生成
溶液反应生成 水放出的热量为
水放出的热量为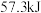 ,则
,则 醋酸溶液与
醋酸溶液与 溶液液反应生成1mol水放出的热量
溶液液反应生成1mol水放出的热量_______ 57.3KJ(填“大于”“小于”或“等于”)。

(1)下列反应中,反应物的总能量小于生成物的总能量的为_______(填标号)。
A. 与水反应 与水反应 |
B. 与灼热的木炭反应 与灼热的木炭反应 |
C. 晶体与 晶体与 晶体反应 晶体反应 |
D. 燃烧生成 燃烧生成 |
(2)已知25℃和
 时,相关物质的相对能量如表所示:
时,相关物质的相对能量如表所示:| 物质 |  |  |  | 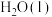 |
相对能量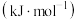 | 0 | 0 | -242 | -286 |
 标准燃烧热的热化学方程式为
标准燃烧热的热化学方程式为②
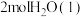 转化为
转化为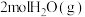 会
会 的热量。
的热量。(3)已知:
I.

II.

根据盖斯定律计算

 。
。(4)实验室用
 盐酸与
盐酸与 溶液在如图所示装置中反应,通过测定该反应过程中放出的热量计算中和反应的反应热。该装置还缺少一种玻璃仪器,该仪器名称为
溶液在如图所示装置中反应,通过测定该反应过程中放出的热量计算中和反应的反应热。该装置还缺少一种玻璃仪器,该仪器名称为 和
和 下,稀盐酸与稀
下,稀盐酸与稀 溶液反应生成
溶液反应生成 水放出的热量为
水放出的热量为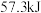 ,则
,则 醋酸溶液与
醋酸溶液与 溶液液反应生成1mol水放出的热量
溶液液反应生成1mol水放出的热量
您最近一年使用:0次
2022-11-10更新
|
215次组卷
|
2卷引用:河北省部分学校2022-2023学年高二上学期中联考化学试题
解题方法
9 . 完成下列填空
(1)某实验小组同学进行如图实验,以探究化学反应中的能量变化。

①写出烧杯中发生反应的离子方程式_______ 。
②该反应的能量变化可用下图中的_______ (填“A”或“B ”)表示。

(2)实验中,该小组同学在烧杯中加入5 mL 1.0 mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图所示,

①0~t1段化学反应速率变化的主要原因是_______ ;
②tl~t2段化学反应速率变化的主要原因是_______ 。
(1)某实验小组同学进行如图实验,以探究化学反应中的能量变化。

①写出烧杯中发生反应的离子方程式
②该反应的能量变化可用下图中的

(2)实验中,该小组同学在烧杯中加入5 mL 1.0 mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图所示,

①0~t1段化学反应速率变化的主要原因是
②tl~t2段化学反应速率变化的主要原因是
您最近一年使用:0次
名校
10 . 为了探究化学反应的热效应,某兴趣小组进行了如下实验:
(1)如图所示,室温下,观察到甲处液面上升,乙处液面下降,则该反应是_______ (填“放热”或“吸热”)反应,写出该反应的化学方程式:_______ 。
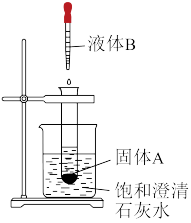
(2)如图所示,室温下,把装有固体A的试管放入盛有饱和澄清石灰水的烧杯中,向该试管中滴入一定量的液体B,观察到烧杯中的饱和澄清石灰水变浑浊,则该反应是_______ (填“放热”或“吸热”)反应。
(3)如图所示,室温下,通过仪器丙向仪器丁中的一定浓度的盐酸中加入一定浓度的氢氧化钠溶液,仪器丙的名称为_______ 。
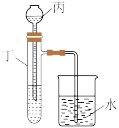
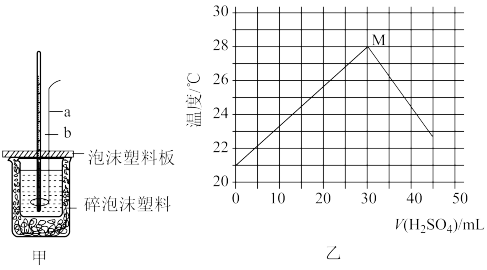
(4)某探究性学习小组为测量中和反应反应热,向20mL 1.5 NaOH溶液中逐滴滴加某浓度的
NaOH溶液中逐滴滴加某浓度的 溶液,搅拌均匀后并迅速记录溶液温度,实验过程操作规范正确,测量的简易装置如图甲所示,根据实验数据绘制的曲线如图乙。
溶液,搅拌均匀后并迅速记录溶液温度,实验过程操作规范正确,测量的简易装置如图甲所示,根据实验数据绘制的曲线如图乙。
回答下列问题:
①仪器a的名称为_______ 。
②若用浓硫酸代替稀硫酸,M点将_______ (填“向左上方移动”“向右方移动”或“不移动”)。
(5)已知:
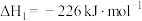
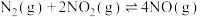

则CO与NO反应生成 气体和
气体和 气体的热化学方程式为
气体的热化学方程式为_______ 。
(1)如图所示,室温下,观察到甲处液面上升,乙处液面下降,则该反应是

(2)如图所示,室温下,把装有固体A的试管放入盛有饱和澄清石灰水的烧杯中,向该试管中滴入一定量的液体B,观察到烧杯中的饱和澄清石灰水变浑浊,则该反应是

(3)如图所示,室温下,通过仪器丙向仪器丁中的一定浓度的盐酸中加入一定浓度的氢氧化钠溶液,仪器丙的名称为

(4)某探究性学习小组为测量中和反应反应热,向20mL 1.5
 NaOH溶液中逐滴滴加某浓度的
NaOH溶液中逐滴滴加某浓度的 溶液,搅拌均匀后并迅速记录溶液温度,实验过程操作规范正确,测量的简易装置如图甲所示,根据实验数据绘制的曲线如图乙。
溶液,搅拌均匀后并迅速记录溶液温度,实验过程操作规范正确,测量的简易装置如图甲所示,根据实验数据绘制的曲线如图乙。
回答下列问题:
①仪器a的名称为
②若用浓硫酸代替稀硫酸,M点将
(5)已知:

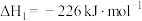
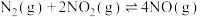

则CO与NO反应生成
 气体和
气体和 气体的热化学方程式为
气体的热化学方程式为
您最近一年使用:0次