14-15高二上·河南周口·阶段练习
名校
解题方法
1 . 煤燃烧的反应热可通过以下两个途径来利用:
a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
a.C(s)+O2(g)=CO2(g) ΔH=E1 ①
b.C(s)+H2O(g)=CO(g)+H2(g) ΔH=E2 ②
H2(g)+ 1/2 O2(g)=H2O(g) ΔH=E3 ③
CO(g)+ 1/2 O2(g)=CO2(g) ΔH=E4 ④
回答:(1)与途径a相比途径b有较多的优点,即__________ 。
(2)上述四个热化学方程式中的哪个反应ΔH>0?_______ 。
(3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是( )
A.a比b多 B.a比b少 C.a与b在理论上相同
(4)根据能量守恒定律,E1、E2、E3、E4之间的关系为_________
a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
a.C(s)+O2(g)=CO2(g) ΔH=E1 ①
b.C(s)+H2O(g)=CO(g)+H2(g) ΔH=E2 ②
H2(g)+ 1/2 O2(g)=H2O(g) ΔH=E3 ③
CO(g)+ 1/2 O2(g)=CO2(g) ΔH=E4 ④
回答:(1)与途径a相比途径b有较多的优点,即
(2)上述四个热化学方程式中的哪个反应ΔH>0?
(3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是
A.a比b多 B.a比b少 C.a与b在理论上相同
(4)根据能量守恒定律,E1、E2、E3、E4之间的关系为
您最近一年使用:0次
2016-12-09更新
|
339次组卷
|
6卷引用:2016届辽宁省大连市高三上学期高考模拟化学试卷
2014高三·全国·专题练习
解题方法
2 . 将煤转化为水煤气的主要化学反应为C(s)+H2O(g) CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
H2(g)+ O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学方程式:______ 。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律作出下列循环图:
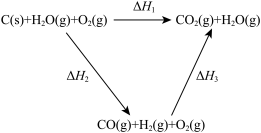
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。请分析:甲、乙两同学观点正确的是______ (填“甲”或“乙”);判断的理由是______ 。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点______ 。
(4)水煤气不仅是优良的气体燃料,也是重要的有机化工原料。CO和H2在一定条件下可以合成:①甲醇;②甲醛;③甲酸;④乙酸。试分析当CO和H2按1:1的体积比混合反应,合成上述______ (填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放。
 CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
H2(g)+
 O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1CO(g)+
 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学方程式:
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律作出下列循环图:

并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。请分析:甲、乙两同学观点正确的是
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点
(4)水煤气不仅是优良的气体燃料,也是重要的有机化工原料。CO和H2在一定条件下可以合成:①甲醇;②甲醛;③甲酸;④乙酸。试分析当CO和H2按1:1的体积比混合反应,合成上述
您最近一年使用:0次
2014高三·四川·专题练习
解题方法
3 .
(1)甲醇是一种重要的化工产品,可利用甲醇催化脱氢制备甲醛。甲醛与气态甲醇转化的能量关系如图所示。
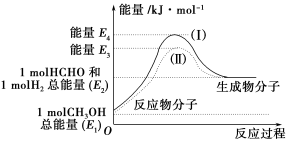
反应过程中的能量关系
①甲醇催化脱氢转化为甲醛的反应是________ (填“吸热”或“放热”)反应。
②过程Ⅰ与过程Ⅱ的反应热是否相同?____________ 原因是_______________ 。
③写出甲醇催化脱氢转化为甲醛的热化学反应方程式_________________________________ 。
(2)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是________。
(1)甲醇是一种重要的化工产品,可利用甲醇催化脱氢制备甲醛。甲醛与气态甲醇转化的能量关系如图所示。

反应过程中的能量关系
①甲醇催化脱氢转化为甲醛的反应是
②过程Ⅰ与过程Ⅱ的反应热是否相同?
③写出甲醇催化脱氢转化为甲醛的热化学反应方程式
(2)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+
 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1下列说法正确的是________。

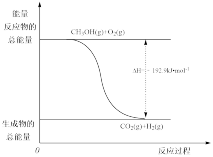
| A.CH3OH转变成H2的过程一定要吸收能量 |
| B.①反应中,反应物的总能量高于生成物的总能量 |
C.根据②推知反应:CH3OH(l)+ O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 |
| D.反应②的能量变化如图所示 |
您最近一年使用:0次
4 . 科学家认为,氢气是一种高效而无污染的理想能源,近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是_________ 。(选填字母)
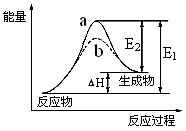
(2)用水分解获得氢气的能量变化如右图所示,表示使用催化剂是曲线_________ 。该反应为_________ (放热还是吸热)反应
(3)1g的氢气完全燃烧生成液态水释放出142.9kJ的热量写出其完全燃烧的热化学方程式:_______________________________ 。
(4)利用氢气和CO合成二甲醚的三步反应如下:
① 2H2(g) + CO(g) CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g) CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g) CH3OCH3(g) + CO2(g)的ΔH=
CH3OCH3(g) + CO2(g)的ΔH=_________
(5)氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行下图所示实验:
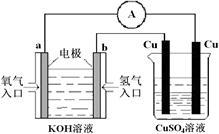
①氢氧燃料电池中,正极的电极反应式为_________________ 。
②上图装置中,某一铜电极的质量减轻3.2g,则 a 极上消耗的O2在标准状况下的体积为
_________ L。
(6)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。则正极电极方程式_________ 。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是
| A.电解水 | B.锌和稀硫酸反应 |
| C.光解海水 | D.分解天然气 |
(2)用水分解获得氢气的能量变化如右图所示,表示使用催化剂是曲线

(3)1g的氢气完全燃烧生成液态水释放出142.9kJ的热量写出其完全燃烧的热化学方程式:
(4)利用氢气和CO合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)
 CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1② 2CH3OH(g)
 CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1③ CO(g) + H2O(g)
 CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1总反应:3H2(g) + 3CO(g)
 CH3OCH3(g) + CO2(g)的ΔH=
CH3OCH3(g) + CO2(g)的ΔH=(5)氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行下图所示实验:

①氢氧燃料电池中,正极的电极反应式为
②上图装置中,某一铜电极的质量减轻3.2g,则 a 极上消耗的O2在标准状况下的体积为
(6)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。则正极电极方程式
您最近一年使用:0次
5 . 通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)。SiC___________ Si;SiCl4___________ SiO2。
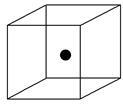
(2)下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子___________ 。
(3)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g)该反应的反应热ΔH=
Si(s)+4HCl(g)该反应的反应热ΔH=___________ kJ·mol-1。
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
(1)比较下列两组物质的熔点高低(填“>”或“<”)。SiC
(2)下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子

(3)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)
 Si(s)+4HCl(g)该反应的反应热ΔH=
Si(s)+4HCl(g)该反应的反应热ΔH=
您最近一年使用:0次
10-11高三上·江西宜春·阶段练习
6 . 镁是很活泼的金属,常用作脱硫剂、脱氧剂。在电子工业中用镁制取硅的反应为:2Mg+SiO2 2MgO+Si,同时有副反应发生:2Mg+Si
2MgO+Si,同时有副反应发生:2Mg+Si Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4,SiH4在常温下是一种不稳定、易分解的气体(燃烧热约为1430
Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4,SiH4在常温下是一种不稳定、易分解的气体(燃烧热约为1430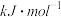 )。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
)。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
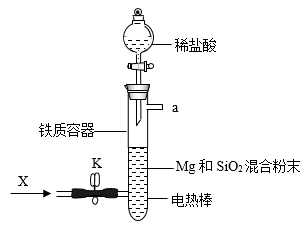
(1)由于O2的存在对该实验有较大影响,实验中应通入X气体作为保护气。X气体应选用①CO2、②N2、③H2中的____________ 。
(2)当接通电源引发反应后,切断电源,反应能继续进行,其原因是____________ 。证明了反应物Mg与SiO2具有的总能量_________ (填“大于”、“小于”或“等于”)生成物MgO和Si具有的总能量。
(3)反应结束时,待冷却至常温后,关闭K,从分液漏斗中加入稀盐酸,可观察到导管口a处有闪亮的火星。据此现象可推知_______ 在空气中能自燃。燃烧的热化学方程式为______ ,当产生等量的热量时,燃烧CH4和SiH4的物质的量之比为_______ (CH4的燃烧热是890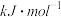 )
)
 2MgO+Si,同时有副反应发生:2Mg+Si
2MgO+Si,同时有副反应发生:2Mg+Si Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4,SiH4在常温下是一种不稳定、易分解的气体(燃烧热约为1430
Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4,SiH4在常温下是一种不稳定、易分解的气体(燃烧热约为1430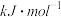 )。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
)。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
(1)由于O2的存在对该实验有较大影响,实验中应通入X气体作为保护气。X气体应选用①CO2、②N2、③H2中的
(2)当接通电源引发反应后,切断电源,反应能继续进行,其原因是
(3)反应结束时,待冷却至常温后,关闭K,从分液漏斗中加入稀盐酸,可观察到导管口a处有闪亮的火星。据此现象可推知
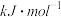 )
)
您最近一年使用:0次
7 . 煤作为燃料,可以有下列两种途径(把煤看成由碳组成):
途径Ⅰ:C(s)+O2(g)= CO2(g) ΔH=-a kJ·mol-1
途径Ⅱ:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+b kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-c kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-d kJ·mol-1
试回答下列问题:
(1)燃烧等质量的煤,途径Ⅰ放出的热量____ 途径Ⅱ放出的热量(填“大于”、“小于”或“等于”)。
(2)b的数学关系式是______________ (用a、c、d表示)。
(3)由于制取水煤气反应中,反应物具有的总能量________ (填“大于”、“小于”或“等于”)生成物所具有的总能量,在反应时,反应物需要______ (填“吸收”或“放出”)能量才能转化为生成物。
(4)简述煤通过途径Ⅱ作为燃料的意义___________________________________ 。
途径Ⅰ:C(s)+O2(g)= CO2(g) ΔH=-a kJ·mol-1
途径Ⅱ:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+b kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-c kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-d kJ·mol-1
试回答下列问题:
(1)燃烧等质量的煤,途径Ⅰ放出的热量
(2)b的数学关系式是
(3)由于制取水煤气反应中,反应物具有的总能量
(4)简述煤通过途径Ⅱ作为燃料的意义
您最近一年使用:0次



