1 . 下列说法正确的是________ 。
①生成物能量一定低于反应物总能量
②放热反应的反应速率总是大于吸热反应的反应速率
③HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
④需要加热才能发生的反应一定是吸热反应
⑤1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
⑥依据盖斯定律,反应焓变的大小与反应的途径有关,无论是一步完成还是分几步完成,其总的热效应完全相同
⑦25 ℃、101kPa,1molS和2molS的燃烧热相等
⑧反应中旧键断裂需吸收能量,新键形成需放出能量,所以总能量不变
⑨化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种
⑩由反应物X转化为Y和Z的能量变化 所示可知,由X→Z反应的ΔH<0
所示可知,由X→Z反应的ΔH<0
⑪由778 K时氮气与氢气合成氨反应过程中能量变化的曲线图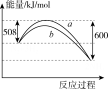 可知,b曲线是加入催化剂时的能量变化曲线
可知,b曲线是加入催化剂时的能量变化曲线
⑫1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
①生成物能量一定低于反应物总能量
②放热反应的反应速率总是大于吸热反应的反应速率
③HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
④需要加热才能发生的反应一定是吸热反应
⑤1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
⑥依据盖斯定律,反应焓变的大小与反应的途径有关,无论是一步完成还是分几步完成,其总的热效应完全相同
⑦25 ℃、101kPa,1molS和2molS的燃烧热相等
⑧反应中旧键断裂需吸收能量,新键形成需放出能量,所以总能量不变
⑨化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种
⑩由反应物X转化为Y和Z的能量变化
 所示可知,由X→Z反应的ΔH<0
所示可知,由X→Z反应的ΔH<0⑪由778 K时氮气与氢气合成氨反应过程中能量变化的曲线图
 可知,b曲线是加入催化剂时的能量变化曲线
可知,b曲线是加入催化剂时的能量变化曲线⑫1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
您最近一年使用:0次
2 . 气态亚硝酸(HNO2或HONO)是大气中的一种污染物。
(1)亚硝酸的电离平衡常数Ka=6.0×10﹣6,其电离方程式为________ 。
(2)亚硝酸分子中各原子最外层电子均达到稳定结构,其电子式为________ 。
(3)亚硝酸进入人体可以与二甲胺[(CH3)2NH]迅速反应生成亚硝酸胺[CH3)2N-N=O],亚硝酸胺是最重要的化学致癌物之一。
① 亚硝酸与二甲胺反应生成亚硝酸胺的一种反应机理如下:
HONO+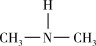

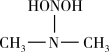

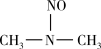
过程ⅰ和过程ⅱ的反应类型分别为:________ 、消去反应。
② 上述反应机理的反应过程与能量变化的关系如图:
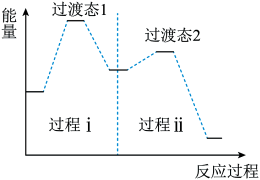
亚硝酸与二甲胺反应生成亚硝酸胺的反应ΔH________ 0(填“>”或“<”)。反应难度更大的是过程________ (填“ⅰ”或“ⅱ”)。
(1)亚硝酸的电离平衡常数Ka=6.0×10﹣6,其电离方程式为
(2)亚硝酸分子中各原子最外层电子均达到稳定结构,其电子式为
(3)亚硝酸进入人体可以与二甲胺[(CH3)2NH]迅速反应生成亚硝酸胺[CH3)2N-N=O],亚硝酸胺是最重要的化学致癌物之一。
① 亚硝酸与二甲胺反应生成亚硝酸胺的一种反应机理如下:
HONO+
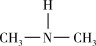



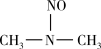
过程ⅰ和过程ⅱ的反应类型分别为:
② 上述反应机理的反应过程与能量变化的关系如图:

亚硝酸与二甲胺反应生成亚硝酸胺的反应ΔH
您最近一年使用:0次
2020-06-06更新
|
194次组卷
|
2卷引用:北京市丰台区2020届高三下学期高三综合练习(二)化学试题
解题方法
3 .  反应过程的能量变化如图所示,请回答下列问题:
反应过程的能量变化如图所示,请回答下列问题:
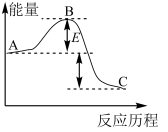
(1)该反应是______________ (填“放热”或“吸热”)反应。
(2)用 作该反应的催化剂,A、C两点的能量差是否变化?
作该反应的催化剂,A、C两点的能量差是否变化?_____________ (填“变化”或“不变”),理由是____________________ 。
(3)在体积为2L的恒容密闭容器中通入2mol 和3mol
和3mol 发生上述反应,10min内
发生上述反应,10min内 的物质的量变化如下表:
的物质的量变化如下表:
①升高温度,反应速率______________ (填“增大”或“减小”)。
②上述反应在7min时_______________ (填“达到”或“未达到”)平衡状态。
③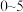 min内,用
min内,用 表示该反应的反应速率为
表示该反应的反应速率为_______________ mol·L-1·min-1。
 反应过程的能量变化如图所示,请回答下列问题:
反应过程的能量变化如图所示,请回答下列问题:
(1)该反应是
(2)用
 作该反应的催化剂,A、C两点的能量差是否变化?
作该反应的催化剂,A、C两点的能量差是否变化?(3)在体积为2L的恒容密闭容器中通入2mol
 和3mol
和3mol 发生上述反应,10min内
发生上述反应,10min内 的物质的量变化如下表:
的物质的量变化如下表:| 反应时间(min) | 0 | 3 | 5 | 7 | 10 |
 的物质的量(mol) 的物质的量(mol) | 0 | 0.2 | 0.3 | 0.38 | 0.38 |
②上述反应在7min时
③
 min内,用
min内,用 表示该反应的反应速率为
表示该反应的反应速率为
您最近一年使用:0次
2020高三·全国·专题练习
名校
4 . 水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用 标注。
标注。
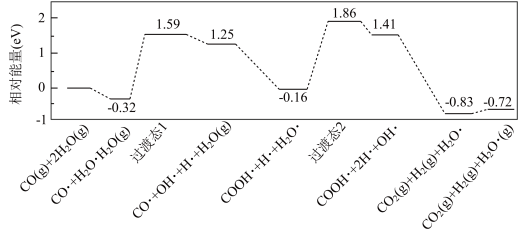
可知水煤气变换的ΔH________ 0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_________ eV,写出该步骤的化学方程式_________ 。
 标注。
标注。
可知水煤气变换的ΔH
您最近一年使用:0次
2020-04-15更新
|
804次组卷
|
12卷引用:专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训
(已下线)专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训甘肃省白银市靖远县第四中学2021届高三上学期10月月考化学试题(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考向18 化学反应与能量变化-备战2022年高考化学一轮复习考点微专题(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)回归教材重难点05 化学反应中的能量变化-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第1讲 化学能与热能
2012·上海闵行·三模
5 . 汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO。为了减轻大气污染科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,即2NO+2CO 2CO2+N2。
2CO2+N2。
为了测定在某种催化剂作用下该反应的反应速率,t1℃下,在一等容的密闭容器中,用气体传感器测得了不同时间的NO和CO的浓度如表(CO2和N2的起始浓度为0)。
回答下列问题:
(1)已知在上述反应中,反应物总能量大于生成物总能量,则正反应是___ 反应(填“放热”或“吸热”)。
(2)前3s内的平均反应速率:v(N2)=___ 。
(3)t1℃时该反应的平衡常数表达式:K=___ 。
(4)假设在密闭容器中该反应达到平衡后,改变下列条件,能提高NO转化率的是___ (选填答案编号)。
a.选用更有效的催化剂 b.升高反应体系的温度
c.降低反应体系的温度 d.缩小容器的体积
 2CO2+N2。
2CO2+N2。为了测定在某种催化剂作用下该反应的反应速率,t1℃下,在一等容的密闭容器中,用气体传感器测得了不同时间的NO和CO的浓度如表(CO2和N2的起始浓度为0)。
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(×10-4,mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)(×10-3,mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
回答下列问题:
(1)已知在上述反应中,反应物总能量大于生成物总能量,则正反应是
(2)前3s内的平均反应速率:v(N2)=
(3)t1℃时该反应的平衡常数表达式:K=
(4)假设在密闭容器中该反应达到平衡后,改变下列条件,能提高NO转化率的是
a.选用更有效的催化剂 b.升高反应体系的温度
c.降低反应体系的温度 d.缩小容器的体积
您最近一年使用:0次
6 . 氯及其化合物在生活和生产中应用广泛。已知:900 K时,4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) 反应过程能量变化如图所示。该反应是
2Cl2(g)+2H2O(g) 反应过程能量变化如图所示。该反应是 __________ 反应(放热还是吸热),有催化剂参与反应过程 ________ (填a或b)。

 2Cl2(g)+2H2O(g) 反应过程能量变化如图所示。该反应是
2Cl2(g)+2H2O(g) 反应过程能量变化如图所示。该反应是 
您最近一年使用:0次
7 . 解答下列问题:
Ⅰ.某同学做如下实验 图
图 ,以检验反应中的能量变化。
,以检验反应中的能量变化。
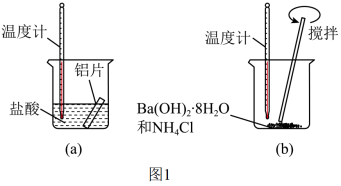


(1)实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是______ 热反应;该反应中 ______ 能转化成 ______ 能。
(2)(b)中温度降低,下列各图 图
图 所表示的反应是(b)反应的是
所表示的反应是(b)反应的是 ______ 。
Ⅱ.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图3所示。
(1)该反应中______ 是反应物,反应是 ______ 反应。
(2)反应开始到10s,用Z表示的反应速率为______  。
。
(3)反应开始到10s时,Y的物质的量浓度减少了______  。
。
(4)反应的化学方程式为______ 。
Ⅰ.某同学做如下实验
 图
图 ,以检验反应中的能量变化。
,以检验反应中的能量变化。 


(1)实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是
(2)(b)中温度降低,下列各图
 图
图 所表示的反应是(b)反应的是
所表示的反应是(b)反应的是 Ⅱ.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图3所示。
(1)该反应中
(2)反应开始到10s,用Z表示的反应速率为
 。
。(3)反应开始到10s时,Y的物质的量浓度减少了
 。
。(4)反应的化学方程式为
您最近一年使用:0次
2020-02-26更新
|
147次组卷
|
2卷引用:2020届高三化学二轮复习实验题必练-化学平衡
2010·全国·一模
名校
8 . 如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL稀盐酸。
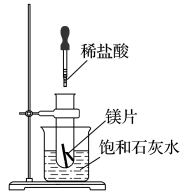
回答下列问题:
(1)实验中观察到的现象是________________ 。
(2)产生上述现象的原因是________________ 。
(3)写出有关反应的离子方程式____________ 。
(4)由实验推知,MgCl2溶液和H2的总能量________ (填“大于”、“小于”或“等于”)镁片和盐酸的总能量。

回答下列问题:
(1)实验中观察到的现象是
(2)产生上述现象的原因是
(3)写出有关反应的离子方程式
(4)由实验推知,MgCl2溶液和H2的总能量
您最近一年使用:0次
2020-01-30更新
|
1163次组卷
|
41卷引用:高考第一轮复习化学反应与能量变化单元测试
(已下线)高考第一轮复习化学反应与能量变化单元测试(已下线)2010年新疆哈巴河县高级中学高二上学期第一次月考化学试题(已下线)2010-2011学年湖南省醴陵二中、醴陵四中高一下学期期中联考化学试卷(已下线)2011-2012年吉林省长春外国语学校高二上学期第一次月考化学试卷(已下线)2011-2012年甘肃天水一中高一下学期第一学段考试文科化学试卷(已下线)2011-2012学年浙江省杭州市西湖高级中学高一5月月考化学试卷(已下线)2011-2012学年浙江临海市白云高级中学高二下学期期中考试化学卷(已下线)2012-2013学年安徽省舒城晓天中学高二上学期第一次月考化学试卷(已下线)2012-2013学年山西省太原五中高二8月月考化学试卷(已下线)2011-2012学年贵州省盘县二中高一下学期期中考试化学试卷(已下线)2013-2014宁夏大学附属中学高一下学期期中考试化学试卷2015-2016学年青海省西宁四中高二上学期期末化学试卷2015-2016学年江西省玉山一中高一下第一次月考化学试卷22015-2016学年安徽省合肥中科大附中高二下期中理科化学试卷2015-2016学年宁夏育才中学高一下期中化学试卷2015-2016学年广西南宁二十六中高一下学期期中考试化学试卷吉林省实验中学2016-2017学年高一下学期期中考试(文)化学试题江西省南康中学2017-2018学年高一下学期第一次月考化学试题宁夏青铜峡市高级中学2017-2018学年高一下学期期中考试化学试题人教版高二化学选修四专题:化学反应与能量变化同步练习题【校级联考】江苏省常州“教学研究合作联盟”2018-2019学年高二下学期期中考试化学试题广西蒙山县第一中学2018-2019学年高一下学期第二次月考化学试题云南省昆明市官渡区第一中学2018-2019学年高一下学期期中考试化学试题上海市2017-2018学年高一化学第一学期反应原理综合测试题(已下线)2019年3月12日 《每日一题》 必修2 放热反应与吸热反应的实验探究人教版高中化学必修二第二单元《化学反应与能量》测试卷2019——2020学年人教版必修2 第二章 化学反应与能量2020年春季苏教版高中化学必修2专题二《化学反应与能量转化》测试卷6.1.1 化学反应与热能——2020年春高一新人教版第二册化学一课一练2020年春高一化学新人教版第二册课后同步:6.1.1 化学反应与热能吉林省延边市长白山第一高级中学2019-2020学年高一下学期验收考试化学试题陕西省渭南市三贤中学2020年高一下学期期中考试化学试题青海省海东市第二中学2019-2020学年高一下学期期中考试化学试题云南省玉溪市峨山彝族自治县第一中学2019-2020学年高一下学期期中考试化学试题(已下线)1.1.1 化学反应的反应热 内能变化 练习——【高中新教材同步备课】鲁科版高中化学选择性必修1(人教版2019)必修第二册 第六章 化学反应与能量 第一节 化学反应与能量变化(已下线)6.1.1 化学反应与热能(练好题)(基础过关)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)福建省建瓯市芝华中学2020-2021学年高一下学期期中考试化学试题云南省易门一中2020-2021学年高一6月份月考化学试题陕西省宜君县高级中学2021-2022学年高二上学期第一次月考化学(理)试题5.3.1 化学变化中的能量变化(第1课时)-【帮课堂】高一化学同步精品讲义(沪科版2020必修第二册)
名校
9 . 已知下列热化学方程式:
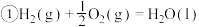
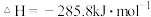


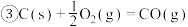
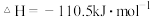
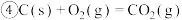
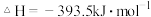
回答下列问题:
(1)上述反应中属于放热反应的是________ 。
(2)H2的燃烧热
________________ ;C的燃烧热
________________ 。
(3)燃烧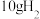 生成液态水,放出的热量为
生成液态水,放出的热量为________ 。
(4)写出CO燃烧的热化学方程式:________________________________ 。
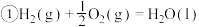
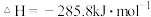


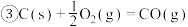
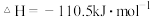
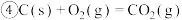
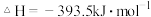
回答下列问题:
(1)上述反应中属于放热反应的是
(2)H2的燃烧热


(3)燃烧
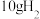 生成液态水,放出的热量为
生成液态水,放出的热量为(4)写出CO燃烧的热化学方程式:
您最近一年使用:0次
2020-01-25更新
|
392次组卷
|
6卷引用:2020届高三化学二轮冲刺新题专练——燃烧热的定义与应用
2014高三·全国·专题练习
名校
10 . 已知某反应A(g)+B(g)=C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题。
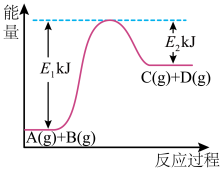
(1)该反应是_____ (填“吸热”或“放热”)反应,该反应的ΔH=________ kJ/mol (用含E1、E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量______ (填“一定高”“一定低”或“高低不一定”)。
(2)若在反应体系中加入催化剂使反应速率增大,则E1和E2的变化是:E1_______ ,E2________ ΔH______ (填“增大”“减小”或“不变”)。

(1)该反应是
(2)若在反应体系中加入催化剂使反应速率增大,则E1和E2的变化是:E1
您最近一年使用:0次
2019-08-13更新
|
399次组卷
|
6卷引用:2014年高考化学苏教版总复习 6-1 化学反应中的热效应练习卷
(已下线)2014年高考化学苏教版总复习 6-1 化学反应中的热效应练习卷2016-2017学年宁夏吴忠中学高二下学期第一次月考化学试卷新疆维吾尔自治区且末县第二中学2018-2019学年高二上学期期末考试化学试题内蒙古北京八中乌兰察布分校2019-2020学年高二上学期第二次调研考试化学试题宁夏贺兰县景博中学2019-2020学年高二上学期第二次月考化学试题(已下线)1.1.1 化学反应的焓变(重点练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)



