解题方法
1 . 含氯消毒剂和过氧化物消毒剂均可有效灭杀新冠病毒。
Ⅰ.过碳酸钠(2Na2CO3·3H2O2)俗称固态双氧水,具有去污、杀菌等功效。其制备原理为:2Na2CO3(aq)+3H2O2(aq)=2Na2CO3·3H2O2(aq) △H<0。
(1)结合过氧化氢和碳酸钠的性质,推测制备过碳酸钠的过程中,碳酸钠与过氧化氢的物质的量之比应小于2:3,且加入Na2CO3溶液速率不能过快的原因是_______ 。
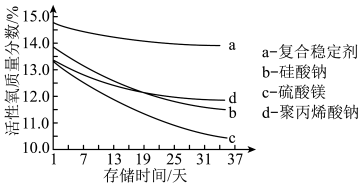
(2)过碳酸钠的储存稳定性是重要的品质指标。以不同种类的稳定剂制备的过碳酸钠产品,测得其活性氧的质量分数随时间变化如图所示。由图可知,制备过碳酸钠时应选择的稳定剂是_______ 。(填图中字母)
Ⅱ.NaClO2是一种更为安全有效的清洗﹑杀菌剂,特别是在NaClO使用受限制的场合,NaClO3是NaClO的安全代用品。
(3)工业上用石墨电极电解ClO2、NaCl溶液制备NaClO3。写出该反应的离子方程式:_______ 。
Ⅰ.过碳酸钠(2Na2CO3·3H2O2)俗称固态双氧水,具有去污、杀菌等功效。其制备原理为:2Na2CO3(aq)+3H2O2(aq)=2Na2CO3·3H2O2(aq) △H<0。
(1)结合过氧化氢和碳酸钠的性质,推测制备过碳酸钠的过程中,碳酸钠与过氧化氢的物质的量之比应小于2:3,且加入Na2CO3溶液速率不能过快的原因是
(2)过碳酸钠的储存稳定性是重要的品质指标。以不同种类的稳定剂制备的过碳酸钠产品,测得其活性氧的质量分数随时间变化如图所示。由图可知,制备过碳酸钠时应选择的稳定剂是

Ⅱ.NaClO2是一种更为安全有效的清洗﹑杀菌剂,特别是在NaClO使用受限制的场合,NaClO3是NaClO的安全代用品。
(3)工业上用石墨电极电解ClO2、NaCl溶液制备NaClO3。写出该反应的离子方程式:
您最近一年使用:0次
名校
解题方法
2 . 汽车尾气中的主要污染物是NOx和CO,它们是现代化城市中的重要大气污染物。
(1)汽车发动机工作时会引发N2和O2反应生成NO,其能量变化如图1所示,则图1中三种分子最稳定的是_______ ,图1中对应反应的热化学方程式为________________ 。
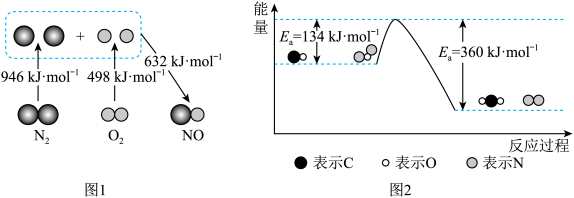
(2)N2O和CO均是有害气体,可在 表面转化为无害气体,其反应原理如下:N2O(g)+CO(g)=CO2(g) + N2(g) ΔH。有关化学反应的能量变化过程如图2所示。
表面转化为无害气体,其反应原理如下:N2O(g)+CO(g)=CO2(g) + N2(g) ΔH。有关化学反应的能量变化过程如图2所示。
①图2中反应是_______ (填“放热”或“吸热”)反应,该反应的活化能为_______ ,该反应的ΔH=_______ ;
②在反应体系中加入Pt2O+作为该反应的催化剂,则Ea_______ (填“增大”“减小”或“不变”,下同), ΔH _______ 。
(3)利用NH3还原法可将NOx还原为N2进行脱除。已知:
4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH=﹣2070 kJ·mol-1
若有0.5 mol NO被还原,则_____ (填“释放”或“吸收”)的热量为______ 。
(1)汽车发动机工作时会引发N2和O2反应生成NO,其能量变化如图1所示,则图1中三种分子最稳定的是

(2)N2O和CO均是有害气体,可在
 表面转化为无害气体,其反应原理如下:N2O(g)+CO(g)=CO2(g) + N2(g) ΔH。有关化学反应的能量变化过程如图2所示。
表面转化为无害气体,其反应原理如下:N2O(g)+CO(g)=CO2(g) + N2(g) ΔH。有关化学反应的能量变化过程如图2所示。①图2中反应是
②在反应体系中加入Pt2O+作为该反应的催化剂,则Ea
(3)利用NH3还原法可将NOx还原为N2进行脱除。已知:
4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH=﹣2070 kJ·mol-1
若有0.5 mol NO被还原,则
您最近一年使用:0次
2021-11-17更新
|
858次组卷
|
5卷引用:江西省丰城市第九中学2021-2022学年高三上学期复读班第三次月考 化学试卷
名校
3 . 为了研究反应 能量变化情况,某同学设计了如图所示装置。当向盛有
能量变化情况,某同学设计了如图所示装置。当向盛有 的试管中滴加试剂
的试管中滴加试剂 时,看到
时,看到 形管中甲处液面下降乙处液面上升。试回答下列问题:
形管中甲处液面下降乙处液面上升。试回答下列问题:
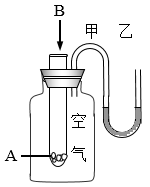
(1)该反应为___________ 反应(填“放热”或“吸热”)。
(2)物质中的化学能通过化学反应转化成___________ 释放出来。
(3)若甲烷的燃烧热为 ,写出表示甲烷燃烧热的热化学方程式
,写出表示甲烷燃烧热的热化学方程式___________ 。
(4)已知
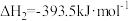
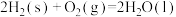
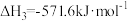 。
。
则高温下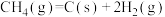

___________  。
。
 能量变化情况,某同学设计了如图所示装置。当向盛有
能量变化情况,某同学设计了如图所示装置。当向盛有 的试管中滴加试剂
的试管中滴加试剂 时,看到
时,看到 形管中甲处液面下降乙处液面上升。试回答下列问题:
形管中甲处液面下降乙处液面上升。试回答下列问题:
(1)该反应为
(2)物质中的化学能通过化学反应转化成
(3)若甲烷的燃烧热为
 ,写出表示甲烷燃烧热的热化学方程式
,写出表示甲烷燃烧热的热化学方程式(4)已知

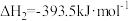
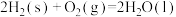
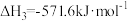 。
。则高温下
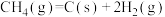

 。
。
您最近一年使用:0次
2021-11-01更新
|
220次组卷
|
3卷引用:西藏林芝市第二高级中学2021-2022学年高三下学期第四次月考理综化学试题
2021高三·全国·专题练习
4 . (1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)⇌NH2COONH4(s) ΔH1
反应Ⅱ:NH2COONH4(s)⇌CO(NH2)2(s)+H2O(g) ΔH2=+72.49 kJ·mol-1
总反应:2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g) ΔH3=-86.98 kJ·mol-1
则反应Ⅰ的ΔH1=________ kJ·mol-1。
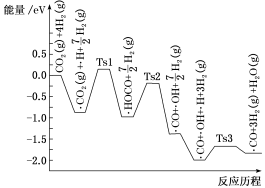
(2)氢气可将CO2还原为甲烷,反应为CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)。ShyamKattel等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示,其中吸附在Pt/SiO2催化剂表面用“·”标注,Ts表示过渡态。物质吸附在催化剂表面,形成过渡态的过程会_____ (填“放出热量”或“吸收热量”);反应历程中最小能垒(活化能)步骤的化学方程式为____ 。
(3)已知CO(g)、CH4(g)、CH3CHO(l)的燃烧热分别为283.0 kJ·mol-1、890.31 kJ·mol-1、1 167.9 kJ·mol-1,则乙醛的分解反应CH3CHO(l)⇌CH4(g)+CO(g)的ΔH=________ 。
反应Ⅰ:2NH3(g)+CO2(g)⇌NH2COONH4(s) ΔH1
反应Ⅱ:NH2COONH4(s)⇌CO(NH2)2(s)+H2O(g) ΔH2=+72.49 kJ·mol-1
总反应:2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g) ΔH3=-86.98 kJ·mol-1
则反应Ⅰ的ΔH1=
(2)氢气可将CO2还原为甲烷,反应为CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)。ShyamKattel等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示,其中吸附在Pt/SiO2催化剂表面用“·”标注,Ts表示过渡态。物质吸附在催化剂表面,形成过渡态的过程会

(3)已知CO(g)、CH4(g)、CH3CHO(l)的燃烧热分别为283.0 kJ·mol-1、890.31 kJ·mol-1、1 167.9 kJ·mol-1,则乙醛的分解反应CH3CHO(l)⇌CH4(g)+CO(g)的ΔH=
您最近一年使用:0次
真题
5 . 镁化合物具有广泛用途,请回答有关镁的下列问题:
(1)单质镁在空气中燃烧的主要产物是白色的__ ,还生成少量的__ (填化学式)。
(2)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是___ ,该化合物水解的化学方程式为___ 。
(3)如图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。
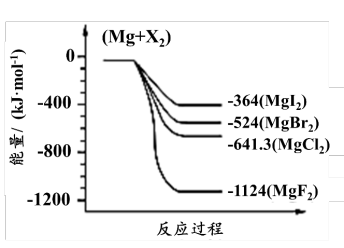
下列选项中正确的是__ (填序号)。
①MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
②Mg与F2的反应是放热反应
③MgBr2与Cl2反应的△H<0
④化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
⑤MgF2(s)+Br2(l)=MgBr2(s)+F2(g)△H=+600kJ·mol-1
(1)单质镁在空气中燃烧的主要产物是白色的
(2)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是
(3)如图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。

下列选项中正确的是
①MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
②Mg与F2的反应是放热反应
③MgBr2与Cl2反应的△H<0
④化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
⑤MgF2(s)+Br2(l)=MgBr2(s)+F2(g)△H=+600kJ·mol-1
您最近一年使用:0次
13-14高一·全国·课时练习
名校
6 . 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察下图,然后回答下列问题。

(1)图中所示反应是___________ (填“吸热”或“放热”)反应。
(2)已知拆开1 mol H—H键、1 mol I—I键、1 mol H—I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ。则由1 mol氢气和1 mol碘反应生成HI会___________ (填“放出”或“吸收”)___________ kJ的热量。在化学反应过程中,是将___________ 转化为___________ 。
(3)下列反应中,属于放热反应的是___________ (填序号,下同),属于吸热反应的是___________ 。
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败 ⑥Ba(OH)2·8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应

(1)图中所示反应是
(2)已知拆开1 mol H—H键、1 mol I—I键、1 mol H—I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ。则由1 mol氢气和1 mol碘反应生成HI会
(3)下列反应中,属于放热反应的是
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败 ⑥Ba(OH)2·8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
您最近一年使用:0次
2021-05-13更新
|
588次组卷
|
13卷引用:江西省赣中南五校2018届高三上学期第二次联考理综化学试题
江西省赣中南五校2018届高三上学期第二次联考理综化学试题(已下线)2014年高一化学人教版必修二 2-1化学能与热能练习卷(已下线)2013-2014湖北省黄石市三中高一下学期期中考试化学试卷【全国百强校】新疆兵团第二师华山中学2017-2018学年高一下学期期末考试化学试题重庆市南岸区2018-2019学年高一下学期期末质量调研抽测化学试题山西省晋中市和诚中学2019-2020学年高一3月月考化学试题广西钦州市浦北县浦北中学2020-2021学年高一3月月考化学试题山西省大同市浑源县第七中学2020-2021学年高一下学期第一次月考化学试题河南省开封市五县部分学校2021-2022学年高一下学期期中考试化学试题(已下线)【期末复习】必刷题(2)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)黑龙江省黑河市五校2021-2022学年高一下学期期末联考化学试题(已下线)6.1.1 化学反应与热能——同步学习必备知识甘肃省武威、张掖两地2022-2023学年高二上学期11月期中考试化学试题
名校
7 . Ⅰ.已知下列热化学方程式:
①2H2(g)+O2(g)=2H2O(l) △H=-570kJ/mol
②2H2O(g)=2H2(g)+O2(g) △H=+483.6kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是_______ (填写序号)。
(2)燃烧10gH2生成液态水,放出的热量为_______ 。
(3)已知:1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量,由此推知H2SO4与NaOH发生中和反应,写出该中和热的热化学方程式为_______ 。
Ⅱ.已知:工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0MPa)和催化剂作用下进行的,反应器中发生了下列反应:
CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.7kJ·mol-1 ①
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1 ②
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
(4)反应器中的总反应可表示为3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g),计算该反应的ΔH=_______ 。
①2H2(g)+O2(g)=2H2O(l) △H=-570kJ/mol
②2H2O(g)=2H2(g)+O2(g) △H=+483.6kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是
(2)燃烧10gH2生成液态水,放出的热量为
(3)已知:1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量,由此推知H2SO4与NaOH发生中和反应,写出该中和热的热化学方程式为
Ⅱ.已知:工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0MPa)和催化剂作用下进行的,反应器中发生了下列反应:
CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.7kJ·mol-1 ①
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1 ②
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
(4)反应器中的总反应可表示为3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g),计算该反应的ΔH=
您最近一年使用:0次
8 . 化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于放热反应的是_________ (填字母)。
A.碳与水蒸气反应 B.铝和氧化铁反应 C.CaCO3受热分解 D.氢气还原三氧化钨制取钨 E.锌与盐酸反应
(2)获取能量变化的途径
①通过化学键的键能计算。通常人们把断裂1mol某化学键所吸收的能量或形成1mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热ΔH。已知部分化学键的键能数据如表所示:
则H2(g)+Cl2(g)=2HCl(g)的反应热ΔH为__________________________
②通过盖斯定律可计算。发射卫星用 作燃料,
作燃料, 作氧化剂,两者反应生成N2和水蒸气,已知:N2(g) +2O2(g)= 2NO2(g)△H1 =+67.7kJ/mol;N2H4(g)+O2(g)= N2(g)+2H2O(g) △H2=-534kJ/mol,写出气体肼和NO2气体反应生成N2和水蒸气的热化学方程式
作氧化剂,两者反应生成N2和水蒸气,已知:N2(g) +2O2(g)= 2NO2(g)△H1 =+67.7kJ/mol;N2H4(g)+O2(g)= N2(g)+2H2O(g) △H2=-534kJ/mol,写出气体肼和NO2气体反应生成N2和水蒸气的热化学方程式___________________________________________________
③利用实验装置测量利用下图图装置测定中和热的实验步骤如下:
回答下列问题:
I.仪器a的名称为______________________________
II.做了四次实验,并将实验数据记录如下:
近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),通过以上数据计算中和热ΔH=_________________ ( 结果保留小数点后一位)。
(1)下列反应中,属于放热反应的是
A.碳与水蒸气反应 B.铝和氧化铁反应 C.CaCO3受热分解 D.氢气还原三氧化钨制取钨 E.锌与盐酸反应
(2)获取能量变化的途径
①通过化学键的键能计算。通常人们把断裂1mol某化学键所吸收的能量或形成1mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热ΔH。已知部分化学键的键能数据如表所示:
| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能/(kJ·mol-1) | 436 | 243 | 431 |
②通过盖斯定律可计算。发射卫星用
 作燃料,
作燃料, 作氧化剂,两者反应生成N2和水蒸气,已知:N2(g) +2O2(g)= 2NO2(g)△H1 =+67.7kJ/mol;N2H4(g)+O2(g)= N2(g)+2H2O(g) △H2=-534kJ/mol,写出气体肼和NO2气体反应生成N2和水蒸气的热化学方程式
作氧化剂,两者反应生成N2和水蒸气,已知:N2(g) +2O2(g)= 2NO2(g)△H1 =+67.7kJ/mol;N2H4(g)+O2(g)= N2(g)+2H2O(g) △H2=-534kJ/mol,写出气体肼和NO2气体反应生成N2和水蒸气的热化学方程式③利用实验装置测量利用下图图装置测定中和热的实验步骤如下:
 | ①用量筒量取0.25mol/L的硫酸50mL倒入小烧杯中,测出硫酸溶液温度; ②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用同一温度计测出其温度; ③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液的最高温度。 |
I.仪器a的名称为
II.做了四次实验,并将实验数据记录如下:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 |
您最近一年使用:0次
2021-01-16更新
|
540次组卷
|
4卷引用:第17讲 化学能与热能(精练)-2022年高考化学一轮复习讲练测
(已下线)第17讲 化学能与热能(精练)-2022年高考化学一轮复习讲练测(已下线)第17讲 化学能与热能(练)-2023年高考化学一轮复习讲练测(全国通用)河南省新蔡县2020-2021学年高二上学期期末调研考试化学试题安徽省六安市舒城育才学校2020-2021学年高二上学期期末考试化学试题
9 . (1)如图表示某反应的能量变化关系,则此反应为____ (填“吸热”或“放热”)反应,其中ΔH=____ (用含有a、b的关系式表示)。

(2)曾用CuCl2作催化剂,在450 ℃利用空气中的氧气跟氯化氢反应制氯气,反应的化学方程式为____ 。使用催化剂对反应焓变有无影响_____ 。
(3)NaBH4(s)与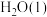 反应生成
反应生成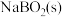 和
和 。在25℃,101kPa下,已知每消耗
。在25℃,101kPa下,已知每消耗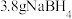
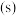 放热
放热 ,该反应的热化学方程式是
,该反应的热化学方程式是_____ 。
(4)甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、 和
和 )在催化剂作用下合成甲醇,发生的主要反应如下:
)在催化剂作用下合成甲醇,发生的主要反应如下:
①

②

③

已知反应①中相关的化学键键能数据如下(已知CO的化学键为 ):
):
计算
_______  ;已知
;已知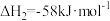 ,则
,则
_______ 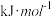 。
。

(2)曾用CuCl2作催化剂,在450 ℃利用空气中的氧气跟氯化氢反应制氯气,反应的化学方程式为
(3)NaBH4(s)与
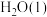 反应生成
反应生成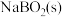 和
和 。在25℃,101kPa下,已知每消耗
。在25℃,101kPa下,已知每消耗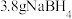
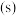 放热
放热 ,该反应的热化学方程式是
,该反应的热化学方程式是(4)甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、
 和
和 )在催化剂作用下合成甲醇,发生的主要反应如下:
)在催化剂作用下合成甲醇,发生的主要反应如下:①


②


③


已知反应①中相关的化学键键能数据如下(已知CO的化学键为
 ):
):| 化学键 | H-H | C-O |  | H-O | C-H |
 | 436 | 343 | 1076 | 465 | 413 |

 ;已知
;已知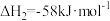 ,则
,则
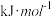 。
。
您最近一年使用:0次
名校
解题方法
10 . 化学物质在汽车的动力、安全等方面有着极为重要的作用。
(1)汽油是以 C8H18 为主要成分的混合烃类。C8H18燃烧的化学方程式是________ 。
(2)汽车尾气中含有 NO,CO 等污染物。其中 NO 生成过程的能量变化示意图如图。由该图形数据计算可得,该反应为__________ (填“吸热”或“放热”)反应。
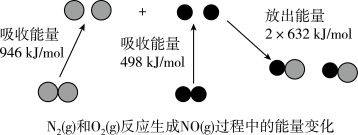
(3)通过 NO 传感器可监测汽车尾气中 NO 的含量,其工作原理如图 所示:
①NiO 电极上发生的是_______ 反应(填“氧化”或“还原”)
②外电路中,电子流动方向是从_______ 电极流向 _____ 电极(填“NiO”或“Pt”)。
③Pt 电极上的电极反应式为________________ 。
(4)电动汽车普遍使用锂离子电池。某锂离子电池反应:FePO4 +Li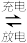 LiFePO4。
LiFePO4。
① 放电时,Li 做电池的__________ 极。
② Na 也可以做电池的电极,但 Li 做电极更有优势。试解释原因____________ 。
(5)安全性是汽车发展需要解决的重要问题.汽车受到强烈撞击时,预置在安全气囊内的化学药剂发生反应产生大量气体,气囊迅速弹出。某种产气药剂主要含有 NaN3、Fe2O3、KClO4、NaHCO3,已知NaN3在猛烈撞击时分解产生两种单质,并放出大量的热。
①推测 Fe2O3的作用是_________________ 。
②结合化学方程式解释 NaHCO3的作用____________________ 。
③结合上述例子,在设计气囊中所运用的化学反应时,需要考虑的角度有________ (填代号,可多选)。
a.反应速率b. 反应限度 c.气体的量d. 气体毒性 e.反应的能量变化
(1)汽油是以 C8H18 为主要成分的混合烃类。C8H18燃烧的化学方程式是
(2)汽车尾气中含有 NO,CO 等污染物。其中 NO 生成过程的能量变化示意图如图。由该图形数据计算可得,该反应为

(3)通过 NO 传感器可监测汽车尾气中 NO 的含量,其工作原理如图 所示:

①NiO 电极上发生的是
②外电路中,电子流动方向是从
③Pt 电极上的电极反应式为
(4)电动汽车普遍使用锂离子电池。某锂离子电池反应:FePO4 +Li
 LiFePO4。
LiFePO4。① 放电时,Li 做电池的
② Na 也可以做电池的电极,但 Li 做电极更有优势。试解释原因
(5)安全性是汽车发展需要解决的重要问题.汽车受到强烈撞击时,预置在安全气囊内的化学药剂发生反应产生大量气体,气囊迅速弹出。某种产气药剂主要含有 NaN3、Fe2O3、KClO4、NaHCO3,已知NaN3在猛烈撞击时分解产生两种单质,并放出大量的热。
①推测 Fe2O3的作用是
②结合化学方程式解释 NaHCO3的作用
③结合上述例子,在设计气囊中所运用的化学反应时,需要考虑的角度有
a.反应速率b. 反应限度 c.气体的量d. 气体毒性 e.反应的能量变化
您最近一年使用:0次
2020-08-14更新
|
296次组卷
|
2卷引用:四川省射洪中学校2021届高三上学期第一次月考理综化学试题(补习班)



