22-23高二·上海·单元测试
1 . 化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是___________(填字母)。
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
则2H2(g)+O2(g)=2H2O(g)ΔH=___________ kJ·mol-1
②通过物质所含能量计算。已知反应A+B=C+D中A、B、C、D所具有的能量依次可表示为EA、EB、EC、ED,该反应ΔH=___________ 。
③通过盖斯定律计算。已知在25℃、101kPa时,2Na(s)+ O2(g)=Na2O(s) ΔH1=-414kJ·mol-1;2Na(s)+O2(g)=Na2O2(s) ΔH2=-511kJ·mol-1
O2(g)=Na2O(s) ΔH1=-414kJ·mol-1;2Na(s)+O2(g)=Na2O2(s) ΔH2=-511kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式:___________ 。
④利用实验装置测量。测量盐酸与NaOH溶液反应的热量变化的过程中,若取50mL0.50mol·L-1的盐酸,则还需加入___________ (填字母)。
A.50mL0.50mol·L-1NaOH溶液B.50mL0.55mol·L-1NaOH溶液C.1.0gNaOH固体
(1)下列反应中,属于吸热反应的是___________(填字母)。
| A.Na2O与水反应 |
| B.铝和氧化铁反应 |
| C.CaCO3受热分解 |
| D.锌与盐酸反应 |
①通过化学键的键能计算。已知:
| 化学键 | H—H | O=O | O—H |
| 键能(kJ·mol-1) | 436 | 496 | 463.4 |
②通过物质所含能量计算。已知反应A+B=C+D中A、B、C、D所具有的能量依次可表示为EA、EB、EC、ED,该反应ΔH=
③通过盖斯定律计算。已知在25℃、101kPa时,2Na(s)+
 O2(g)=Na2O(s) ΔH1=-414kJ·mol-1;2Na(s)+O2(g)=Na2O2(s) ΔH2=-511kJ·mol-1
O2(g)=Na2O(s) ΔH1=-414kJ·mol-1;2Na(s)+O2(g)=Na2O2(s) ΔH2=-511kJ·mol-1写出Na2O2与Na反应生成Na2O的热化学方程式:
④利用实验装置测量。测量盐酸与NaOH溶液反应的热量变化的过程中,若取50mL0.50mol·L-1的盐酸,则还需加入
A.50mL0.50mol·L-1NaOH溶液B.50mL0.55mol·L-1NaOH溶液C.1.0gNaOH固体
您最近一年使用:0次
2022-07-22更新
|
807次组卷
|
3卷引用:第1章基础巩固测评卷-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)
(已下线)第1章基础巩固测评卷-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)第一章化学反应的热效应新疆塔城市第三中学2022-2023学年高二上学期第一次月考化学试题
21-22高一·全国·假期作业
解题方法
2 . 碱是一类重要的物质,氢氧化钠和氢氧化钙是常见的碱。
(1)我国古代劳动人民在生产、生活中就已经充分利用氢氧化钙。氢氧化钙的俗名是_______ ,请写出氢氧化钙的一种用途_______ 。
(2)为验证氢氧化钙和氢氧化钠的性质,进行如下图所示实验(装置气密性良好)。
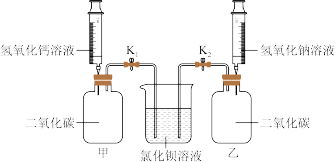
步骤:分别向充满二氧化碳的甲、乙两个容器中注入等体积的氢氧化钙饱和溶液、氢氧化钠饱和溶液;稍后打开弹簧夹K1、K2。
现象与结论:实验过程中甲、乙均有氯化钡溶液进入,进入乙中的液体量较多。从氢氧化钙和氢氧化钠性质的角度分析,产生上述现象的原因_______ 。乙中产生的白色沉淀的化学式是_______ 。
(3)在某15mL氢氧化钠溶液中滴入稀盐酸,稀盐酸的体积与溶液温度的变化关系如下图所示。

I.由上图可知,氢氧化钠溶液与盐酸反应会_______ (选填“放出”或“吸收”)热量;滴入稀盐酸的体积为_______ (选填“a”“b”“c”或“d”)mL时两者恰好完全反应。
II.设计实验,证明上述实验产生的热量来自酸碱中和反应,而不是溶液稀释所导致的。请写出实验方案。_______
(1)我国古代劳动人民在生产、生活中就已经充分利用氢氧化钙。氢氧化钙的俗名是
(2)为验证氢氧化钙和氢氧化钠的性质,进行如下图所示实验(装置气密性良好)。

步骤:分别向充满二氧化碳的甲、乙两个容器中注入等体积的氢氧化钙饱和溶液、氢氧化钠饱和溶液;稍后打开弹簧夹K1、K2。
现象与结论:实验过程中甲、乙均有氯化钡溶液进入,进入乙中的液体量较多。从氢氧化钙和氢氧化钠性质的角度分析,产生上述现象的原因
(3)在某15mL氢氧化钠溶液中滴入稀盐酸,稀盐酸的体积与溶液温度的变化关系如下图所示。

I.由上图可知,氢氧化钠溶液与盐酸反应会
II.设计实验,证明上述实验产生的热量来自酸碱中和反应,而不是溶液稀释所导致的。请写出实验方案。
您最近一年使用:0次
解题方法
3 . 二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳,总反应可表示为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)+Q(Q>0)一般认为通过如下步骤来实现:①CO2(g)+H2(g)=CO(g)+H2O(g),②CO(g)+2H2(g)=CH3OH(g)。
(1)下列示意图中能体现总反应能量变化的是___ (填标号),判断的理由是___ 。
A.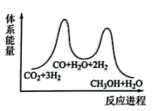 B.
B. C.
C.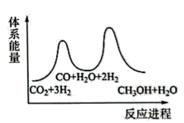
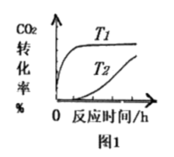
(2)在不同温度下,反应中CO2的转化率与时间的关系如图1。据图1可判断:温度T1__ T2(填“>”、“<”或“=”),理由是___ 。
总反应在起始物 =3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250℃下的x(CH3OH)~p、在p=5×105Pa下的x(CH3OH)~t如图2所示。
=3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250℃下的x(CH3OH)~p、在p=5×105Pa下的x(CH3OH)~t如图2所示。

(3)图2中对应等温过程的曲线是___ ,判断的理由是___ 。
(4)当x(CH3OH)=0.10时,CO2的平衡转化率a=___ 。反应条件可能为___ 或___ 。
(1)下列示意图中能体现总反应能量变化的是
A.
 B.
B. C.
C.
(2)在不同温度下,反应中CO2的转化率与时间的关系如图1。据图1可判断:温度T1

总反应在起始物
 =3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250℃下的x(CH3OH)~p、在p=5×105Pa下的x(CH3OH)~t如图2所示。
=3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250℃下的x(CH3OH)~p、在p=5×105Pa下的x(CH3OH)~t如图2所示。
(3)图2中对应等温过程的曲线是
(4)当x(CH3OH)=0.10时,CO2的平衡转化率a=
您最近一年使用:0次
名校
解题方法
4 . 按要求填空。
(1)下列反应中,属于吸热反应的是_______ ;属于氧化还原的放热反应是_______ 。
①煅烧石灰石 ②甲醇燃烧 ③制水煤气 ④生石灰与水反应 ⑤酸碱中和
(2)1 g液态甲醇(CH3OH)完全燃烧,生成CO2气体和液态水,放出a kJ热量。写出甲醇燃烧热的热化学方程式为_______ 。
(3)依据氧化还原反应:2Ag++Cu=Cu2++2Ag设计一个原电池,并在如图框中画出装置______ 。

(4)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25 g,则铜表面析出了氢气_______ L(标准状况)。
(1)下列反应中,属于吸热反应的是
①煅烧石灰石 ②甲醇燃烧 ③制水煤气 ④生石灰与水反应 ⑤酸碱中和
(2)1 g液态甲醇(CH3OH)完全燃烧,生成CO2气体和液态水,放出a kJ热量。写出甲醇燃烧热的热化学方程式为
(3)依据氧化还原反应:2Ag++Cu=Cu2++2Ag设计一个原电池,并在如图框中画出装置

(4)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25 g,则铜表面析出了氢气
您最近一年使用:0次
2021-12-01更新
|
84次组卷
|
2卷引用:上海市青浦高中2023-2024学年高二上学期期末考试化学模拟试卷
解题方法
5 . CH4-CO2重整反应[CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+247kJ/mol]在大力推进生态文明建设、“碳达峰”、“碳中和”的时代背景下,受到更为广泛的关注。
I.该反应以两种温室气体为原料,可以生成合成气。如何减少反应过程中的催化剂积炭,是研究的热点之一、某条件下,发生主反应的同时,还发生了积炭反应:
CO歧化:2CO(g)=CO2(g)+C(s) △H=-172kJ/mol
CH4裂解:CH4(g)=C(s)+2H2(g) △H=+75kJ/mol
(1)对积炭反应进行计算,得到以下温度和压强对积炭反应中平衡炭量的影响图,其中表示温度和压强对CH4裂解反应中平衡炭量影响的是(选填序号)___________ ,理由是___________ 。

(2)实验表明,在重整反应中,低温、高压时会有显著积炭产生,由此可推断,对于该重整反应而言,其积炭主要由___________ 反应产生。
综合以上分析,为抑制积炭产生,应选用高温、低压条件。
II.该重整反应也可用于太阳能、核能、高温废热等的储存,储能研究是另一研究热点。
(3)该反应可以储能的原因是___________ 。
某条件下,除发生主反应外,主要副反应为CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41kJ/mol。研究者研究反应物气体流量、CH4/CO2物质的量比对CH4转化率(XCH4)、储能效率的影响,部分数据如下所示。
【资料】储能效率:热能转化为化学能的效率,用ηchem表示。ηchem=Qchem/Q。其中,Qchem是通过化学反应吸收的热量,Q是设备的加热功率。
(4)气体流量越大,CH4转化率越低,原因是:随着流量的提高,反应物预热吸热量增多,体系温度明显降低,___________ 。
(5)对比实验___________ (填序号),可得出结论:CH4/CO2越低,CH4转化率越高。
(6)对比②、③发现,混合气中CO2占比越低,储能效率越高,原因可能是___________ (该条件下设备的加热功率视为不变)。
I.该反应以两种温室气体为原料,可以生成合成气。如何减少反应过程中的催化剂积炭,是研究的热点之一、某条件下,发生主反应的同时,还发生了积炭反应:
CO歧化:2CO(g)=CO2(g)+C(s) △H=-172kJ/mol
CH4裂解:CH4(g)=C(s)+2H2(g) △H=+75kJ/mol
(1)对积炭反应进行计算,得到以下温度和压强对积炭反应中平衡炭量的影响图,其中表示温度和压强对CH4裂解反应中平衡炭量影响的是(选填序号)

(2)实验表明,在重整反应中,低温、高压时会有显著积炭产生,由此可推断,对于该重整反应而言,其积炭主要由
综合以上分析,为抑制积炭产生,应选用高温、低压条件。
II.该重整反应也可用于太阳能、核能、高温废热等的储存,储能研究是另一研究热点。
(3)该反应可以储能的原因是
某条件下,除发生主反应外,主要副反应为CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41kJ/mol。研究者研究反应物气体流量、CH4/CO2物质的量比对CH4转化率(XCH4)、储能效率的影响,部分数据如下所示。
【资料】储能效率:热能转化为化学能的效率,用ηchem表示。ηchem=Qchem/Q。其中,Qchem是通过化学反应吸收的热量,Q是设备的加热功率。
| 序号 | 加热温度/℃ | 反应物气体流量/L·min-1 | CH4/CO2 | XCH4/% | ηchem/% |
| ① | 800 | 4 | 2:2 | 79.6 | 52.2 |
| ② | 800 | 6 | 3:3 | 64.2 | 61.9 |
| ③ | 800 | 6 | 2:4 | 81.1 | 41.6 |
(5)对比实验
(6)对比②、③发现,混合气中CO2占比越低,储能效率越高,原因可能是
您最近一年使用:0次
解题方法
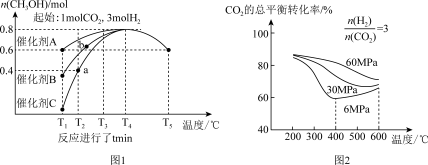
6 . 为应对全球气候变暖,科学家在综合利用 CO2方面取得了不少研究成果。如用 CO2合成重要化工原料 CH3OH,同时生成 CO,反应如下:
反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)+Q1kJ(Q1>0),
反应Ⅱ:CO2(g)+H2(g) ⇌CO(g)+H2O(g)-Q2kJ(Q2>0)。
研究催化剂等外界条件对上述反应的影响,结果如图 1、图 2
完成下列填空:
(1)一定是碳12的同位素原子是_____ (选填“A”、“B”、“C”、“D”)
A.质子数为6,中子数为8 B.质子数为8,中子数为12
C.质子数为12,中子数为6 D.质子数为12,中子数为8
(2)分析图1:催化效果最佳的是催化剂_____ (选填“A”、“B”、“C”)。若密闭容器体积为2L,则a点测得CH3OH的平均生成速率为_____ mol·L-1·min-1。b点反应_____ (填“达到”或“未达到”)平衡状态,理由是:_____
(3)分析图2:相同温度下,增大原料气压强,反应Ⅰ平衡常数_____ (选填“增大”、“减小”、“不变”、“无法判断”);当压强为6Mpa、温度在400~600℃时,CO2的总体平衡转化率随温度升高而增大的原因是___________________________________
(4)若生成的CH3OH和CO物质的量之比为4:1,则消耗相同条件下的CO2和H2体积比是_____
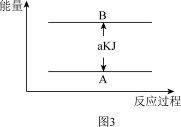
(5)若有88gCO2发生反应Ⅰ,并放出akJ热量,则图3中A为_____ ,B为_____
反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)+Q1kJ(Q1>0),
反应Ⅱ:CO2(g)+H2(g) ⇌CO(g)+H2O(g)-Q2kJ(Q2>0)。
研究催化剂等外界条件对上述反应的影响,结果如图 1、图 2

完成下列填空:
(1)一定是碳12的同位素原子是
A.质子数为6,中子数为8 B.质子数为8,中子数为12
C.质子数为12,中子数为6 D.质子数为12,中子数为8
(2)分析图1:催化效果最佳的是催化剂
(3)分析图2:相同温度下,增大原料气压强,反应Ⅰ平衡常数
(4)若生成的CH3OH和CO物质的量之比为4:1,则消耗相同条件下的CO2和H2体积比是
(5)若有88gCO2发生反应Ⅰ,并放出akJ热量,则图3中A为

您最近一年使用:0次



