名校
解题方法
1 . 在能源绿色低碳转型行动中,天然气发挥着重要作用。管道天然气实行“应改尽改、能改全改”,预计到2025年,管道天然气普及率达到95%以上。
(1)天然气的主要成分是_______ (写电子式),该分子的空间构型是_______ 。
(2)将液化石油气(主要成分为C3H8)灶改用天然气为燃料,若进气口保持不变,则需要_______ (填“调小”或“调大”)风门。
(3)CH4在光照条件下与Cl2反应,可得到各种氯代甲烷。某小组同学查阅文献可知,CH4与Cl2反应的机理为自由基(带有单电子的原子或原子团,如·Cl、·CH3)反应,包括以下几步:
I.
Ⅱ.链传递: ,
,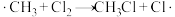 ,……
,……
Ⅲ.链终止: ,
, ……
……
为探究光照对 与
与 反应的影响,实验如下。
反应的影响,实验如下。
①由B和D得出的结论是_______ 。
②根据上述机理,解释C中几乎没有氯代甲烷的原因_______ 。
③早期的有机化合物结构理论认为,有机化合物的分子结构都是平面形的,按照这种理论丙烷_______ (填“有”或“没有”)同分异构体。
(4)丙烷氯代反应中链传递的一步反应能量变化如下。
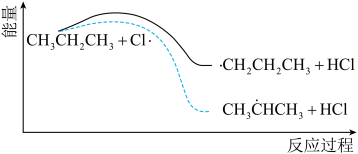
推知断裂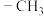 中1molC—H比断裂—CH2—中1molC—H所需能量
中1molC—H比断裂—CH2—中1molC—H所需能量_______ (填“大”或“小”)。
(1)天然气的主要成分是
(2)将液化石油气(主要成分为C3H8)灶改用天然气为燃料,若进气口保持不变,则需要
(3)CH4在光照条件下与Cl2反应,可得到各种氯代甲烷。某小组同学查阅文献可知,CH4与Cl2反应的机理为自由基(带有单电子的原子或原子团,如·Cl、·CH3)反应,包括以下几步:
I.

Ⅱ.链传递:
 ,
,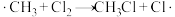 ,……
,……Ⅲ.链终止:
 ,
, ……
……为探究光照对
 与
与 反应的影响,实验如下。
反应的影响,实验如下。| 编号 | 操作 | 结果 |
| A | 将Cl2与CH4混合后,光照 | 得到氯代甲烷 |
| B | 将Cl2先用光照,然后迅速在黑暗中与CH4混合 | 得到氯代甲烷 |
| C | 将Cl2先用光照,然后在黑暗中放置一段时间,再与CH4混合 | 几乎无氯代甲烷 |
| D | 将CH4先用光照,然后迅速在黑暗中与Cl2混合 | 几乎无氯代甲烷 |
②根据上述机理,解释C中几乎没有氯代甲烷的原因
③早期的有机化合物结构理论认为,有机化合物的分子结构都是平面形的,按照这种理论丙烷
(4)丙烷氯代反应中链传递的一步反应能量变化如下。

推知断裂
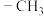 中1molC—H比断裂—CH2—中1molC—H所需能量
中1molC—H比断裂—CH2—中1molC—H所需能量
您最近一年使用:0次
名校
2 . 实验室研究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1=-49.5kJ·mol-1
Ⅱ.CO(g)+2H2(g)⇌CH3OH(g) ΔH2=-90.4kJ·mol-1
Ⅲ.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH3>0
不同压强下,按照n(CO2)∶n(H2)=1∶3投料,实验测定CH3OH的平衡产率(图1)和CO2的平衡转化率(图2)随温度的变化关系如图所示。回答问题
(1)图1中,一定压强下,CH3OH的平衡产率随温度升高而下降的原因是______ 。
(2)图1中,压强p1、p2、p3由大到小的顺序为______ 。
(3)图2中T1温度时,三条曲线几乎交于一点的原因是______ 。
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为______。
Ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1=-49.5kJ·mol-1
Ⅱ.CO(g)+2H2(g)⇌CH3OH(g) ΔH2=-90.4kJ·mol-1
Ⅲ.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH3>0
不同压强下,按照n(CO2)∶n(H2)=1∶3投料,实验测定CH3OH的平衡产率(图1)和CO2的平衡转化率(图2)随温度的变化关系如图所示。回答问题

(1)图1中,一定压强下,CH3OH的平衡产率随温度升高而下降的原因是
(2)图1中,压强p1、p2、p3由大到小的顺序为
(3)图2中T1温度时,三条曲线几乎交于一点的原因是
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为______。
| A.低温、高压 | B.高温、低压 | C.低温、低压 | D.高温、高压 |
您最近一年使用:0次
名校
解题方法
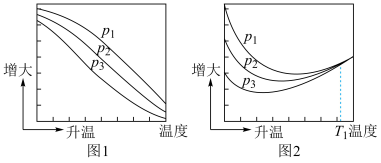
3 . 已知N-H键、O=O键、H-O键键能分别为391kJ·mol-1、497kJ·mol-1、463kJ·mol-1,N2H4(g)与O2(g)反应的能量变化如图所示:
(1)N2H4(g)与O2(g)的反应是___________ (放热/吸热)反应。
(2)N2H4(g)中N-N键的键能为___________ 。
(3)N2(g)中N N键的键能为
N键的键能为___________ 。
(4)美国加利福尼亚大学圣地亚哥的 G·N·SChrauzer等人用氮气和水蒸气在触媒上,光照射下合成高能气态联氨初获成功,该反应的热化学方程式为:___________ 。
(5)在实验室中可以用次氯酸钠和氨气常温制备联氨,反应的离子方程式为:___________ 。
(6)联氨(N2H4)在水中电离方式与NH3相似,若将NH3视为一元弱碱,则N2H4是一种二元弱碱。根据以上信息,推断下列关于N2H4的说法不正确的是_________

(1)N2H4(g)与O2(g)的反应是
(2)N2H4(g)中N-N键的键能为
(3)N2(g)中N
 N键的键能为
N键的键能为(4)美国加利福尼亚大学圣地亚哥的 G·N·SChrauzer等人用氮气和水蒸气在触媒上,光照射下合成高能气态联氨初获成功,该反应的热化学方程式为:
(5)在实验室中可以用次氯酸钠和氨气常温制备联氨,反应的离子方程式为:
(6)联氨(N2H4)在水中电离方式与NH3相似,若将NH3视为一元弱碱,则N2H4是一种二元弱碱。根据以上信息,推断下列关于N2H4的说法不正确的是_________
| A.它与硫酸形成的酸式盐可以表示为N2H5HSO4 |
| B.它溶于水所得的溶液中共有4种离子 |
C.它溶于水发生电离的第一步可表示为:N2H4+H2O N2H N2H +OH- +OH- |
| D.若已知联氨和四氧化二氮可以做火箭推进剂,两者反应产物可以是氮气和水 |
您最近一年使用:0次
名校
解题方法
4 . 化学反应与能量变化
化学反应过程中,不仅有物质的变化,同时还伴随能量变化。研究化学反应中的能量变化有重要意义。
(1)下列反应中属于吸热反应的是________
(2)已知充分燃烧1 mol乙炔气体(分子式为C2H2)时生成二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是________
(3)分别取 的盐酸与
的盐酸与 的氢氧化钠溶液混合进行中和热的测定,下列说法正确的是________
的氢氧化钠溶液混合进行中和热的测定,下列说法正确的是________
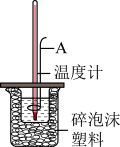
(4)下列说法正确的是________
(5)如图是某化学反应中的能量变化图。
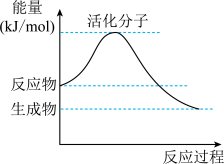
①该反应是___________ (填“吸热”或“放热”)反应。
②请在图中标注出该反应的活化能 。
。_________
(6)298K,100KPa时,把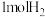 和
和 放在某密闭容器中进行反应,热化学方程式如下:
放在某密闭容器中进行反应,热化学方程式如下:
 ,测得反应放出的热量总是少于9 kJ/mol,其原因是
,测得反应放出的热量总是少于9 kJ/mol,其原因是___________ 。
化学反应过程中,不仅有物质的变化,同时还伴随能量变化。研究化学反应中的能量变化有重要意义。
(1)下列反应中属于吸热反应的是________
| A.氢气燃烧 | B.铝粉和氧化铁粉末的反应 |
| C.浓硫酸稀释 | D.Ba(OH)2·8H2O和NH4Cl固体的反应 |
A.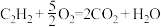 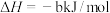 |
B.  |
C. 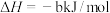 |
D.  |
 的盐酸与
的盐酸与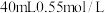 的氢氧化钠溶液混合进行中和热的测定,下列说法正确的是________
的氢氧化钠溶液混合进行中和热的测定,下列说法正确的是________
| A.仪器A是金属搅拌棒 |
| B.稍过量的氢氧化钠是确保盐酸完全反应 |
| C.酸碱混合时,NaOH溶液应缓缓倒入小烧杯中,不断搅拌 |
| D.用氢氧化钡和硫酸代替氢氧化钠和盐酸溶液,结果也是正确的 |
| A.焓变或熵变均可以单独作为反应自发性的判据 |
| B.能自发进行的反应一定能迅速发生 |
C. 、 、 的反应在低温时能自发进行 的反应在低温时能自发进行 |
D.两种物质反应,无论方程式的书写形式如何, 均不变 均不变 |

①该反应是
②请在图中标注出该反应的活化能
 。
。(6)298K,100KPa时,把
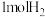 和
和 放在某密闭容器中进行反应,热化学方程式如下:
放在某密闭容器中进行反应,热化学方程式如下:
 ,测得反应放出的热量总是少于9 kJ/mol,其原因是
,测得反应放出的热量总是少于9 kJ/mol,其原因是
您最近一年使用:0次
名校
解题方法
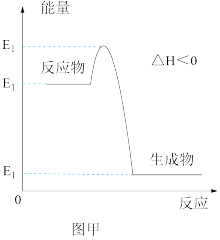
5 . 工业制硫酸中的一步重要反应是 在400~500℃下的催化氧化。
在400~500℃下的催化氧化。
(1)根据图甲,该反应是___________ (填“放热”或者“吸热”)反应。 和5mol
和5mol ,反应过程中部分物质的物质的量随反应时间变化的曲线如图所示。恒温恒容时,下列措施能使该反应速率增大的是_____。
,反应过程中部分物质的物质的量随反应时间变化的曲线如图所示。恒温恒容时,下列措施能使该反应速率增大的是_____。
(3)2min时,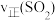
___________ 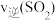 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)在图中画出 的物质的量随反应时间变化的曲线
的物质的量随反应时间变化的曲线_____ 。
 在400~500℃下的催化氧化。
在400~500℃下的催化氧化。(1)根据图甲,该反应是
 和5mol
和5mol ,反应过程中部分物质的物质的量随反应时间变化的曲线如图所示。恒温恒容时,下列措施能使该反应速率增大的是_____。
,反应过程中部分物质的物质的量随反应时间变化的曲线如图所示。恒温恒容时,下列措施能使该反应速率增大的是_____。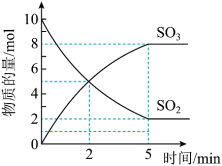
A.增加 的浓度 的浓度 | B.选择高效催化剂 | C.充入氦气 | D.适当降低温度 |
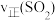
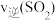 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(4)在图中画出
 的物质的量随反应时间变化的曲线
的物质的量随反应时间变化的曲线
您最近一年使用:0次
解题方法
6 . 为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:

(1)上述 3 个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是______ ;
(2)某同学选用装置I 进行实验(实验前U 型管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U 型管中可观察到的现象是___________ ,说明该反应属于___________ (选填“吸热” 或“放热”)反应。
(3)为探究固体M 溶于水的热效应,选择装置 II 进行实验(反应在甲中进行)。
①若 M 为Na,则实验过程中烧杯中可观察到的现象是___________
②若观察到烧杯里产生气泡,则说明 M 溶于水___________ (选填“一定是放热反应”、“一定是吸热反应” 或“可能是放热反应”),理由是___________ 。
③若观察到烧杯里玻璃管内形成一段水柱,则 M 溶于水是___________ (选填“放热”或“吸热”)过程。
(4)C(石墨)与适量 H2O(g)反应生成标准状况下 CO 和H2各 2.24L 时,吸收 3.13kJ 热量,该反应的热化学方程式为___________ 。

(1)上述 3 个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是
(2)某同学选用装置I 进行实验(实验前U 型管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U 型管中可观察到的现象是
(3)为探究固体M 溶于水的热效应,选择装置 II 进行实验(反应在甲中进行)。
①若 M 为Na,则实验过程中烧杯中可观察到的现象是
②若观察到烧杯里产生气泡,则说明 M 溶于水
③若观察到烧杯里玻璃管内形成一段水柱,则 M 溶于水是
(4)C(石墨)与适量 H2O(g)反应生成标准状况下 CO 和H2各 2.24L 时,吸收 3.13kJ 热量,该反应的热化学方程式为
您最近一年使用:0次
7 . 我们通过更深入地研究化学反应的方向、限度和速率,利用这些规律来解决日常生活和工业生产中的实际问题,让生活更美好。
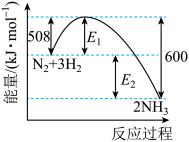
(1)一定条件下,在密闭容器中,氮气与氢气合成氨气,能量变化曲线如图所示。下列说法正确的是___________
(2)乙烯与水通过加成反应可得乙醇。反应机理、能量变化与反应进程的关系如图所示:
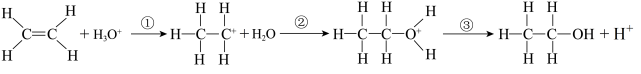
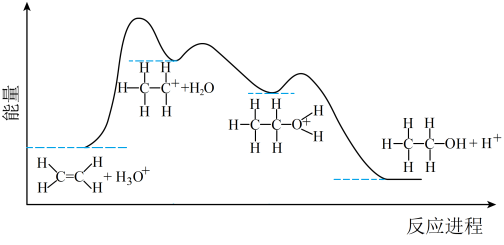
下列叙述正确的是________
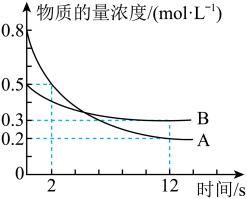
(3)某温度下,在2L恒容密闭容器中投入一定量的A、B,发生反应:3A(g)+bB(g) cC(g)+2D(s),12s时生成C的物质的量为0.8mol(反应进程如图所示)。下列说法中正确的是__________
cC(g)+2D(s),12s时生成C的物质的量为0.8mol(反应进程如图所示)。下列说法中正确的是__________
(4)一定条件下N2O发生如下反应:
Ⅰ. 2N2O(g) 2N2(g)+O2(g)
2N2(g)+O2(g)  =-164kJ·mol-1
=-164kJ·mol-1
Ⅱ. N2O(g)+CO(g) N2(g)+CO2(g)
N2(g)+CO2(g)  =-356kJ·mol-1
=-356kJ·mol-1
①反应Ⅰ平衡常数的表达式K=___________ 。
②恒温恒容条件下,下列可以作为判断反应Ⅰ达到平衡的依据是___________ 。
a. 气体的压强不变 b. 2v正(N2O)=v逆(O2) c. K不变 d. 容器内气体的密度不变
③某温度下,反应Ⅰ的K=0.16,该温度下,测得容器中N2O、N2、O2的浓度分别为0.5mol·L-1、0.5mol·L-1、0.25mol·L-1,此时,反应Ⅰ是否处于平衡状态? 若不是,预测反应的方向。___________
(5)甲为10L的恒温容器。盛有1mol N2O和1mol CO,发生反应Ⅰ和反应Ⅱ,5min时,测得CO转化率为60%,n(N2):n(O2)=8:1,则n(N2O)=___________ mol;0~5min,O2的平均反应速率v(O2)=___________ mol·L-1·min-1。
(6)不同压强的密闭容器中分别充入1mol N2O和1mol CO,发生反应Ⅰ和反应Ⅱ,测得N2O的平衡转化率与温度的关系如图所示。

P1、P2、P3由小到大的顺序为___________ ;温度高于T0℃时,容器内发生的主要反应为___________ (填“Ⅰ”、“Ⅱ”或“Ⅰ和Ⅱ”)。
(1)一定条件下,在密闭容器中,氮气与氢气合成氨气,能量变化曲线如图所示。下列说法正确的是___________

| A.加入催化剂,E1、E2都变小 |
B.N2(g)+3H2(g)  2NH3(g) 2NH3(g)  =-600kJ·mol-1 =-600kJ·mol-1 |
| C.升温可以增大该反应的化学平衡常数 |
| D.通入1mol N2和3mol H2充分反应,放热小于92kJ |


下列叙述正确的是________
| A.①、②、③三步均属于加成反应 |
| B.H+为反应的催化剂 |
| C.①、②、③三步反应均为放热反应 |
| D.总反应是放热反应,不需要加热就能发生 |
 cC(g)+2D(s),12s时生成C的物质的量为0.8mol(反应进程如图所示)。下列说法中正确的是__________
cC(g)+2D(s),12s时生成C的物质的量为0.8mol(反应进程如图所示)。下列说法中正确的是__________
| A.0-2s,D的平均反应速率为0.1mol/(L·s) |
| B.12s时,B的转化率为40% |
| C.化学计量系数之比b:c=1:2 |
| D.图中两曲线相交时,A的消耗速率等于A的生成速率 |
Ⅰ. 2N2O(g)
 2N2(g)+O2(g)
2N2(g)+O2(g)  =-164kJ·mol-1
=-164kJ·mol-1Ⅱ. N2O(g)+CO(g)
 N2(g)+CO2(g)
N2(g)+CO2(g)  =-356kJ·mol-1
=-356kJ·mol-1①反应Ⅰ平衡常数的表达式K=
②恒温恒容条件下,下列可以作为判断反应Ⅰ达到平衡的依据是
a. 气体的压强不变 b. 2v正(N2O)=v逆(O2) c. K不变 d. 容器内气体的密度不变
③某温度下,反应Ⅰ的K=0.16,该温度下,测得容器中N2O、N2、O2的浓度分别为0.5mol·L-1、0.5mol·L-1、0.25mol·L-1,此时,反应Ⅰ是否处于平衡状态? 若不是,预测反应的方向。
(5)甲为10L的恒温容器。盛有1mol N2O和1mol CO,发生反应Ⅰ和反应Ⅱ,5min时,测得CO转化率为60%,n(N2):n(O2)=8:1,则n(N2O)=
(6)不同压强的密闭容器中分别充入1mol N2O和1mol CO,发生反应Ⅰ和反应Ⅱ,测得N2O的平衡转化率与温度的关系如图所示。

P1、P2、P3由小到大的顺序为
您最近一年使用:0次
名校
解题方法
8 . 以生物材质(以C计)与水蒸气反应制取H2是一种低耗能、高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及的反应有:
I.C(s)+H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
Ⅱ.CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
Ⅲ.CaO(s)+CO2(g) CaCO3(s)
CaCO3(s)
(1)对于反应I,不同温度和压强对H2产率影响如下表。
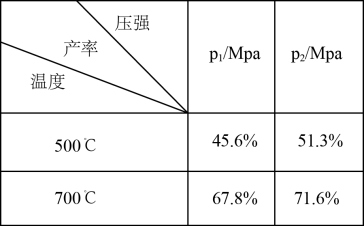
该反应是___________ (填“吸热”或“放热”)反应,p1___________ p2(填“>、<或=”);下列图像正确的是___________ 。
(2)在某恒容、绝热密闭容器中模拟上述气化炉制氢中的反应Ⅱ,下列能说明该反应达到平衡状态的是___________。
(3)对于反应Ⅲ,其他条件不变,平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡___________ 移动(填“向右”、“向左”或“不”);当重新平衡后,CO2浓度___________ (填“变大”、“变小”或“不变”),理由是___________ 。
I.C(s)+H2O(g)
 CO(g)+H2(g)
CO(g)+H2(g)Ⅱ.CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)Ⅲ.CaO(s)+CO2(g)
 CaCO3(s)
CaCO3(s)(1)对于反应I,不同温度和压强对H2产率影响如下表。

该反应是

(2)在某恒容、绝热密闭容器中模拟上述气化炉制氢中的反应Ⅱ,下列能说明该反应达到平衡状态的是___________。
| A.混合气体的温度不再变化 |
| B.H2O(g)、H2(g)的物质的量之比为1:1,且各质量不再变化 |
| C.混合气体的密度保持不变 |
| D.断裂amolH—H键的同时形成2amolH—O键 |
您最近一年使用:0次
名校
解题方法
9 . 将煤液化得到的甲醇是重要的化工原料。下图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。
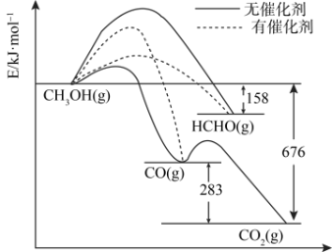
(1)在有催化剂作用下,CH3OH与O2反应主要生成___________ (填“CO”、“CO2”或HCHO”)。请补全热化学方程式HCHO(g)+1/2O2(g)=CO(g)+H2O(g)___________ 。
(2)请从有效碰撞理论的角度说明加入催化剂可以加快化学反应速率的原因:___________ 。
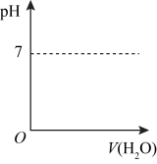
(3)HCHO可进一步被氧化为重要工业原料HCOOH(其酸性比H2SO3弱,比CH3COOH强)。在下图中画出常温下向甲酸钠溶液中加水时溶液的pH的变化___________ 。

(1)在有催化剂作用下,CH3OH与O2反应主要生成
(2)请从有效碰撞理论的角度说明加入催化剂可以加快化学反应速率的原因:
(3)HCHO可进一步被氧化为重要工业原料HCOOH(其酸性比H2SO3弱,比CH3COOH强)。在下图中画出常温下向甲酸钠溶液中加水时溶液的pH的变化

您最近一年使用:0次
名校
解题方法
10 . 碳达峰碳中和。实现碳达峰中和是贯彻新发展理念、构建新发展格局、推动高质量发展的内在要求。因此,二氧化碳的合理利用成为研究热点。其中,CO2经催化加氢可以生成低碳有机物,有以下反应:
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g);
CH3OH(g)+H2O(g);
反应Ⅱ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
(1)已知反应I是放热反应,能正确表示该反应的图示是___________ 。
A.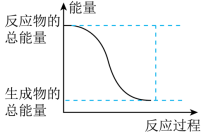 B.
B.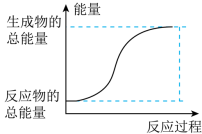
(2)在2L密闭容器中,充入10 mol CO2和32mol H2,在催化剂、200℃的条件下,发生反应I,部分反应物和产物随时间变化如下图所示:
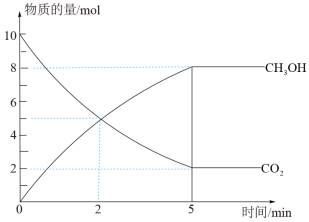
①0~2min末,以H2的浓度变化表示反应的平均速率为___________ 。
②下列措施中能增大反应速率且利于平衡正向移动的是___________ 。
A. 升高反应温度 B. 将CH3OH与反应混合物分离
C. 使用高效催化剂 D. 增大CO2浓度
③下列情况能说明该反应达到化学平衡状态的是___________ 。
A. 单位时间内消耗1mol CO2,同时生成1mol CH3OH
B. 密闭容器中n(CO2):n(H2O)不发生变化
C. CO2、H2、CH3OH浓度之比为1:3:1的状态
D. 密闭容器内混合气体的密度不发生变化
(3)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应Ⅱ,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。
其中:CH3OH的选择性=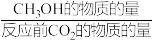 ×100%
×100%
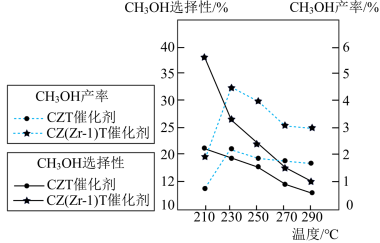
①温度高于230℃,CH3OH产率随温度升高而下降的原因是___________ 。
②在上述条件下合成甲醇的工业条件是___________ 。
A. 210℃ B. 230℃ C. 催化剂ZCT D. 催化剂CZ(Zr-1)T
反应I:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g);
CH3OH(g)+H2O(g);反应Ⅱ:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)(1)已知反应I是放热反应,能正确表示该反应的图示是
A.
 B.
B.
(2)在2L密闭容器中,充入10 mol CO2和32mol H2,在催化剂、200℃的条件下,发生反应I,部分反应物和产物随时间变化如下图所示:

①0~2min末,以H2的浓度变化表示反应的平均速率为
②下列措施中能增大反应速率且利于平衡正向移动的是
A. 升高反应温度 B. 将CH3OH与反应混合物分离
C. 使用高效催化剂 D. 增大CO2浓度
③下列情况能说明该反应达到化学平衡状态的是
A. 单位时间内消耗1mol CO2,同时生成1mol CH3OH
B. 密闭容器中n(CO2):n(H2O)不发生变化
C. CO2、H2、CH3OH浓度之比为1:3:1的状态
D. 密闭容器内混合气体的密度不发生变化
(3)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应Ⅱ,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。
其中:CH3OH的选择性=
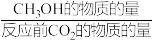 ×100%
×100%
①温度高于230℃,CH3OH产率随温度升高而下降的原因是
②在上述条件下合成甲醇的工业条件是
A. 210℃ B. 230℃ C. 催化剂ZCT D. 催化剂CZ(Zr-1)T
您最近一年使用:0次



