名校
解题方法
1 . 下列实验设计或所选装置合理的是
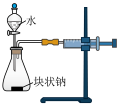 | 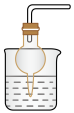 | 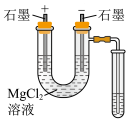 | 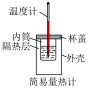 |
A.通过注射器活塞右移,验证 与 与 反应放热 反应放热 | B. 溶液吸收尾气 溶液吸收尾气 | C.电解 溶液,制备金属 溶液,制备金属 | D.测定中和反应反应热 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-08更新
|
292次组卷
|
3卷引用:湖北省十一校2023-2024学年高三上学期第一次联考化学试题
名校
解题方法
2 . 乙苯与氯气在光照条件下反应生成两种一氯取代物,反应过程中的能量变化如下图所示。下列说法正确的是( )
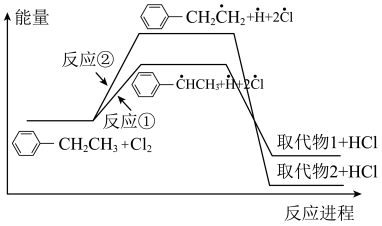

A.反应生成相同物质的量的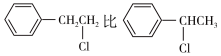 吸收的热量更多 吸收的热量更多 |
| B.反应刚开始时产物中取代物2所占的比例大于取代物1 |
C.反应①的 大于反应②的 大于反应②的 |
D.稳定性: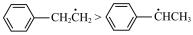 |
您最近一年使用:0次
2023-12-08更新
|
202次组卷
|
3卷引用:天津市第一中学2023-2024学年高三上学期第二次月考化学试题
解题方法
3 . 乙醇在浓硫酸做催化剂的条件下发生脱水反应,反应历程和能量变化关系图如下,下列说法正确的是。
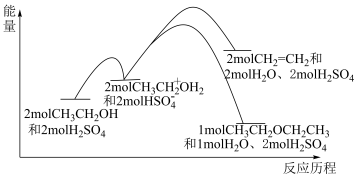
| A.采用较低温度,可获得产率更高的乙醚 |
| B.在上述相同条件下,正丙醇比异丙醇更容易反应 |
| C.为了获得更多的乙烯,温度越高越好 |
| D.选择合适的催化剂,可提高平衡时乙烯的产率 |
您最近一年使用:0次
4 . 自由基是化学键断裂时产生的含未成对电子的中间体,HNO自由基与 反应过程的能量变化如图所示,下列说法正确的是
反应过程的能量变化如图所示,下列说法正确的是
 反应过程的能量变化如图所示,下列说法正确的是
反应过程的能量变化如图所示,下列说法正确的是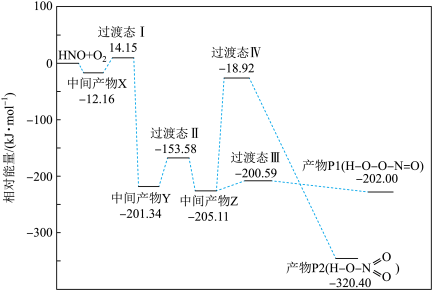
A.反应过程中,产物 的浓度先增大,后减小 的浓度先增大,后减小 |
B.过渡态能量越高,反应的活化能越高,反应的 越小 越小 |
C.其它条件相同,升高温度,达到平衡时,生成的产物中 的百分含量增大 的百分含量增大 |
D.反应过程中,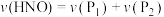 |
您最近一年使用:0次
名校
5 . 苯乙稀是生产塑料和合成橡胶的重要有机原料,可由乙苯催化脱氢获得。
(1)科技工作者结合实验与计算机模拟结果,研究了一个乙苯分子在催化剂表面脱氢制苯乙烯的反应,其历程如图所示(吸附在催化剂表面的物质用*标注):
___________ (填“>”“<”或“=”)0,为提高乙苯的平衡转化率,应选择的反应条件为___________ (填标号)。
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
(2)有研究者发现,在 气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图:
气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图:___________ 。
②根据反应历程分析,催化剂表面酸碱性对乙苯脱氢反应影响较大,如果催化剂表面碱性太强,会降低乙苯的转化率,碱性太强使乙苯转化率降低的原因是___________ (写一点即可)。
③从资源综合利用角度分析, 氧化乙苯脱氢制苯乙烯的优点是
氧化乙苯脱氢制苯乙烯的优点是___________ 。
(3) 恒压下,将
恒压下,将 乙苯蒸气通入体积可变的密闭容器中发生乙苯脱氢制苯乙烯反应。
乙苯蒸气通入体积可变的密闭容器中发生乙苯脱氢制苯乙烯反应。
① 时,反应经过
时,反应经过 达到平衡,此时苯乙烯的体积分数为0.375,则乙苯的转化率为
达到平衡,此时苯乙烯的体积分数为0.375,则乙苯的转化率为________ , 内的平均反应速率
内的平均反应速率
________  ,该温度下的
,该温度下的
________  。
。
②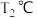 时,若再向体系中通入氮气,此时
时,若再向体系中通入氮气,此时
___________ (填“增大”“减小”或“不变”)。
(1)科技工作者结合实验与计算机模拟结果,研究了一个乙苯分子在催化剂表面脱氢制苯乙烯的反应,其历程如图所示(吸附在催化剂表面的物质用*标注):
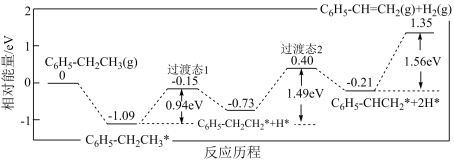

A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
(2)有研究者发现,在
 气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图:
气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图: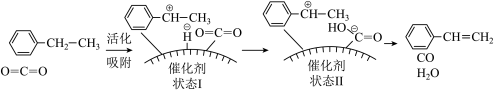
②根据反应历程分析,催化剂表面酸碱性对乙苯脱氢反应影响较大,如果催化剂表面碱性太强,会降低乙苯的转化率,碱性太强使乙苯转化率降低的原因是
③从资源综合利用角度分析,
 氧化乙苯脱氢制苯乙烯的优点是
氧化乙苯脱氢制苯乙烯的优点是(3)
 恒压下,将
恒压下,将 乙苯蒸气通入体积可变的密闭容器中发生乙苯脱氢制苯乙烯反应。
乙苯蒸气通入体积可变的密闭容器中发生乙苯脱氢制苯乙烯反应。①
 时,反应经过
时,反应经过 达到平衡,此时苯乙烯的体积分数为0.375,则乙苯的转化率为
达到平衡,此时苯乙烯的体积分数为0.375,则乙苯的转化率为 内的平均反应速率
内的平均反应速率
 ,该温度下的
,该温度下的
 。
。②
 时,若再向体系中通入氮气,此时
时,若再向体系中通入氮气,此时
您最近一年使用:0次
2023-12-01更新
|
830次组卷
|
6卷引用:2024届河南省新乡市高三第一次模拟考试理科综合试题
2024届河南省新乡市高三第一次模拟考试理科综合试题河南省濮阳市油田第一中学2024届高三第四次考试理科综合化学试题河北省邯郸市六校联考2023-2024学年高二上学期11月月考化学试题2024届陕西省西安市第一中学高三上学期12月月考理综试卷(已下线)专题10 化学反应原理综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)2024届内蒙古自治区包头市高三下学期适应性考试(一)理综试题-高中化学
名校
6 . C2H6氧化脱氢制CH4的反应为放热反应,某科研团队结合实验与计算机模拟结果,研究了在Ni催化作用下C2H6氧化脱氢制CH4的反应机理,其部分反应历程如图所示。
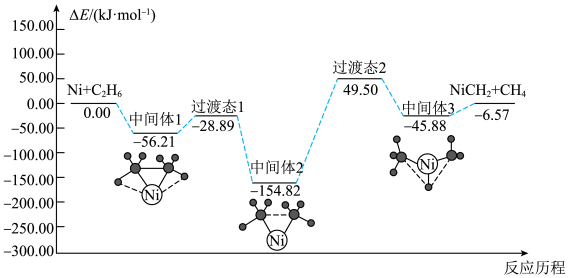
下列说法正确的是

下列说法正确的是
| A.选用高效催化剂,可以降低反应的△H |
B.决速步骤的反应为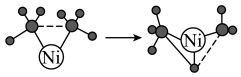 |
| C.在反应过程中NiCH2是催化剂 |
| D.降低温度会降低乙烷的平衡转化率 |
您最近一年使用:0次
2023-11-30更新
|
227次组卷
|
2卷引用:河北衡水中学2023-2024学年高三上学期三调考试化学试题
7 . 实验室利用SO2和Cl2在活性炭作用下制取SO2Cl2,原理为SO2(g)+Cl2(g)  SO2Cl2(l) ΔH=-97.3 kJ/mol。装置如图所示(部分装置已省略)。已知SO2Cl2的熔点为-54.1 ℃,沸点为69.1 ℃,遇水能发生剧烈反应并产生白雾。下列说法正确的是
SO2Cl2(l) ΔH=-97.3 kJ/mol。装置如图所示(部分装置已省略)。已知SO2Cl2的熔点为-54.1 ℃,沸点为69.1 ℃,遇水能发生剧烈反应并产生白雾。下列说法正确的是
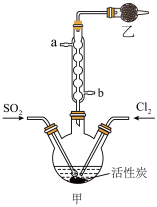
 SO2Cl2(l) ΔH=-97.3 kJ/mol。装置如图所示(部分装置已省略)。已知SO2Cl2的熔点为-54.1 ℃,沸点为69.1 ℃,遇水能发生剧烈反应并产生白雾。下列说法正确的是
SO2Cl2(l) ΔH=-97.3 kJ/mol。装置如图所示(部分装置已省略)。已知SO2Cl2的熔点为-54.1 ℃,沸点为69.1 ℃,遇水能发生剧烈反应并产生白雾。下列说法正确的是
| A.乙装置中盛放的试剂为无水氯化钙 | B.制备过程中需要将装置甲置于冰水浴中 |
| C.冷却水应该从b口进,a口出 | D.可用硝酸与亚硫酸钠反应制备二氧化硫 |
您最近一年使用:0次
8 . 二氧化硫的治理已成为当前研究的课题。请回答下列问题:
(1)硫与硫的氧化物在转化过程中的能量变化如图所示。

①图中的Ⅰ、Ⅱ、Ⅲ、Ⅳ中属于放热反应的是___________ 。
(2)工业用 和
和 反应合成
反应合成 反应的反应热
反应的反应热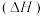 、活化能(
、活化能(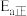 )为:
)为: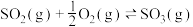
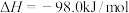
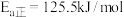 ,三氧化硫的分解反应
,三氧化硫的分解反应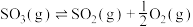 的活化能
的活化能
___________ kJ/mol。
(3)查阅资料可知,25℃,部分弱酸的电离平衡常数如表:
①0.1mol/L 溶液的pH
溶液的pH___________ (填“大于”“小于”或“等于”)0.1mol/L 溶液的pH。
溶液的pH。
②向 溶液通入少量
溶液通入少量 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(4) 会对环境和人体健康带来极大的危害,工业上采取多种方法减少
会对环境和人体健康带来极大的危害,工业上采取多种方法减少 的排放。
的排放。
方法1:电化学法处理
利用过氧化氢吸收 可消除
可消除 污染,设计装置如图所示。
污染,设计装置如图所示。
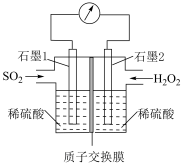
①石墨1电极处发生的电极反应式为___________ 。
方法2:用氨水除去
②已知25℃, 的
的 。若氨水的浓度为2.0mo/L,溶液中的
。若氨水的浓度为2.0mo/L,溶液中的 =
=___________ mol/L。将 通入该氨水中,当
通入该氨水中,当 降至
降至 时,结合(2)表中数据,计算溶液中的
时,结合(2)表中数据,计算溶液中的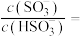
___________ 。
(1)硫与硫的氧化物在转化过程中的能量变化如图所示。

①图中的Ⅰ、Ⅱ、Ⅲ、Ⅳ中属于放热反应的是
(2)工业用
 和
和 反应合成
反应合成 反应的反应热
反应的反应热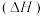 、活化能(
、活化能(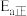 )为:
)为: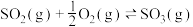
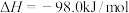
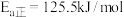 ,三氧化硫的分解反应
,三氧化硫的分解反应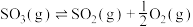 的活化能
的活化能
(3)查阅资料可知,25℃,部分弱酸的电离平衡常数如表:
| 弱酸 |  |  |
| 电离平衡常数(25℃) | 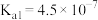 , ,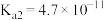 |  , ,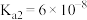 |
 溶液的pH
溶液的pH 溶液的pH。
溶液的pH。②向
 溶液通入少量
溶液通入少量 发生反应的离子方程式为
发生反应的离子方程式为(4)
 会对环境和人体健康带来极大的危害,工业上采取多种方法减少
会对环境和人体健康带来极大的危害,工业上采取多种方法减少 的排放。
的排放。方法1:电化学法处理

利用过氧化氢吸收
 可消除
可消除 污染,设计装置如图所示。
污染,设计装置如图所示。
①石墨1电极处发生的电极反应式为
方法2:用氨水除去

②已知25℃,
 的
的 。若氨水的浓度为2.0mo/L,溶液中的
。若氨水的浓度为2.0mo/L,溶液中的 =
= 通入该氨水中,当
通入该氨水中,当 降至
降至 时,结合(2)表中数据,计算溶液中的
时,结合(2)表中数据,计算溶液中的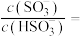
您最近一年使用:0次
2023-11-30更新
|
292次组卷
|
2卷引用:辽宁省沈阳市第二中学2023-2024学年高三上学期期中考试化学试题
9 . 下列反应属于放热反应且不属于氧化还原反应的是
| A.稀释浓硫酸 | B.碳酸氢钠与盐酸反应 |
| C.稀醋酸与氢氧化钠溶液反应 | D.镁与稀盐酸反应 |
您最近一年使用:0次
2023-11-24更新
|
154次组卷
|
3卷引用:选择题1-5
名校
10 . 汽车尾气的污染是现代研究的重要课题。一定条件下对汽车尾气有效治理的反应要经历以下三个基元反应阶段,反应历程如图甲所示(TS表示过渡态,图示涉及的物质均是气体)。
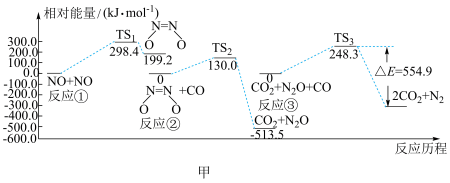
请回答下列问题:
(1)写出有效治理汽车尾气的三个基元反应中反应②的热化学方程式为_______ ;上述该过程的总反应热化学方程式为_______ 。
(2)汽车尾气中含有N2O,在一定条件下N2O会发生反应2N2O(g) 2N2(g)+O2(g)。在三个密闭容器Ⅰ、Ⅱ、Ⅲ中分别通入0.1molN2O气体,各容器中N2O的平衡转化率如图乙所示。
2N2(g)+O2(g)。在三个密闭容器Ⅰ、Ⅱ、Ⅲ中分别通入0.1molN2O气体,各容器中N2O的平衡转化率如图乙所示。

①该反应的逆反应为_________ 反应(填“放热”或“吸热”)。
②若三个密闭容器的容积分别为VI、VII、VIII,则VI、VII、VIII的大小关系为_______ 。
③若VII=1L,470℃时容器Ⅱ中反应的平衡常数K为_______ ;在此温度下,向1L的密闭容器Ⅳ中通入0.06molN2O、0.06molN2和0.04molO2,则反应开始时v正(N2O)_____ v逆(N2O)(填“>”“=”或“<”)。
(3)汽车尾气中的NO可与Br2发生反应:2NO(g)+Br2(g) 2NOBr(g) △H=-akJ•mol-1(a>0),其反应机理如下:
2NOBr(g) △H=-akJ•mol-1(a>0),其反应机理如下:
①NO(g)+Br2(g) NOBr2(g) 快
NOBr2(g) 快
②NO(g)+NOBr2(g) 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是_______ (填字母序号)。

请回答下列问题:
(1)写出有效治理汽车尾气的三个基元反应中反应②的热化学方程式为
(2)汽车尾气中含有N2O,在一定条件下N2O会发生反应2N2O(g)
 2N2(g)+O2(g)。在三个密闭容器Ⅰ、Ⅱ、Ⅲ中分别通入0.1molN2O气体,各容器中N2O的平衡转化率如图乙所示。
2N2(g)+O2(g)。在三个密闭容器Ⅰ、Ⅱ、Ⅲ中分别通入0.1molN2O气体,各容器中N2O的平衡转化率如图乙所示。
①该反应的逆反应为
②若三个密闭容器的容积分别为VI、VII、VIII,则VI、VII、VIII的大小关系为
③若VII=1L,470℃时容器Ⅱ中反应的平衡常数K为
(3)汽车尾气中的NO可与Br2发生反应:2NO(g)+Br2(g)
 2NOBr(g) △H=-akJ•mol-1(a>0),其反应机理如下:
2NOBr(g) △H=-akJ•mol-1(a>0),其反应机理如下:①NO(g)+Br2(g)
 NOBr2(g) 快
NOBr2(g) 快②NO(g)+NOBr2(g)
 2NOBr(g) 慢
2NOBr(g) 慢下列有关该反应的说法正确的是
| A.该反应的速率主要取决于反应①的快慢 |
| B.NOBr2是该反应的催化剂 |
| C.正反应的活化能比逆反应的活化能小akJ•mol-1 |
| D.增大Br2(g)的浓度能增大活化分子百分数,加快反应速率 |
您最近一年使用:0次



