名校
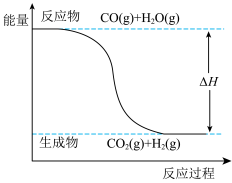
1 . 水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g) ΔH]是重要的化工过程,反应过程中的能量变化如下图所示。
②H2O(g)=H2O(l) ΔH=-44kJ/mol
下列叙述错误的是
| 化学键 | H-H | H-O | C=O | C≡O |
| E/(kJ·mol-1) | 436 | 465 | 805 | 1076 |
下列叙述错误的是
| A.反应使用催化剂时,不会改变其ΔH |
| B.CO中化学键的键能为1076kJ/mol |
| C.水煤气变换反应的ΔH=-40kJ/mol |
| D.若H2O的状态为液态,则该反应仍为放热反应 |
您最近一年使用:0次
2024-01-03更新
|
147次组卷
|
2卷引用:重庆市第一中学校2023-2024学年高三上学期11月月考化学试卷
名校
2 . 2022年诺贝尔化学奖授予了对点击化学和生物正交化学作出贡献的三位科学家。点击化学的代表反应为“叠氮化物炔烃”反应,其反应原理如图所示(R1和R2代表烷基)。下列说法正确的是
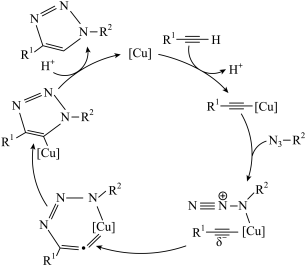

| A.整个反应中碳原子的杂化方式共有2种 |
B. 在[Cu]作用下,C-H键断裂并放出能量 在[Cu]作用下,C-H键断裂并放出能量 |
| C.该反应原理的总反应的原子利用率为100% |
| D.反应中[Cu]可降低反应的活化能,提高反应速率,降低焓变,提高平衡转化率 |
您最近一年使用:0次
2024-01-02更新
|
763次组卷
|
6卷引用:山东省高中名校2023-2024学年高三上学期12月统一调研考试化学试题
山东省高中名校2023-2024学年高三上学期12月统一调研考试化学试题山东省名校联考2024届高三上学期模拟预测化学试题(已下线)题型10 反应微观机理分析 速率方程及其应用-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)山东省济宁市第一中学2023-2024学年高三上学期2月期末化学试题河北省石家庄二中教育集团2023-2024学年高二年级上学期期末考试化学试题(已下线)热点04 分子的空间结构
解题方法
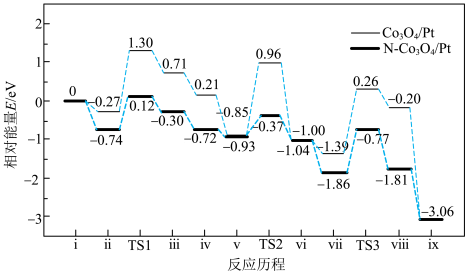
3 . 我国科学家利用两种不同的纳米催化剂(Co3O4/Pt,N-Co3O4/Pt)在室温水汽条件下实现高效CO催化氧化(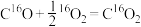 ),其反应历程中相对能量的变化如下图所示(TS1、TS2、TS3分别代表过渡态1、过渡态2、过渡态3)。下列说法错误的是
),其反应历程中相对能量的变化如下图所示(TS1、TS2、TS3分别代表过渡态1、过渡态2、过渡态3)。下列说法错误的是
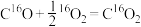 ),其反应历程中相对能量的变化如下图所示(TS1、TS2、TS3分别代表过渡态1、过渡态2、过渡态3)。下列说法错误的是
),其反应历程中相对能量的变化如下图所示(TS1、TS2、TS3分别代表过渡态1、过渡态2、过渡态3)。下列说法错误的是
| A.效果较好的催化剂是N-Co3O4/Pt |
B.若利用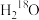 进行同位素标记实验,检测到以上反应中有 进行同位素标记实验,检测到以上反应中有 和 和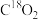 生成,说明O-H键断裂 生成,说明O-H键断裂 |
C.反应: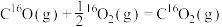 的 的 |
| D.若ⅱ表示H2O被吸附在催化剂表面,则Co3O4/Pt更容易吸附H2O |
您最近一年使用:0次
4 . 一定条件下,丙烯与 反应生成
反应生成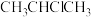 和
和 的反应历程如图所示。下列说法不正确的是
的反应历程如图所示。下列说法不正确的是
 反应生成
反应生成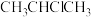 和
和 的反应历程如图所示。下列说法不正确的是
的反应历程如图所示。下列说法不正确的是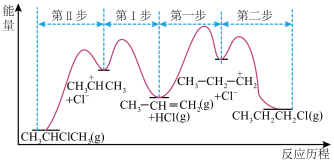
A.合成 的反应中,第一步为反应的决速步 的反应中,第一步为反应的决速步 |
B.其他条件不变,适当升高温度可以提高加成产物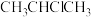 的比例 的比例 |
C.根据该反应推测,丙烯与 加成的主要产物为2-溴丙烷 加成的主要产物为2-溴丙烷 |
D.反应的主要产物为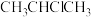 ,是由于活性中间体 ,是由于活性中间体 比 比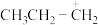 更稳定,所需活化能更低 更稳定,所需活化能更低 |
您最近一年使用:0次
5 . 多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时(各物质均为气态),甲醇与水在铜催化剂上的反应机理和能量图如图:下列说法正确的是
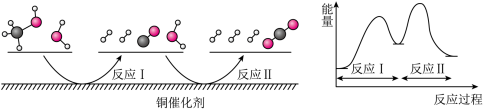

| A.选择优良的催化剂降低反应I和II的活化能,有利于减少过程中的能耗 |
| B.1molCH3OH(g)和1molH2O(g)的总能量大于1molCO2(g)和3molH2(g)的总能量 |
| C.CO(g)在反应中生成又消耗,CO(g)可认为是催化剂 |
| D.反应II的热化学方程式为CO(g)+H2O(g)=H2(g)+CO2(g) ΔH=+akJ/mol(a>0) |
您最近一年使用:0次
名校
6 . 含S2O 、Fe3+、I-的溶液中反应历程如图所示,下列说法正确的是
、Fe3+、I-的溶液中反应历程如图所示,下列说法正确的是
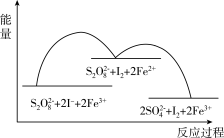
 、Fe3+、I-的溶液中反应历程如图所示,下列说法正确的是
、Fe3+、I-的溶液中反应历程如图所示,下列说法正确的是
| A.该反应为吸热反应 |
B.由图可知氧化性:Fe2+>S2O |
| C.若不加Fe3+,正反应的活化能比逆反应的大 |
D.该反应可表示为S2O (aq)+2I-(aq)=2SO (aq)+2I-(aq)=2SO (aq)+I2(aq) (aq)+I2(aq) |
您最近一年使用:0次
2023-12-28更新
|
149次组卷
|
3卷引用:重庆市巴蜀中学校2023-2024学年高三上学期11月期中化学试题
名校
解题方法
7 . 多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时各物质均为气态),甲醇与水在铜基催化剂上的反应机理和能量图如下:

| A.反应Ⅱ的热化学方程式为:CO(g)+H2O(g)=H2(g)+CO2(g) ΔH=+akJ/mol(a>0) |
| B.1molCH3OH(g)和1molH2O(g)的总能量大于1molCO2(g)和3molH2(g)的总能量 |
| C.选择优良的催化剂降低反应Ⅰ和Ⅱ的活化能,有利于减少过程中的能耗 |
| D.CO(g)在反应中生成又消耗,CO(g)可认为是催化剂 |
您最近一年使用:0次
2023-12-28更新
|
147次组卷
|
5卷引用:北京师范大学附属中学预科部2023-2024学年高三上学期12月月考化学试题
名校
解题方法
8 . 我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
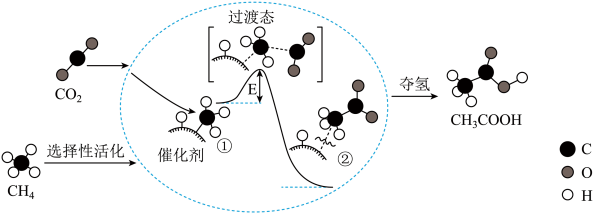
下列说法不正确的是

下列说法不正确的是
| A.CO2分子中,碳原子的杂化方式为sp杂化 |
| B.CH4→CH3COOH过程中,有C-H键发生断裂和O-H的形成 |
| C.①→②吸收能量并形成了C-C键 |
| D.图中的E值,表示该反应的活化能。 |
您最近一年使用:0次
9 .  、
、 、
、 是氢元素的3种核素,基态H原子1s1的核外电子排布,使得H既可以形成H+又可以形成H-,还能形成H2O、H2O2、NH3、N2H4、CaH2等重要化合物;水煤气法、电解水、光催化分解水都能获得H2,如水煤气法制氢反应中,H2O(g)与足量C(s)反应生成1molH2(g)和1molCO(g)吸收131.3kJ的热量。H2在金属冶炼、新能源开发、碳中和等方面具有重要应用,如HCO
是氢元素的3种核素,基态H原子1s1的核外电子排布,使得H既可以形成H+又可以形成H-,还能形成H2O、H2O2、NH3、N2H4、CaH2等重要化合物;水煤气法、电解水、光催化分解水都能获得H2,如水煤气法制氢反应中,H2O(g)与足量C(s)反应生成1molH2(g)和1molCO(g)吸收131.3kJ的热量。H2在金属冶炼、新能源开发、碳中和等方面具有重要应用,如HCO 在催化剂作用下与H2反应可得到HCOO-。我国科学家在氢气的制备和应用等方面都取得了重大成果。下列化学反应表示正确的是
在催化剂作用下与H2反应可得到HCOO-。我国科学家在氢气的制备和应用等方面都取得了重大成果。下列化学反应表示正确的是
 、
、 、
、 是氢元素的3种核素,基态H原子1s1的核外电子排布,使得H既可以形成H+又可以形成H-,还能形成H2O、H2O2、NH3、N2H4、CaH2等重要化合物;水煤气法、电解水、光催化分解水都能获得H2,如水煤气法制氢反应中,H2O(g)与足量C(s)反应生成1molH2(g)和1molCO(g)吸收131.3kJ的热量。H2在金属冶炼、新能源开发、碳中和等方面具有重要应用,如HCO
是氢元素的3种核素,基态H原子1s1的核外电子排布,使得H既可以形成H+又可以形成H-,还能形成H2O、H2O2、NH3、N2H4、CaH2等重要化合物;水煤气法、电解水、光催化分解水都能获得H2,如水煤气法制氢反应中,H2O(g)与足量C(s)反应生成1molH2(g)和1molCO(g)吸收131.3kJ的热量。H2在金属冶炼、新能源开发、碳中和等方面具有重要应用,如HCO 在催化剂作用下与H2反应可得到HCOO-。我国科学家在氢气的制备和应用等方面都取得了重大成果。下列化学反应表示正确的是
在催化剂作用下与H2反应可得到HCOO-。我国科学家在氢气的制备和应用等方面都取得了重大成果。下列化学反应表示正确的是| A.C(s)+H2O(g)=H2(g)+CO(g)中,反应物的总键能小于生成物的总键能 |
B.HCO 催化加氢生成HCOO-的反应:HCO 催化加氢生成HCOO-的反应:HCO +H2 +H2 HCOO-+H2O HCOO-+H2O |
| C.电解水制氢的阳极反应:2H2O+2e-=H2↑+2OH- |
| D.CaH2与水反应:CaH2+2H2O=Ca(OH)2+H2↑ |
您最近一年使用:0次
2023-12-25更新
|
110次组卷
|
2卷引用:江苏省如皋中学2023-2024学年高三上学期阶段考试(二) 化学试题
名校
10 . 合理地利用自然资源,防止环境的污染和破坏,以求自然环境同人文环境、经济环境共同平衡可持续发展,扩大有用资源的再生产,保证社会的发展。
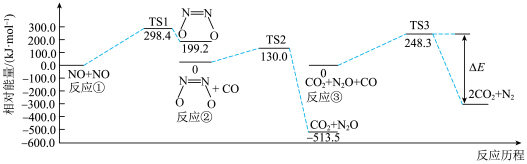
(1)以下反应可有效降低汽车尾气污染物的排放,其反应热 。一定条件下该反应经历三个基元反应阶段,反应历程如图所示(TS表示过渡态)。下列说法正确的是______。
。一定条件下该反应经历三个基元反应阶段,反应历程如图所示(TS表示过渡态)。下列说法正确的是______。
模拟工业上回收“分银渣”中的银,过程如下:
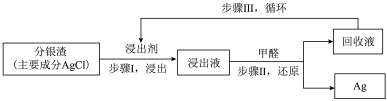
Ⅰ中反应: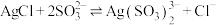 (杂质不反应)
(杂质不反应)
(2)过程Ⅰ中,向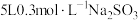 溶液中加入分银渣,10分钟后,固体质量减少了
溶液中加入分银渣,10分钟后,固体质量减少了 ,则反应速率
,则反应速率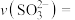
______ 。(忽略溶液体积变化)
(3)其他条件不变,反应I在敞口容器中进行,若反应时间过长反而银的产率降低,银产率降低的可能原因是______ (结合离子方程式解释)。
不同 时,浸出液中
时,浸出液中 的浓度与含硫微粒总浓度的关系如下图所示。
的浓度与含硫微粒总浓度的关系如下图所示。
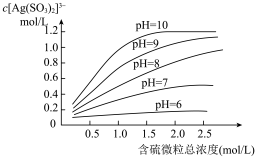
(4) 溶液中微粒浓度的关系正确的是______。
溶液中微粒浓度的关系正确的是______。
(5)将亚硫酸钠溶液酸化至 ,此时溶液中
,此时溶液中 ______
______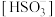 。
。
(6) 时,解释
时,解释 浓度随含硫微粒总浓度变化趋势的原因
浓度随含硫微粒总浓度变化趋势的原因______ 。 时,
时, 浓度随含硫微粒总浓度的变化与
浓度随含硫微粒总浓度的变化与 时不同,可能的原因是
时不同,可能的原因是______ 。
(7)将Ⅱ中反应的离子方程式补充完整______ 。

(8)Ⅲ中回收液可直接循环使用,但循环多次后,银浸出率降低。从回收液离子浓度变化和平衡移动的角度分析原因:______ 。
(1)以下反应可有效降低汽车尾气污染物的排放,其反应热
 。一定条件下该反应经历三个基元反应阶段,反应历程如图所示(TS表示过渡态)。下列说法正确的是______。
。一定条件下该反应经历三个基元反应阶段,反应历程如图所示(TS表示过渡态)。下列说法正确的是______。
A. |
| B.三个基元反应中只有③是放热反应 |
| C.该化学反应的速率主要由反应②决定 |
D.该过程的总反应为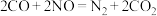 |
模拟工业上回收“分银渣”中的银,过程如下:

Ⅰ中反应:
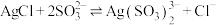 (杂质不反应)
(杂质不反应)(2)过程Ⅰ中,向
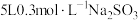 溶液中加入分银渣,10分钟后,固体质量减少了
溶液中加入分银渣,10分钟后,固体质量减少了 ,则反应速率
,则反应速率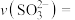
(3)其他条件不变,反应I在敞口容器中进行,若反应时间过长反而银的产率降低,银产率降低的可能原因是
不同
 时,浸出液中
时,浸出液中 的浓度与含硫微粒总浓度的关系如下图所示。
的浓度与含硫微粒总浓度的关系如下图所示。
(4)
 溶液中微粒浓度的关系正确的是______。
溶液中微粒浓度的关系正确的是______。A.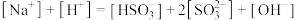 |
B. |
C.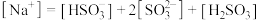 |
D. |
(5)将亚硫酸钠溶液酸化至
 ,此时溶液中
,此时溶液中 ______
______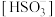 。
。| A.大于 | B.等于 | C.小于 | D.无法确定 |
(6)
 时,解释
时,解释 浓度随含硫微粒总浓度变化趋势的原因
浓度随含硫微粒总浓度变化趋势的原因 时,
时, 浓度随含硫微粒总浓度的变化与
浓度随含硫微粒总浓度的变化与 时不同,可能的原因是
时不同,可能的原因是(7)将Ⅱ中反应的离子方程式补充完整

(8)Ⅲ中回收液可直接循环使用,但循环多次后,银浸出率降低。从回收液离子浓度变化和平衡移动的角度分析原因:
您最近一年使用:0次



