1 . 拟用如图装置设计实验来探究纯净、干燥的氯气与氨气的反应。___________ 。
(2)如图中的装置连接顺序为A→___________ (用大写字母表示)。若按照正确顺序连接实验装置后,整套实验装置存在的主要缺点___________ 。
(3)写出F装置中的反应的一种工业用途:___________ 。
(4)在工业上利用反应N2+3H2 2NH3制备氨气。现在实验室模拟该反应探究影响反应速率的因素,在四个相同的容器中,在不同的温度下(其他条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是
2NH3制备氨气。现在实验室模拟该反应探究影响反应速率的因素,在四个相同的容器中,在不同的温度下(其他条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是___________ (填字母)。
A.v(NH3)=0.1mol/(L·min) B.v(H2)=0.6mol/(L·min) C.v(N2)=0.3mol/(L·min)

(2)如图中的装置连接顺序为A→
(3)写出F装置中的反应的一种工业用途:
(4)在工业上利用反应N2+3H2
 2NH3制备氨气。现在实验室模拟该反应探究影响反应速率的因素,在四个相同的容器中,在不同的温度下(其他条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是
2NH3制备氨气。现在实验室模拟该反应探究影响反应速率的因素,在四个相同的容器中,在不同的温度下(其他条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是A.v(NH3)=0.1mol/(L·min) B.v(H2)=0.6mol/(L·min) C.v(N2)=0.3mol/(L·min)
您最近一年使用:0次
名校
解题方法
2 . 氨的用途十分广泛,如氨是制造硝酸和氮肥的重要原科。工业合成氨是人类科学技术的一项重大突破。回答下列问题:
(1)合成氨反应的历程和能量的变化如图所示,符号“·”可视为催化剂。________  。
。
(2)在不同条件下进行合成氨反应,下列反应速率由大到小的顺序是______ (填选项序号)。
①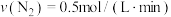 ②
②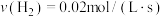
③ ④
④
(3)对于合成氨反应而言,只控制一个变量,下列图像合理的是___________(填选项字母)。
(4)一定温度下,向 恒容密闭容器中充入
恒容密闭容器中充入 、
、 发生反应,
发生反应, 的浓度随时间变化情况如表所示:
的浓度随时间变化情况如表所示:
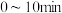 内,用
内,用 表示的平均反应速率为
表示的平均反应速率为_______ ;平衡常数
______ (结果保留一位小数);若维持温度不变,向另一 恒容密闭容器中充入
恒容密闭容器中充入 、
、 和
和 各
各 时,该反应的
时,该反应的
_____ (填 “>”“<”或“=”) 。
。
(1)合成氨反应的历程和能量的变化如图所示,符号“·”可视为催化剂。

 。
。(2)在不同条件下进行合成氨反应,下列反应速率由大到小的顺序是
①
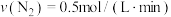 ②
②
③
 ④
④
(3)对于合成氨反应而言,只控制一个变量,下列图像合理的是___________(填选项字母)。
A. | B. |
C. | D. |
(4)一定温度下,向
 恒容密闭容器中充入
恒容密闭容器中充入 、
、 发生反应,
发生反应, 的浓度随时间变化情况如表所示:
的浓度随时间变化情况如表所示:| 时间/min | 5 | 10 | 15 | 20 | 25 |
浓度/ | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 |
 内,用
内,用 表示的平均反应速率为
表示的平均反应速率为
 恒容密闭容器中充入
恒容密闭容器中充入 、
、 和
和 各
各 时,该反应的
时,该反应的
 。
。
您最近一年使用:0次
名校
3 . 甲醇 是一种重要的化工原料,在生产生活中有重要用途。现在2L的恒容密闭容器中充入
是一种重要的化工原料,在生产生活中有重要用途。现在2L的恒容密闭容器中充入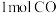 和
和 ,一定条件下发生反应:
,一定条件下发生反应: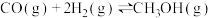 。测得CO和
。测得CO和 的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
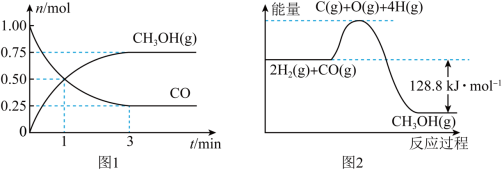
(1)从反应开始至达到平衡,以 表示的反应的平均反应速率
表示的反应的平均反应速率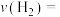
___________ ;下列措施能增大反应速率的是___________ 。
A.升高温度 B.降低压强 C.减小 的浓度 D.加入合适的催化剂
的浓度 D.加入合适的催化剂
(2)反应达到平衡状态时 的转化率为
的转化率为___________ 。
(3)在相同条件下,若向该密闭容器中充入 与
与 ,二者充分反应后,根据反应的特点推测,能够
,二者充分反应后,根据反应的特点推测,能够___________ (填放出或吸收)的热量___________ (填“>”“<”或“=”)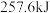 。
。
 是一种重要的化工原料,在生产生活中有重要用途。现在2L的恒容密闭容器中充入
是一种重要的化工原料,在生产生活中有重要用途。现在2L的恒容密闭容器中充入 和
和 ,一定条件下发生反应:
,一定条件下发生反应: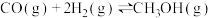 。测得CO和
。测得CO和 的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
(1)从反应开始至达到平衡,以
 表示的反应的平均反应速率
表示的反应的平均反应速率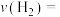
A.升高温度 B.降低压强 C.减小
 的浓度 D.加入合适的催化剂
的浓度 D.加入合适的催化剂(2)反应达到平衡状态时
 的转化率为
的转化率为(3)在相同条件下,若向该密闭容器中充入
 与
与 ,二者充分反应后,根据反应的特点推测,能够
,二者充分反应后,根据反应的特点推测,能够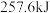 。
。
您最近一年使用:0次
2023-05-11更新
|
498次组卷
|
3卷引用:吉林省延边第二中学2022-2023学年高一下学期5月期中考试化学试题
4 . 氨气是一种重要的化工产品,有广泛用途,工业上可由氢气和氮气合成氨气。回答下列问题:
(1)已知:
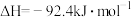 ,该反应过程中的能量变化如图1所示。
,该反应过程中的能量变化如图1所示。

正反应的活化能 (正)=
(正)=___________  。
。
(2)恒温下,将一定量 、
、 置于10 L密闭容器中发生上述反应,反应过程中各物质的浓度随时间的变化情况如图2.则0~10 min内的反应速率。
置于10 L密闭容器中发生上述反应,反应过程中各物质的浓度随时间的变化情况如图2.则0~10 min内的反应速率。
___________ 。

(3)若用 、
、 、
、 、
、 分别表示
分别表示 、
、 ,
, 和固体Fe催化剂,则在固体催化剂表面合成氨的过程如图3所示:
和固体Fe催化剂,则在固体催化剂表面合成氨的过程如图3所示:

①吸附后,能量状态最低的是___________ (填序号)。
②结合上述原理,在固体Fe催化剂表面进行 的分解实验,发现
的分解实验,发现 的分解速率与其浓度的关系如图4所示。从吸附和解吸过程分析,
的分解速率与其浓度的关系如图4所示。从吸附和解吸过程分析, 之前反应速率增加的原因可能是
之前反应速率增加的原因可能是___________ ; 之后反应速率降低的原因可能是
之后反应速率降低的原因可能是___________ 。

(4)研究表明,合成氨的速率与相关物质的浓度的关系为 ,
, 为速率常数。能使合成氨的速率增大的措施有
为速率常数。能使合成氨的速率增大的措施有___________ (填序号)。
A.使用更有效的催化剂
B.总压强一定,增大 的值
的值
C.升高温度
D.按照原来比值增大反应物的浓度
(1)已知:

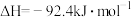 ,该反应过程中的能量变化如图1所示。
,该反应过程中的能量变化如图1所示。
正反应的活化能
 (正)=
(正)= 。
。(2)恒温下,将一定量
 、
、 置于10 L密闭容器中发生上述反应,反应过程中各物质的浓度随时间的变化情况如图2.则0~10 min内的反应速率。
置于10 L密闭容器中发生上述反应,反应过程中各物质的浓度随时间的变化情况如图2.则0~10 min内的反应速率。

(3)若用
 、
、 、
、 、
、 分别表示
分别表示 、
、 ,
, 和固体Fe催化剂,则在固体催化剂表面合成氨的过程如图3所示:
和固体Fe催化剂,则在固体催化剂表面合成氨的过程如图3所示:
①吸附后,能量状态最低的是
②结合上述原理,在固体Fe催化剂表面进行
 的分解实验,发现
的分解实验,发现 的分解速率与其浓度的关系如图4所示。从吸附和解吸过程分析,
的分解速率与其浓度的关系如图4所示。从吸附和解吸过程分析, 之前反应速率增加的原因可能是
之前反应速率增加的原因可能是 之后反应速率降低的原因可能是
之后反应速率降低的原因可能是
(4)研究表明,合成氨的速率与相关物质的浓度的关系为
 ,
, 为速率常数。能使合成氨的速率增大的措施有
为速率常数。能使合成氨的速率增大的措施有A.使用更有效的催化剂
B.总压强一定,增大
 的值
的值C.升高温度
D.按照原来比值增大反应物的浓度
您最近一年使用:0次
5 . 氨气具有广泛用途,工业上利用反应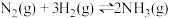
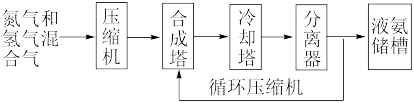
 合成氨,其基本合成过程如下:
合成氨,其基本合成过程如下:
(1)某小组为了探究外界条件对反应的影响,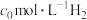 参加合成氨的反应,在
参加合成氨的反应,在 、
、 两种条件下分别达到平衡,测得
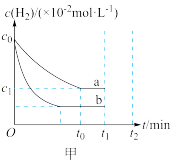
两种条件下分别达到平衡,测得 的浓度与反应时间的关系如图甲所示。请回答下列问题:
的浓度与反应时间的关系如图甲所示。请回答下列问题:
① 条件下,
条件下,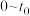 的平均反应速率
的平均反应速率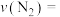
________  。
。
②相对 而言,
而言, 可能改变的条件是
可能改变的条件是________________ 。
③在 条件下,
条件下, 时刻将容器容积压缩至原来的
时刻将容器容积压缩至原来的 ,
, 时刻重新建立平衡状态。请在图中画出
时刻重新建立平衡状态。请在图中画出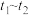 时刻
时刻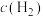 的变化曲线
的变化曲线________________ 。
(2)某小组往一恒温恒压容器中充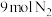 和
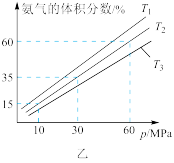
和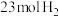 ,模拟合成氨的反应,图乙为不同温度下平衡混合物中氨气的体积分数与总压强(
,模拟合成氨的反应,图乙为不同温度下平衡混合物中氨气的体积分数与总压强( )的关系图。若体系在
)的关系图。若体系在 、
、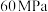 下达到平衡。
下达到平衡。
①此时 的平衡分压为
的平衡分压为________ MPa, 的平衡分压为
的平衡分压为________ MPa。(分压 总压
总压 物质的量分数)
物质的量分数)
②列式计算此时的平衡常数
________ 。(用平衡分压代替平衡浓度计算,结果保留2位有效数字)
(3)分离器中的过程对整个工业合成氨的意义是________________________ 。
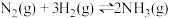
 合成氨,其基本合成过程如下:
合成氨,其基本合成过程如下:
(1)某小组为了探究外界条件对反应的影响,
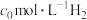 参加合成氨的反应,在
参加合成氨的反应,在 、
、 两种条件下分别达到平衡,测得
两种条件下分别达到平衡,测得 的浓度与反应时间的关系如图甲所示。请回答下列问题:
的浓度与反应时间的关系如图甲所示。请回答下列问题:①
 条件下,
条件下,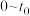 的平均反应速率
的平均反应速率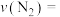
 。
。②相对
 而言,
而言, 可能改变的条件是
可能改变的条件是③在
 条件下,
条件下, 时刻将容器容积压缩至原来的
时刻将容器容积压缩至原来的 ,
, 时刻重新建立平衡状态。请在图中画出
时刻重新建立平衡状态。请在图中画出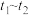 时刻
时刻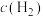 的变化曲线
的变化曲线

(2)某小组往一恒温恒压容器中充
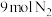 和
和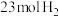 ,模拟合成氨的反应,图乙为不同温度下平衡混合物中氨气的体积分数与总压强(
,模拟合成氨的反应,图乙为不同温度下平衡混合物中氨气的体积分数与总压强( )的关系图。若体系在
)的关系图。若体系在 、
、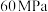 下达到平衡。
下达到平衡。①此时
 的平衡分压为
的平衡分压为 的平衡分压为
的平衡分压为 总压
总压 物质的量分数)
物质的量分数)②列式计算此时的平衡常数

(3)分离器中的过程对整个工业合成氨的意义是
您最近一年使用:0次
2020-09-13更新
|
872次组卷
|
6卷引用:广东省广东实验中学2017-2018学年高二上学期期中考试化学试题
广东省广东实验中学2017-2018学年高二上学期期中考试化学试题(已下线)黄金30题系列 高二化学(选修4) 大题好拿分【提升版】鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2节 化学反应的限度 课时1 化学平衡常数 平衡转化率高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时2 化学平衡常数选择性必修1 专题2 第三单元 课时2 化学平衡常数的应用(已下线)化学反应速率与化学平衡——课时4化学平衡常数
名校
解题方法
6 . 碘及其化合物在合成杀菌剂、药物方面具有广泛用途。H2(g)+I2(g) 2HI(g)在1 L的恒温容器中进行,反应过程中部分数据见下表:
2HI(g)在1 L的恒温容器中进行,反应过程中部分数据见下表:
若在起始时总压为p0 kPa,反应速率若用单位时间内分压的变化表示,而气态物质分压=总压×气态物质的物质的量分数,则10 min内H2(g)的反应速率为( )
 2HI(g)在1 L的恒温容器中进行,反应过程中部分数据见下表:
2HI(g)在1 L的恒温容器中进行,反应过程中部分数据见下表:| 反应时间/min | H2(g)/mol | I2(g)/mol | HI(g)/mol |
| 0 | 4 | 4 | 0 |
| 5 | 2.5 | ||
| 10 | 2 |
| A.0.25p0 kPa·min-1 | B.0.025p0 kPa·min-1 |
| C.0.005p0 kPa·min-1 | D.0.016p0 kPa·min-1 |
您最近一年使用:0次
2020-10-24更新
|
302次组卷
|
4卷引用:河北省邢台市巨鹿中学2020-2021学年高二上学期第一次月考化学试题
河北省邢台市巨鹿中学2020-2021学年高二上学期第一次月考化学试题(已下线)练习4 化学反应速率-2020-2021学年【补习教材·寒假作业】高二化学(人教版)河北省巨鹿中学2020-2021学年高二下学期第一次月考化学试题作业(四) 化学反应速率
名校
7 . 碳酸二甲酯【CO(OCH3)2】是一种无毒、环保性能优异、用途广泛的化工原料。在催化剂作用下,可由甲醇和CO2直接合成:CO2+2CH3OH→CO(OCH3)2+H2O。某研究小组在某温度下,在0.1L恒容密闭容器中投入2.5 mol CH3OH(g)、适量CO2和6×10-5mol催化剂,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如图所示。计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量。下列说法不正确的是


| A.在该温度下,最佳反应时间是10h |
| B.4~10h内碳酸二甲酯的平均反应速率是7.5×10-4mol·L-1·h-1 |
| C.向反应体系中添加催化剂,一定能提高反应的TON |
| D.该合成方法可以利用廉价的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面具有重要意义 |
您最近一年使用:0次
2019-02-05更新
|
567次组卷
|
4卷引用:【全国百强校】浙江省嘉兴市第一中学2019届高三上学期期末考试化学试题
【全国百强校】浙江省嘉兴市第一中学2019届高三上学期期末考试化学试题(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP409】【化学】(已下线)【浙江新东方】99(鲁科版2019)必修第二册 第2章 化学键 化学反应规律 第3节 化学反应的快慢和限度 第1课时 化学反应的快慢



