名校
解题方法
1 . 下列实验设计或装置能达到实验目的的是
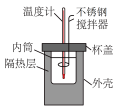 | 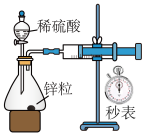 |  |  |
| A.测定中和反应反应热 | B.测定锌与稀硫酸的反应速率 | C.分离乙酸乙酯和碳酸钠溶液 | D.温度计显示温度升高,证明该反应是放热反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-10-28更新
|
474次组卷
|
4卷引用:新疆兵团地州学校2023-2024学年高二上学期期中联考化学试题
名校
2 . 可逆反应A(g)+4B(g)⇌C(g)+D(s),在四种不同情况下的反应速率如下,其中反应进行得最快的是
| A.v(A)=0.15mol/(L·min) | B.v(B)=0.02mol/(L·s) |
| C.v(C)=0.4mol/(L·min) | D.v(D)=0.01mol/(L·s) |
您最近一年使用:0次
2023-05-19更新
|
634次组卷
|
3卷引用:新疆生产建设兵团第二师八一中学2023-2024学年高二上学期开学考试化学试题
10-11高二上·江苏南通·期中
名校
解题方法
3 . 为比较Fe3+和Cu2+对H2O2分解反应的催化效果,两位同学分别设计了如图甲、乙所示的实验。下列叙述不正确的是
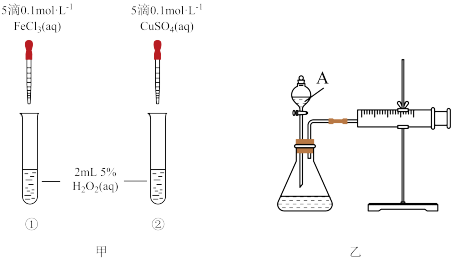

| A.图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小 |
| B.若图甲中所示实验反应速率为①>②,则说明Fe3+一定比Cu2+对H2O2分解的催化效果好 |
| C.用图乙所示装置测定反应速率,可测定产生的一定体积气体所需要的时间 |
| D.为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 |
您最近一年使用:0次
2022-11-02更新
|
147次组卷
|
85卷引用:新疆乌鲁木齐市林肯外国语培训学校、第十二中学2021-2022学年高一下学期期中考试化学试题
新疆乌鲁木齐市林肯外国语培训学校、第十二中学2021-2022学年高一下学期期中考试化学试题新疆实验中学2023-2024学年高二上学期期中考试化学试题(已下线)2010年江苏省启东中学高二上学期期中考试化学卷(已下线)2010-2011学年江苏省启东中学高二上学期期中考试化学试题(理)2016届黑龙江省大庆实验中学高三上学期12月月考化学试卷2015-2016学年辽宁鞍山一中高一下期中化学试卷2015-2016学年浙江宁波效实中学高二下期中化学试卷2015-2016学年河北武邑中学高一下5.15周考化学试卷2015-2016学年湖南省娄底市双峰县高一下期中化学试卷2016-2017学年山东省烟台第二中学高二下学期开学考试化学试卷四川省南充高级中学2016-2017学年高一下学期期末考试化学试题甘肃省兰州第一中学2017-2018学年高二上学期第一次月考(9月)化学试题安徽省淮北市第一中学2017-2018学年高二上学期第四次月考(12月)化学试题四川省三台中学实验学校2017-2018学年高一下学期期末仿真模拟(二)化学试题安徽省定远重点中学2018-2019学年高二上学期第三次月考化学试题(已下线)2019年3月31日 《每日一题》 必修2 每周一测黑龙江省大庆中学2018-2019学年高一下学期期末考试化学试题四川省棠湖中学2018-2019学年高一下学期期末考试化学试题安徽省滁州市定远县育才学校2019-2020学年高二上学期入学考试化学试题贵州省贵阳市第二中学高一下学期期末考试化学试题辽宁省六校协作体2019-2020学年高二上学期10月月考化学试题广东省广州市第16中学2019-2020学年高二上学期期中考试化学试题2020届高三化学二轮冲刺新题专练——气体制取流程的规范操作(提升练)2020届高三化学实验复习——气密性的检查【选择突破】四川省棠湖中学2019-2020学年高一下学期第二次月考化学试题第二章 化学反应与能量 第三节 化学反应的速率和限度安徽省阜阳市2019-2020学年高一下学期开学考化学试题吉林省辽源市田家炳高级中学2019-2020学年高一下学期期中考试化学试题安徽省定远县育才学校2019-2020学年高一6月月考化学试题(已下线)第15讲 化学反应速率-2021年高考化学一轮复习名师精讲练(已下线)2.1.2 影响化学反应速率的因素(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)(已下线)2.1.2 影响化学反应速率的因素(重点练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)安徽省定远县育才学校2020-2021学年高二上学期开学考试化学试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第3节 化学反应的速率 课时2 影响化学反应速率的因素鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第3节 化学反应的速率高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第一节 化学反应速率 课时2 影响化学反应速率的因素山东省潍坊市临朐县实验中学2020-2021学年高二9月月考化学试题(已下线)易错11 影响化学反应速率的因素-备战2021年高考化学一轮复习易错题湖北省随州市曾都一中2020-2021学年高二上学期9月月考化学试题必修第二册RJ高效学习手册-第六章山西省长治市第二中学校2020-2021学年高二上学期第一次月考化学试题黑龙江省齐齐哈尔市第八中学2020-2021学年高二上学期期中考试化学试题黑龙江省哈尔滨市第六中学2020-2021学年高二10月月考化学试题四川省成都新津为明学校2020-2021学年高二上学期期中测试化学试题黑龙江省大庆中学2020-2021学年高二上学期期中考试化学试题安徽省桐城中学2020-2021学年高一上学期12月月考化学试题山西省吕梁市2020-2021学年高二上学期期末考试化学试题河北省张家口市宣化一中2020-2021学年高一下学期期初考试化学试题浙江省丽水市高中发展共同体2020-2021学年高二下学期期中联合测试化学试题福建省三明市三地三校2020-2021学年高一下学期期中联考化学试题2018年广东和广西高中学生化学竞赛试题选择性必修1 专题2 第一单元 课时2 影响化学反应速率的因素河北省任丘一中2021-2022学年高二上学期阶段考试(一)化学试题(已下线)专题21 化学反应速率(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练甘肃省庆阳市第六中学2021-2022学年高二上学期第一次月考化学(理)试题山西省长治市第二中学校2021-2022学年高二上学期第一次月考化学试题陕西省西安市长安区第一中学2017-2018学年高二上学期第四次教学质量检测化学试题北京市石景山区第九中学2021-2022学年高二上学期期中考试化学试题(已下线)专题13 装置气密性的检查方法-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)湖北省武汉市部分普通高中联合体2021-2022学年高一下学期期中联考化学试题河南省南阳市第一中学校2021-2022学年高一下学期第三次月考化学试题四川省泸州市泸县第四中学2021-2022学年高一下学期期中考试化学试题湖南省长沙市实验中学2021-2022学年高一下学期期中考试化学试题甘肃省天水市秦安县第一中学2021-2022学年高一下学期期中考试化学试题 吉林省长春市东北师范大学附属中学2021-2022学年高一下学期期中考试化学试题宁夏石嘴山市平罗中学2021-2022学年高一下学期期中考试化学试题广东省珠海市三校2021-2022学年高一下学期期中联考化学试题河南省实验中学2021-2022学年高一下学期期期中考试化学试题辽宁省营口市第二高级中学2021-2022学年高一6月月考化学试题宁夏永宁县永宁中学2021-2022学年高二上学期期中考试化学试题(已下线)2.3.3 化学反应速率综合分析-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修1)湖北省襄阳市第五中学2022-2023学年高二上学期9月化学试题福建省福州市第三中学2022-2023学年高一上学期10月月考化学试题黑龙江省佳木斯市第十二中学(佳木斯市建三江第一中学)2021-2022学年高一下学期期中考试化学试题广东省化州市第一中学2020-2021学年高二上学期10月月考化学试题甘肃省礼县第一中学2020-2021学年高一上学期期中测试化学试题福建省南平市浦城第一中学2022-2023学年高一下学期期中考试化学试题福建省南平市浦城县2022-2023学年高一下学期期中考试化学试题浙江省温州市环大罗山联盟2022-2023学年高二上学期11月期中考试化学试题作业(十四) 外界条件对化学反应速率的影响四川省南充高级中学2021-2022学年高一下学期第二次月考化学试题浙江省温州十校联合体2023-2024学年高二上学期期中考试化学试题江苏省苏州市吴江市高级中学2023-2024学年高二上学期10月月考化学试题湖北省武汉市新洲区第一中学2024届高二上学期期末联考化学试题湖北省武汉市新洲区第一中学2024届高二上学期11月阶段测试化学试题
名校
解题方法
4 . 下列说法正确的是
| A.强碱滴定弱酸应选用甲基橙为指示剂 |
B.闪光光解技术的时间分辨率达到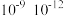 s,主要用于化学平衡问题的研究 s,主要用于化学平衡问题的研究 |
| C.用比色法可以测定化学反应速率 |
| D.化学反应的反应热均可通过实验直接测定 |
您最近一年使用:0次
2021-11-18更新
|
111次组卷
|
2卷引用:新疆乌鲁木齐市第六十八中学2023-2024学年高三下学期2月月考化学试题
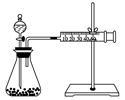
5 . (1)50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:____ 。
②大烧杯上如不盖硬纸板,求得的中和热数值____ (填“偏大”、“偏小”或“无影响”)。
③实验中改用60mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行反应,与上述实验相比,所放出的热量___ (填“相等”或“不相等”)。
④用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会____ (填“偏大””、“偏小””或“无影响”)。
(2)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
①催化剂能增大化学反应速率的原因是___ 。
②实验①和②的目的是探究___ 对反应速率的影响。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是___ 。
③实验③④⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论:___ 环境能增大H2O2分解的速率;
b.___ 环境能减小H2O2分解的速率。
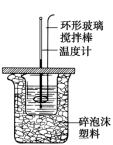
②大烧杯上如不盖硬纸板,求得的中和热数值
③实验中改用60mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行反应,与上述实验相比,所放出的热量
④用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会
(2)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 分组实验 | 催化剂 | |
| ① | 10mL5%H2O2溶液 | 无 |
| ② | 10mL2%H2O2溶液 | 无 |
| ③ | 10mL5%H2O2溶液 | 1mL0.1mol·L-1FeCl3溶液 |
| ④ | 10mL5%H2O2溶液+少量稀盐酸 | 1mL0.1mol·L-1FeCl3溶液 |
| ⑤ | 10mL5%H2O2溶液+少量NaOH溶液 | 1mL0.1mol·L-1FeCl3溶液 |
②实验①和②的目的是探究
③实验③④⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论:
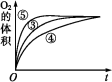
b.
您最近一年使用:0次
2021-05-24更新
|
176次组卷
|
2卷引用:新疆兵团第三师图木舒克市鸿德实验学校2023-2024学年高二上学期第一次月考化学试题
名校
6 . 某小组探究实验条件对反应速率的影响,设计如下实验,并记录结果如下,下列说法正确的是
| 编号 | 温度 |  溶液 溶液 |  溶液 溶液 |  淀粉溶液体积 淀粉溶液体积 | 出现蓝色时间 |
| ① |  |  |  |  |  |
| ② |  |  |  |  | 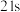 |
| ③ |  |  |  |  | 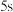 |
| ④ |  |  |  |  | 未见蓝色 |
A.由实验①②可知,反应速率 与 与 成正比 成正比 |
| B.由实验②③可知,对速率的影响程度上,浓度大于温度 |
C. 在被 在被 氧化过程中, 氧化过程中, 只是降低活化能 只是降低活化能 |
| D.由实验③④可知,温度越高,反应速率越慢 |
您最近一年使用:0次
2021-03-11更新
|
462次组卷
|
5卷引用:新疆维吾尔自治区2021届高三下学期诊断性自测(第一次)化学试题
新疆维吾尔自治区2021届高三下学期诊断性自测(第一次)化学试题(已下线)2021年秋季高三化学开学摸底考试卷02(山东专用)湖南省长沙市长郡中学2021-2022学年高二上学期第一次月考化学试题(已下线)专题21 化学反应速率(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练山东省栖霞市第一中学2021-2022学年高三上学期开学摸底考试化学试题
名校
7 . 下列方案设计不能达到实验目的的是
| A | B | C | D |
| 测定硫酸与锌反应的化学反应速率 | 由球中气体颜色的深浅判断温度对平衡的影响 | 由褪色快慢研究反应物浓度对反应速率的影响 | 探究醋酸、碳酸、硼酸的酸性相对强弱 |
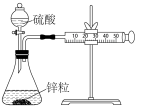 | 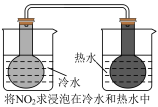 |  | 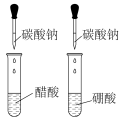 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-11-16更新
|
601次组卷
|
7卷引用:新疆阿勒泰地区2020-2021学年高二上学期期末考试化学试题
名校
8 . 控制变量思想在探究实验中有重要应用,下列实验对影响化学反应速率的因素进行探究。
Ⅰ.催化剂对速率的影响
探究Fe3+和Cu2+对H2O2分解的催化效果:在两支试管中各加入2 mL 5%的H2O2溶液,再向其中分别滴入1 mL浓度均为0.1 mol·L-1 的FeCl3溶液和CuSO4溶液。
(1)H2O2分解的化学方程式是_____ 。
(2)有同学建议将CuSO4改为CuCl2溶液,理由是______ ;还有同学认为即使改用了 CuCl2溶液,仍不严谨,建议补做对比实验:向2 mL 5%的H2O2溶液中滴入的试剂及其用量是____ 。
Ⅱ.浓度对速率的影响
实验方案:混合试剂1和试剂2,记录溶液褪色所需的时间。
(3)配平下列化学方程式:
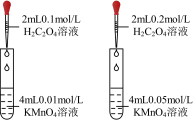
____ KMnO4+____ H2C2O4+____ =____ K2SO4+____ MnSO4+____ CO2↑+____ H2O
(4)实验1中t min 时溶液褪色,用草酸表示的反应速率v(H2C2O4)=___ mol·L-1· min-1。
联系实验1、2,预期结论是_________ 。
(5)n(CO2)随时间的变化如下图1所示,其变化的原因是________ 。

(6)研究发现KMnO4溶液的酸化程度对反应的速率也有较大影响,用不同浓度的硫酸进行酸化,其余条件均相同时,测得反应溶液的透光率(溶液颜色越浅,透光率越高)随时间变化如图2所示,由此得出的结论是_______ 。
Ⅰ.催化剂对速率的影响
探究Fe3+和Cu2+对H2O2分解的催化效果:在两支试管中各加入2 mL 5%的H2O2溶液,再向其中分别滴入1 mL浓度均为0.1 mol·L-1 的FeCl3溶液和CuSO4溶液。
(1)H2O2分解的化学方程式是
(2)有同学建议将CuSO4改为CuCl2溶液,理由是
Ⅱ.浓度对速率的影响
实验方案:混合试剂1和试剂2,记录溶液褪色所需的时间。
| 实验1 | 实验2 | |
| 试剂1 | 2 mL 0.1mol·L-1的草酸溶液 | 2 mL 0.2mol·L-1的草酸溶液 |
| 试剂2 | 4 mL 0.01 mol·L-1的高锰酸钾酸性溶液 | 4 mL 0.01 mol·L-1的高锰酸钾酸性溶液 |
(3)配平下列化学方程式:
(4)实验1中t min 时溶液褪色,用草酸表示的反应速率v(H2C2O4)=
联系实验1、2,预期结论是
(5)n(CO2)随时间的变化如下图1所示,其变化的原因是

(6)研究发现KMnO4溶液的酸化程度对反应的速率也有较大影响,用不同浓度的硫酸进行酸化,其余条件均相同时,测得反应溶液的透光率(溶液颜色越浅,透光率越高)随时间变化如图2所示,由此得出的结论是
您最近一年使用:0次
2020-11-16更新
|
374次组卷
|
3卷引用:新疆生产建设兵团第十师北屯高级中学2021-2022学年高二上学期期中考试化学试题
名校
9 . 用下列装置进行实验,能达到相应实验目的的是
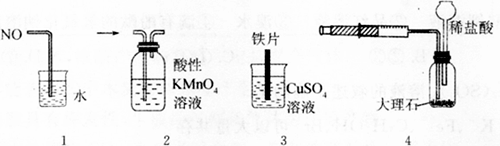

| A.图1可用于吸收多余的NO |
| B.图2可用于检验Cl2的漂白性 |
| C.图3可用于比较Fe与Cu的金属活动性强弱 |
| D.图4可用于测定CO2的生成速率 |
您最近一年使用:0次
2017-06-30更新
|
391次组卷
|
6卷引用:新疆阿克苏市农一师中学2018届高三上学期第二次月考化学试题
10-11高一下·辽宁·期中
名校
10 . 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
(1)该同学的实验目的是________________________ ;要得出正确的实验结论,还需控制的实验条件是________________________________________ 。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用上图装置进行定量实验。完成该实验应选用的实验药品是____________________________ ;应该测定的实验数据是________________________________________________________________________ 。
实验二:已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是________ 的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是________ 。
A.硫酸钾 B.硫酸锰
C.氯化锰 D.水
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2 mol·L-1硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 | 反应快慢:Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快 |

(1)该同学的实验目的是
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用上图装置进行定量实验。完成该实验应选用的实验药品是
实验二:已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是
A.硫酸钾 B.硫酸锰
C.氯化锰 D.水
您最近一年使用:0次
2016-12-09更新
|
1012次组卷
|
6卷引用:2012-2013学年新疆乌鲁木齐市一中高一(平行班)下学期期中考试化学试卷
(已下线)2012-2013学年新疆乌鲁木齐市一中高一(平行班)下学期期中考试化学试卷(已下线)2013届新疆乌鲁木齐市一中高一下学期平行班期中考试化学试卷(已下线)2010-2011学年辽宁省师大附中高一下学期期中考试化学试卷(已下线)2011-2012学年湖北省武汉市五校高二上学期期中统考化学试卷(已下线)2012年鲁科版高中化学选修6 2反应条件对化学反应的影响练习卷安徽省合肥市第十一中学2020-2021学年高二上学期第一次月考化学试题



