名校
解题方法
1 . 某校化学小组探究酸性KMnO4溶液与H2O2溶液反应速率的影响因素。
(1)甲进行了实验I:常温下,向4mL不同浓度的H2O2溶液中滴入一滴0.04mL0.05mol/LKMnO4溶液[c(H+)=5.0mol/L],记录如下:
①请写出反应的离子方程式_______ 。
②对于c(H2O2)增大引起的速率异常现象,根据上述实验结果,甲排除了一种可能,请用化学方程式表示这种可能性_______ 。
③为了解释c(H2O2)增大到一定浓度后速率减小,乙查得了如下资料:
资料显示:c(H2O2)>0.02mol,H2O2溶液中存在平衡:2H2O2⇌H4O4
请用平衡移动原理解释c(H2O2)=0.0312mol/L速率忽然减小的原因_______ 。
(2)乙继续进行实验II,并记录如下:
①对于第10滴溶液与H2O2溶液反应速率剧烈变化的原因,乙提出如下假设:_______ 。
②乙设计实验方案证实了上述假设合理,请补全他的方案:
(3)综合上述实验,对于酸性KMnO4溶液与H2O2溶液反应速率,丙进行了总结。下列因素一定能加快反应速率的是_______ 。
a.增大KMnO4溶液浓度 b.增大H2O2溶液浓度 c.增大H2SO4浓度
d.加热适当温度 e.加入合适的催化剂
(1)甲进行了实验I:常温下,向4mL不同浓度的H2O2溶液中滴入一滴0.04mL0.05mol/LKMnO4溶液[c(H+)=5.0mol/L],记录如下:
| c(H2O2)/mol/L | 0.0010 | 0.0015 | 0.0125 | 0.0312 | 0.044 | 0.0620 |
| 完全褪色时间/s | 25 | 15 | 12 | 23 | 60 | 370 |
| 无色气泡 | 一样多 | |||||
②对于c(H2O2)增大引起的速率异常现象,根据上述实验结果,甲排除了一种可能,请用化学方程式表示这种可能性
③为了解释c(H2O2)增大到一定浓度后速率减小,乙查得了如下资料:
资料显示:c(H2O2)>0.02mol,H2O2溶液中存在平衡:2H2O2⇌H4O4
请用平衡移动原理解释c(H2O2)=0.0312mol/L速率忽然减小的原因
(2)乙继续进行实验II,并记录如下:
| 操作 | 现象 | |
| 实验II | 往2mL0.2mol/LH2O2溶液中逐滴滴加0.05mol/LKMnO4[c(H+)=5.0mol/L]溶液 | 第1-9滴溶液滴下,完全褪色所需时间很长; 第10滴溶液滴下迅速褪色。 整个过程中几乎无温度变化。 |
②乙设计实验方案证实了上述假设合理,请补全他的方案:
| 操作 | 现象 | |
| 实验III | 往2mL0.2mol/LH2O2溶液中滴入5滴0.05mol/LKMnO4[c(H+)=5.0mol/L]溶液 | 完全褪色时间为t秒 |
| 实验IV | 往2mL0.2mol/LH2O2溶液中 |
a.增大KMnO4溶液浓度 b.增大H2O2溶液浓度 c.增大H2SO4浓度
d.加热适当温度 e.加入合适的催化剂
您最近一年使用:0次
2022-08-21更新
|
858次组卷
|
8卷引用:2021年北京市海淀区中国人民大学附属中学三模化学试题
2021年北京市海淀区中国人民大学附属中学三模化学试题中国人民大学附属中学2021届高三第三次模拟考试化学试题(已下线)考点32 化学反应条件的控制-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)备战2022年高考化学精准检测卷【全国卷】20广东省普宁市华侨中学2021-2022学年高三下学期第二次模拟考化学试题广东省惠州市第一中学2022-2023学年高二上学期第一次月考化学试题(已下线)易错点21 化学反应速率-备战2023年高考化学考试易错题(已下线)化学(广东B卷)-学易金卷:2023年高考第一次模拟考试卷
名校
2 . 某探究性学习小组认为 与KI溶液反应时,能发生以下反应:①
与KI溶液反应时,能发生以下反应:①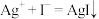
 ,②
,②
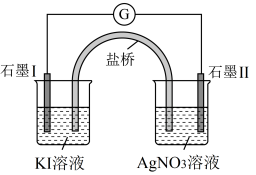
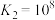 。设计如下装置进行验证,一段时间后,石墨Ⅱ电极上有光亮的物质生成。
。设计如下装置进行验证,一段时间后,石墨Ⅱ电极上有光亮的物质生成。
已知AgI的溶度积常数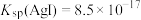 ,氧化性
,氧化性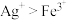 ,下列有关叙述正确的是
,下列有关叙述正确的是
 与KI溶液反应时,能发生以下反应:①
与KI溶液反应时,能发生以下反应:①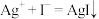
 ,②
,②
 。设计如下装置进行验证,一段时间后,石墨Ⅱ电极上有光亮的物质生成。
。设计如下装置进行验证,一段时间后,石墨Ⅱ电极上有光亮的物质生成。
已知AgI的溶度积常数
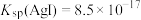 ,氧化性
,氧化性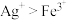 ,下列有关叙述正确的是
,下列有关叙述正确的是| A.石墨Ⅰ为正极,盐桥内溶质为KCl |
B.石墨Ⅱ的电极反应式为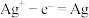 |
| C.往KI溶液中加入淀粉可检验生成的产物 |
D.平衡常数 : : ;反应活化能:①>② ;反应活化能:①>② |
您最近一年使用:0次
名校
3 . 作为绿色氧化剂和消毒剂, 在工业生产及日常生活中应用广泛。已知:
在工业生产及日常生活中应用广泛。已知:
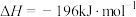 。回答下列问题:
。回答下列问题:
(1)实验表明,在54℃下恒温储存两周, 的浓度仍然保持为原来的99%,这说明
的浓度仍然保持为原来的99%,这说明 分解反应的
分解反应的_______ 。
(2) 催化
催化 分解的原理分为两步:第一步反应的热化学方程式为
分解的原理分为两步:第一步反应的热化学方程式为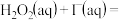
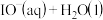
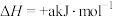 (a>0),则第二步反应的热化学方程式为
(a>0),则第二步反应的热化学方程式为_______ 。已知第一步反应为慢反应,第二步反应为快反应,则能正确表示 催化
催化 分解原理的示意图为
分解原理的示意图为_______ (填标号)。 在不同条件下分解的反应速率,实验室测量气体体积的常用方法如图所示,其中有明显错误的是
在不同条件下分解的反应速率,实验室测量气体体积的常用方法如图所示,其中有明显错误的是_______ (填标号),应当怎样改正?_______ ;四种测量气体体积方法的图示中均用到的仪器包括导管、_______ ;比较 在不同条件下分解的反应速率时,实验中需要测定的数据为
在不同条件下分解的反应速率时,实验中需要测定的数据为_______ 。 催化
催化 分解反应的影响如图所示。
分解反应的影响如图所示。 时,0~10min内
时,0~10min内 分解反应的平均速率
分解反应的平均速率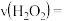
_______  。
。
②下列对图象的分析正确的是_______ (填标号)。
A.相同条件下, 的浓度越小,分解速率越大
的浓度越小,分解速率越大
B.相同条件下,溶液的酸性越强, 的分解速率越大
的分解速率越大
C.在0~50min内, 时
时 的分解百分率比
的分解百分率比 时大
时大
 在工业生产及日常生活中应用广泛。已知:
在工业生产及日常生活中应用广泛。已知:
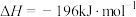 。回答下列问题:
。回答下列问题:(1)实验表明,在54℃下恒温储存两周,
 的浓度仍然保持为原来的99%,这说明
的浓度仍然保持为原来的99%,这说明 分解反应的
分解反应的(2)
 催化
催化 分解的原理分为两步:第一步反应的热化学方程式为
分解的原理分为两步:第一步反应的热化学方程式为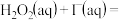
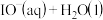
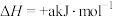 (a>0),则第二步反应的热化学方程式为
(a>0),则第二步反应的热化学方程式为 催化
催化 分解原理的示意图为
分解原理的示意图为
 在不同条件下分解的反应速率,实验室测量气体体积的常用方法如图所示,其中有明显错误的是
在不同条件下分解的反应速率,实验室测量气体体积的常用方法如图所示,其中有明显错误的是 在不同条件下分解的反应速率时,实验中需要测定的数据为
在不同条件下分解的反应速率时,实验中需要测定的数据为A.  B.
B. 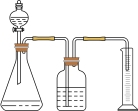 C.
C.  D.
D. 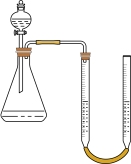
 催化
催化 分解反应的影响如图所示。
分解反应的影响如图所示。
 时,0~10min内
时,0~10min内 分解反应的平均速率
分解反应的平均速率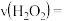
 。
。②下列对图象的分析正确的是
A.相同条件下,
 的浓度越小,分解速率越大
的浓度越小,分解速率越大B.相同条件下,溶液的酸性越强,
 的分解速率越大
的分解速率越大C.在0~50min内,
 时
时 的分解百分率比
的分解百分率比 时大
时大
您最近一年使用:0次
2022-09-29更新
|
145次组卷
|
3卷引用:河北省保定市部分学校2022-2023学年高二上学期第一次月考化学试题
解题方法
4 . 我国科学家开发新型高效催化剂,在太阳能作用下制备双氧水。
I.双氧水不稳定。
(1)实验研究发现,碘离子催化双氧水分解反应分两步进行,其反应历程如图所示。
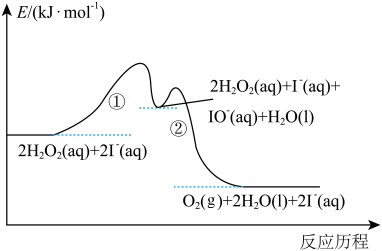
①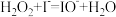 ;
;
②_______ (补充离子方程式)。其中,反应_______ 控制总反应速率(填“①”或“②”)。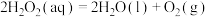

_______ 0(填“>”“<”或“=”)。
(2)双氧水在碘离子催化下发生分解反应: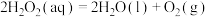 ,其速率方程为
,其速率方程为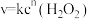 (k为速率常数,只与温度、催化剂有关;n为反应级数,可以为零、分数或整数)。双氧水在常温下的分解速率与浓度的关系如表所示。
(k为速率常数,只与温度、催化剂有关;n为反应级数,可以为零、分数或整数)。双氧水在常温下的分解速率与浓度的关系如表所示。
常温下,该反应的速率常数
_______ (不写单位)。
II.查阅资料知: 是一种弱酸,298K时
是一种弱酸,298K时 的
的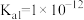 ,
,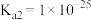 。
。
(3)298K时,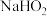 溶液中
溶液中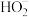 的水解常数为
的水解常数为_______ 。
III.测定双氧水溶液的浓度。
(4)已知:酸性条件下,双氧水和高锰酸钾反应, 生成,写出反应的离子方程式:
生成,写出反应的离子方程式:_______ 。
(5)取 mL某双氧水溶液于锥形瓶中,稀释至250 mL。取稀释后的溶液25.00 mL于锥形瓶中,加入适量的稀硫酸,用c mol·L
mL某双氧水溶液于锥形瓶中,稀释至250 mL。取稀释后的溶液25.00 mL于锥形瓶中,加入适量的稀硫酸,用c mol·L
 标准溶液滴定至终点时,消耗滴定液V mL。该双氧水溶液中
标准溶液滴定至终点时,消耗滴定液V mL。该双氧水溶液中
_______ mol·L (用含c、V、
(用含c、V、 的代数式表示)。若滴定管用蒸馏水洗涤后没有用
的代数式表示)。若滴定管用蒸馏水洗涤后没有用 标准溶液润洗,则测得的结果
标准溶液润洗,则测得的结果_______ (填“偏高”“偏低”或“无影响”)。
I.双氧水不稳定。
(1)实验研究发现,碘离子催化双氧水分解反应分两步进行,其反应历程如图所示。

①
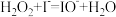 ;
;②
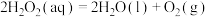

(2)双氧水在碘离子催化下发生分解反应:
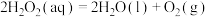 ,其速率方程为
,其速率方程为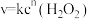 (k为速率常数,只与温度、催化剂有关;n为反应级数,可以为零、分数或整数)。双氧水在常温下的分解速率与浓度的关系如表所示。
(k为速率常数,只与温度、催化剂有关;n为反应级数,可以为零、分数或整数)。双氧水在常温下的分解速率与浓度的关系如表所示。| 序号 | 反应时间/min |  /(mol·L /(mol·L ) ) | v/(mol·L ·min ·min ) ) |
| ① | 0 | 0.80 | 0 |
| ② | 20 | 0.40 | 0.020 |
| ③ | 40 | 0.20 | 0.010 |
| ④ | 60 | 0.10 | 0.005 |
| ⑤ | 80 | 0.05 | 0.0025 |

II.查阅资料知:
 是一种弱酸,298K时
是一种弱酸,298K时 的
的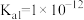 ,
,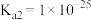 。
。(3)298K时,
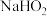 溶液中
溶液中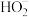 的水解常数为
的水解常数为III.测定双氧水溶液的浓度。
(4)已知:酸性条件下,双氧水和高锰酸钾反应,
 生成,写出反应的离子方程式:
生成,写出反应的离子方程式:(5)取
 mL某双氧水溶液于锥形瓶中,稀释至250 mL。取稀释后的溶液25.00 mL于锥形瓶中,加入适量的稀硫酸,用c mol·L
mL某双氧水溶液于锥形瓶中,稀释至250 mL。取稀释后的溶液25.00 mL于锥形瓶中,加入适量的稀硫酸,用c mol·L
 标准溶液滴定至终点时,消耗滴定液V mL。该双氧水溶液中
标准溶液滴定至终点时,消耗滴定液V mL。该双氧水溶液中
 (用含c、V、
(用含c、V、 的代数式表示)。若滴定管用蒸馏水洗涤后没有用
的代数式表示)。若滴定管用蒸馏水洗涤后没有用 标准溶液润洗,则测得的结果
标准溶液润洗,则测得的结果
您最近一年使用:0次
2023-02-18更新
|
121次组卷
|
2卷引用:海南省2022-2023学年高二上学期期末学业水平诊断(一)化学试题
名校
解题方法
5 .  催化剂光助一芬顿反应用于漂白有机染料的一种机理如图所示,其中包括①②光激发产生光电子与光生空穴(
催化剂光助一芬顿反应用于漂白有机染料的一种机理如图所示,其中包括①②光激发产生光电子与光生空穴( ,具有很强的得电子能力)、③④空穴氧化、⑥超氧自由基氧化、⑦光生电子还原铁离子等。下列说法正确的是
,具有很强的得电子能力)、③④空穴氧化、⑥超氧自由基氧化、⑦光生电子还原铁离子等。下列说法正确的是

 催化剂光助一芬顿反应用于漂白有机染料的一种机理如图所示,其中包括①②光激发产生光电子与光生空穴(
催化剂光助一芬顿反应用于漂白有机染料的一种机理如图所示,其中包括①②光激发产生光电子与光生空穴( ,具有很强的得电子能力)、③④空穴氧化、⑥超氧自由基氧化、⑦光生电子还原铁离子等。下列说法正确的是
,具有很强的得电子能力)、③④空穴氧化、⑥超氧自由基氧化、⑦光生电子还原铁离子等。下列说法正确的是
A.反应⑤每消耗1mol  ,共转移4mol ,共转移4mol  |
| B.反应⑨中双氧水将颜料直接氧化成无色物质 |
C.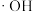 、 、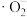 和 和 在漂白颜料时体现了强还原性 在漂白颜料时体现了强还原性 |
| D.催化剂可以降低反应活化能,提高单位体积内活化分子百分数 |
您最近一年使用:0次
2024-02-26更新
|
209次组卷
|
2卷引用:江西省五市九校协作体2023-2024学年高三上学期第一次联考化学试题
6 .  的综合利用具有重要意义。
的综合利用具有重要意义。 的捕集方法众多,可以形成
的捕集方法众多,可以形成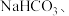
 、尿素
、尿素 等重要化合物,
等重要化合物, 还可以催化转化为高附加值化学品
还可以催化转化为高附加值化学品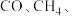
 等。如用镍基催化剂催化电解
等。如用镍基催化剂催化电解 可得到
可得到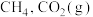 和
和 反应生成
反应生成
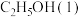 和
和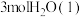 可放出
可放出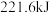 的热量。固载
的热量。固载 基催化剂催化反应
基催化剂催化反应 是实现
是实现 资源化的重要途径。将一定比例的
资源化的重要途径。将一定比例的 和
和 的混合气体以一定流速通过装有催化剂的反应器,在反应器出口处检测到大量
的混合气体以一定流速通过装有催化剂的反应器,在反应器出口处检测到大量 其选择性高达
其选择性高达 以上。下列说法
以上。下列说法不正确 的是
 的综合利用具有重要意义。
的综合利用具有重要意义。 的捕集方法众多,可以形成
的捕集方法众多,可以形成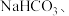
 、尿素
、尿素 等重要化合物,
等重要化合物, 还可以催化转化为高附加值化学品
还可以催化转化为高附加值化学品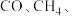
 等。如用镍基催化剂催化电解
等。如用镍基催化剂催化电解 可得到
可得到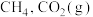 和
和 反应生成
反应生成
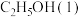 和
和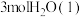 可放出
可放出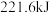 的热量。固载
的热量。固载 基催化剂催化反应
基催化剂催化反应 是实现
是实现 资源化的重要途径。将一定比例的
资源化的重要途径。将一定比例的 和
和 的混合气体以一定流速通过装有催化剂的反应器,在反应器出口处检测到大量
的混合气体以一定流速通过装有催化剂的反应器,在反应器出口处检测到大量 其选择性高达
其选择性高达 以上。下列说法
以上。下列说法A. 既有酸性,又有还原性 既有酸性,又有还原性 |
B.该反应的平衡常数 |
C.该反应中每消耗 转移电子的数目约为 转移电子的数目约为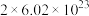 |
D.该反应可能经历了以下过程:① ② ② 且反应①的活化能大于反应② 且反应①的活化能大于反应② |
您最近一年使用:0次
7 . 中国的能源特点是“多煤、少油、缺气”,因此“煤制合成天然气(SNG)”合成技术对我国资源合理利用、节能减排具有重要意义。
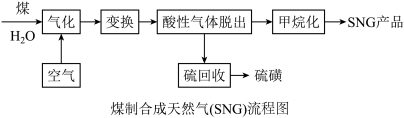
(1)煤主要由碳、氢、氧、硫等元素组成,下列碳及其化合物的性质与用途具有对应关系的是_______
(2)煤、石油、天然气均属于化石燃料,是不可再生资源。下列关于化石燃料的说法不正确 的是_______
(3)已知:几种物质的标准燃烧热如下表所示
①写出能表示 标准燃烧热的热化学方程式:
标准燃烧热的热化学方程式:_______ 。
②燃烧等质量的上述几种物质,放出热量最多得是_______ 。
③气化过程中,需向炭层交替喷入空气和水蒸气,请从能量利用的角度分析喷入空气的目的是_______ 。
(4)一种“酸性气体脱出”并回收硫的技术如下:
第一步,用 溶液吸收
溶液吸收 ;
;
第二步,在 时,用
时,用 溶液氧化NaHS回收单质硫,同时产生
溶液氧化NaHS回收单质硫,同时产生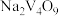 。
。
①第二步发生的反应离子方程式为_______ 。
②脱出 速度主要取决于第二步反应的速率,则反应速率:
速度主要取决于第二步反应的速率,则反应速率: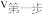
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。

(1)煤主要由碳、氢、氧、硫等元素组成,下列碳及其化合物的性质与用途具有对应关系的是_______
| A.炭能燃烧,可用作除味剂 | B.CO具有还原性,可用于铁的冶炼 |
C. 易溶于水,可用于去除油污 易溶于水,可用于去除油污 | D. 能与碱反应,可用于烘焙糕点 能与碱反应,可用于烘焙糕点 |
| A.甲烷是天然气的主要成分,它是一种高效而洁净的燃料 |
| B.石油的分馏是化学变化 |
| C.石油通过催化裂化过程可获得汽油、煤油等轻质油 |
| D.煤的气化是把煤转化为可燃性气体的过程,该过程属于化学变化 |
 |  |  | |
标准燃烧热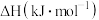 | -393.5 | -283 | -285.8 |
①写出能表示
 标准燃烧热的热化学方程式:
标准燃烧热的热化学方程式:②燃烧等质量的上述几种物质,放出热量最多得是
③气化过程中,需向炭层交替喷入空气和水蒸气,请从能量利用的角度分析喷入空气的目的是
(4)一种“酸性气体脱出”并回收硫的技术如下:
第一步,用
 溶液吸收
溶液吸收 ;
;第二步,在
 时,用
时,用 溶液氧化NaHS回收单质硫,同时产生
溶液氧化NaHS回收单质硫,同时产生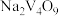 。
。①第二步发生的反应离子方程式为
②脱出
 速度主要取决于第二步反应的速率,则反应速率:
速度主要取决于第二步反应的速率,则反应速率: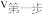
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
名校
8 . 2021年中国科学院和中国工程院评选出2020年世界十大科技进展,其一是一种可借助光将二氧化碳转化为甲烷的新型催化转化方法: ,这是最接近人造光合作用的方法,
,这是最接近人造光合作用的方法, 加氢制
加氢制 的一种催化机理如图。下列说法不正确的是
的一种催化机理如图。下列说法不正确的是
 ,这是最接近人造光合作用的方法,
,这是最接近人造光合作用的方法, 加氢制
加氢制 的一种催化机理如图。下列说法不正确的是
的一种催化机理如图。下列说法不正确的是
A.反应中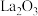 是中间产物 是中间产物 |
B. 转化为 转化为 利用了 利用了 的氧化性 的氧化性 |
C. 经过Ni活性中心裂解产生 经过Ni活性中心裂解产生 需要吸收能量 需要吸收能量 |
| D.使用催化剂可以提高化学反应速率 |
您最近一年使用:0次
名校
9 . 某课题组研究煤燃烧过程中氮氧化物与砷反应的微观机理,对于所研究的三个反应,下列说法错误的是
| 反应 | 活化能/kJ·mol-1 |
| As+NO→AsO+N | 155.85 |
| As+N2O→AsO+N2 | 78.45 |
| As+NO2→AsO+NO | 2.58 |
| A.相同条件下的氧化性:NO2>NO |
| B.仅改变温度不能显著改变As与NO的反应速率 |
| C.相同条件下,As与NO的反应速率最慢 |
| D.升高温度不能降低As与N2O反应的活化能 |
您最近一年使用:0次
2023-08-28更新
|
97次组卷
|
2卷引用:吉林省长春市朝阳区长春外国语学校2022-2023学年高二上学期11月期中化学试题
10 . 酯在碱性条件下发生水解反应的历程如图,下列说法错误的是


| A.反应①为该反应的决速步骤 |
| B.若用18OH-进行标记,反应结束后醇和羧酸钠中均存在18O |
| C.该反应历程中碳原子杂化方式会发生改变 |
| D.反应①中OH-攻击的位置由碳和氧电负性大小决定 |
您最近一年使用:0次
2022-09-29更新
|
549次组卷
|
2卷引用:山东省淄博第四中学2022-2023学年高三上学期第一次阶段性检测化学试题



