名校
1 . 碳达峰是指我国承诺2030年前,二氧化碳的排放不再增长。因此,诸多科学家都在大力研合理利用 和CO以减少碳的排放。
和CO以减少碳的排放。
(1) 可通过以下4种方式转化成有机物,从而有效实现碳循环。
可通过以下4种方式转化成有机物,从而有效实现碳循环。
a.
b.
c.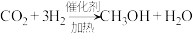
已知: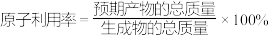
以上反应中,最环保节能的是_______ ,原子利用率最高的是_______ 。(填编号)
(2)我国科学家设计出一条仅11步的工业合成路线,实现了 到淀粉的合成。其第一步是把
到淀粉的合成。其第一步是把 还原为甲醇(
还原为甲醇( ),该方法的化学方程式是:
),该方法的化学方程式是:
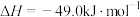 。回答下列问题:
。回答下列问题:
①能说明该反应已达平衡状态的是_______ (填字母)。
A.单位时间内生成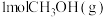 的同时消耗了
的同时消耗了
B.在恒温恒容的容器中,混合气体的平均摩尔质量保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,混合气体的密度不再变化
②该反应正逆反应的活化能大小为:Ea(正)_______ Ea(逆)(填“>”、“=”或“<”)
(3)利用CO高温时与磷石膏(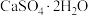 )反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
)反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
①在700℃时,主要的还原产物是一种硫的最低价盐,该物质为_______ (填化学式)。
②在1150℃时,向盛有足量 的真空恒容密闭容器中充入一定量CO,反应体系起始压强为
的真空恒容密闭容器中充入一定量CO,反应体系起始压强为 ,主要发生反应:
,主要发生反应: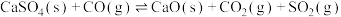 。该反应达到平衡时,
。该反应达到平衡时,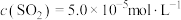 ,CO的转化率为50%,则初始时
,CO的转化率为50%,则初始时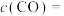
_______ mol/L,该反应的压强平衡常数
_______ MPa(忽略副反应;气体分压=总压×气体物质的量分数)。
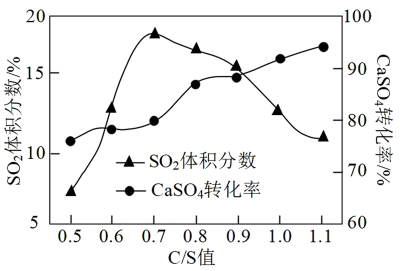
(4)工业上也可用炭粉还原磷石膏,该反应的产物与C/S值(炭粉与 的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、
的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、 和
和 ;当C/S值大于0.7时,反应所得气体中
;当C/S值大于0.7时,反应所得气体中 的体积分数下降,可能的原因是
的体积分数下降,可能的原因是_______ 。
 和CO以减少碳的排放。
和CO以减少碳的排放。(1)
 可通过以下4种方式转化成有机物,从而有效实现碳循环。
可通过以下4种方式转化成有机物,从而有效实现碳循环。a.

b.

c.
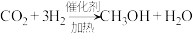
已知:
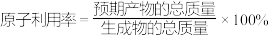
以上反应中,最环保节能的是
(2)我国科学家设计出一条仅11步的工业合成路线,实现了
 到淀粉的合成。其第一步是把
到淀粉的合成。其第一步是把 还原为甲醇(
还原为甲醇( ),该方法的化学方程式是:
),该方法的化学方程式是:
 。回答下列问题:
。回答下列问题:①能说明该反应已达平衡状态的是
A.单位时间内生成
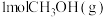 的同时消耗了
的同时消耗了
B.在恒温恒容的容器中,混合气体的平均摩尔质量保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,混合气体的密度不再变化
②该反应正逆反应的活化能大小为:Ea(正)
(3)利用CO高温时与磷石膏(
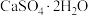 )反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
)反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。①在700℃时,主要的还原产物是一种硫的最低价盐,该物质为
②在1150℃时,向盛有足量
 的真空恒容密闭容器中充入一定量CO,反应体系起始压强为
的真空恒容密闭容器中充入一定量CO,反应体系起始压强为 ,主要发生反应:
,主要发生反应: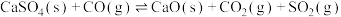 。该反应达到平衡时,
。该反应达到平衡时,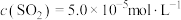 ,CO的转化率为50%,则初始时
,CO的转化率为50%,则初始时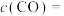

(4)工业上也可用炭粉还原磷石膏,该反应的产物与C/S值(炭粉与
 的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、
的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、 和
和 ;当C/S值大于0.7时,反应所得气体中
;当C/S值大于0.7时,反应所得气体中 的体积分数下降,可能的原因是
的体积分数下降,可能的原因是
您最近一年使用:0次
2022-09-21更新
|
142次组卷
|
2卷引用:重庆市璧山来凤中学校2022-2023学年高二上学期9月月考化学试题
名校
解题方法
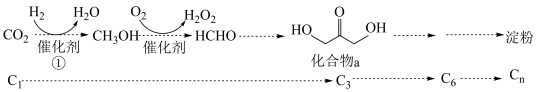
2 . 2021年我国科学家以 为原料人工合成淀粉,其效率约为传统农业生产淀粉的8.5倍,其部分合成路线如图所示,下列有关说法正确的是
为原料人工合成淀粉,其效率约为传统农业生产淀粉的8.5倍,其部分合成路线如图所示,下列有关说法正确的是
①
②
③
④
 为原料人工合成淀粉,其效率约为传统农业生产淀粉的8.5倍,其部分合成路线如图所示,下列有关说法正确的是
为原料人工合成淀粉,其效率约为传统农业生产淀粉的8.5倍,其部分合成路线如图所示,下列有关说法正确的是
①

②

③

④

| A.第①步反应断裂了非极性键与极性键 |
| B.催化剂降低了反应的活化能,改变了反应的焓变,降低了合成淀粉的难度 |
C. |
| D.反应④是吸热反应,活化能较大,所以是决速步 |
您最近一年使用:0次
3 . 2021年我国科学家以 为原料人工合成淀粉,其效率约为传统农业生产淀粉的8.5倍,其部分合成路线如图所示,下列有关说法正确的是
为原料人工合成淀粉,其效率约为传统农业生产淀粉的8.5倍,其部分合成路线如图所示,下列有关说法正确的是

①
②
③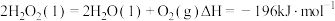
④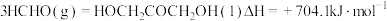
 为原料人工合成淀粉,其效率约为传统农业生产淀粉的8.5倍,其部分合成路线如图所示,下列有关说法正确的是
为原料人工合成淀粉,其效率约为传统农业生产淀粉的8.5倍,其部分合成路线如图所示,下列有关说法正确的是
①

②

③
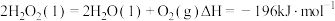
④
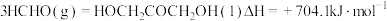
| A.第①步反应断裂了非极性键与极性键 |
| B.催化剂降低了反应的活化能,改变了反应的焓变,降低了合成淀粉的难度 |
| C.化合物a属于电解质 |
| D.反应④是吸热反应,活化能较大,所以是决速步 |
您最近一年使用:0次
4 .  上
上 加氢制甲醇的某种反应路线如图,下列说法错误的是
加氢制甲醇的某种反应路线如图,下列说法错误的是
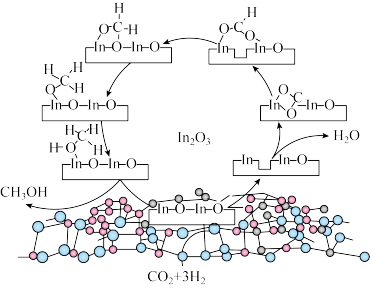
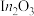 上
上 加氢制甲醇的某种反应路线如图,下列说法错误的是
加氢制甲醇的某种反应路线如图,下列说法错误的是
A.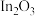 降低了总反应的活化能 降低了总反应的活化能 |
| B.该路线有非极性键的断裂和形成 |
| C.该合成路线符合绿色化学理念 |
| D.甲醇与水分子能形成分子间氢键 |
您最近一年使用:0次
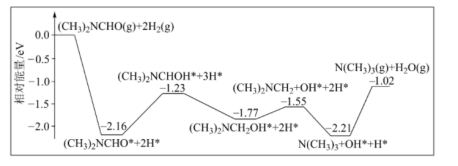
5 . 三甲胺(N (CH3)3)是重要的化工原料,最近我国科学家发明了使用铜催化剂将 二甲基甲酰胺 [N(CH3)2CHO,简称为
二甲基甲酰胺 [N(CH3)2CHO,简称为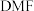 ]转化为三甲胺的合成路线,单一
]转化为三甲胺的合成路线,单一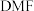 分子在铜催化剂表面的反应历程如图所示,(*表示物质吸附在铜催化剂上)下列说法正确的是
分子在铜催化剂表面的反应历程如图所示,(*表示物质吸附在铜催化剂上)下列说法正确的是
 二甲基甲酰胺 [N(CH3)2CHO,简称为
二甲基甲酰胺 [N(CH3)2CHO,简称为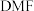 ]转化为三甲胺的合成路线,单一
]转化为三甲胺的合成路线,单一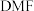 分子在铜催化剂表面的反应历程如图所示,(*表示物质吸附在铜催化剂上)下列说法正确的是
分子在铜催化剂表面的反应历程如图所示,(*表示物质吸附在铜催化剂上)下列说法正确的是 
| A.该历程中决速步骤为: (CH3)2NCH2OH*=(CH3)2NCH2+OH* |
B.该反应的原子利用率为 ,该历程中的最大能垒(活化能)为2.16eV ,该历程中的最大能垒(活化能)为2.16eV |
| C.升高温度可以加快反应速率,并提高DMF的平衡转化率 |
D.若 完全转化为三甲胺,则会释放出1.02eV·NA的能量 完全转化为三甲胺,则会释放出1.02eV·NA的能量 |
您最近一年使用:0次
2021-11-06更新
|
632次组卷
|
5卷引用:黑龙江省八校2022届高三上学期期中联合考试化学试题
黑龙江省八校2022届高三上学期期中联合考试化学试题(已下线)押新高考卷11题 反应机理分析-备战2022年高考化学临考题号押题(新高考通版)山东省枣庄滕州市2022-2023学年高三上学期期中考试化学试题山东省滕州市第二中学2022-2023学年高三上学期11月定时检测化学试题(已下线)专题13 反应微观机理分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
名校
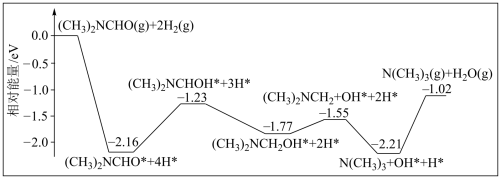
6 . 三甲胺 是重要的化工原料。我国科学家实现了使用铜催化剂将
是重要的化工原料。我国科学家实现了使用铜催化剂将 ,
, 二甲基甲酰胺[
二甲基甲酰胺[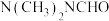 ,简称
,简称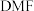 ]转化为三甲胺的合成路线。结合实验与计算机模拟结果,研究单个
]转化为三甲胺的合成路线。结合实验与计算机模拟结果,研究单个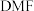 分子在铜催化剂表面的反应历程如图所示(*装示物质吸附在铜催化剂上)。下列说法
分子在铜催化剂表面的反应历程如图所示(*装示物质吸附在铜催化剂上)。下列说法错误 的是
 是重要的化工原料。我国科学家实现了使用铜催化剂将
是重要的化工原料。我国科学家实现了使用铜催化剂将 ,
, 二甲基甲酰胺[
二甲基甲酰胺[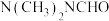 ,简称
,简称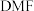 ]转化为三甲胺的合成路线。结合实验与计算机模拟结果,研究单个
]转化为三甲胺的合成路线。结合实验与计算机模拟结果,研究单个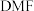 分子在铜催化剂表面的反应历程如图所示(*装示物质吸附在铜催化剂上)。下列说法
分子在铜催化剂表面的反应历程如图所示(*装示物质吸附在铜催化剂上)。下列说法
| A.该历程中只发生了极性键的断裂 |
B.该历程中的最大能垒(活化能)为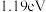 |
| C.铜催化剂的作用之一是吸附反应物形成更稳定的反应中间体 |
D.若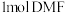 完全转化为三甲胺,则会释放出 完全转化为三甲胺,则会释放出 的能量 的能量 |
您最近一年使用:0次
解题方法
7 . 低碳烯烃是指乙烯、丙烯、丁烯,它们是有机合成的重要原料。
(1)我国学者用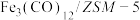 催化
催化 加氢合成低碳烯烃,反应过程如图所示。
加氢合成低碳烯烃,反应过程如图所示。 存在下,
存在下, 加氢反应中,RWGS反应的活化能与FTS反应的活化能的关系是
加氢反应中,RWGS反应的活化能与FTS反应的活化能的关系是______ (填字母)。
a.前者大于后者 b.前者小于后者 .无法判断
②已知:Ⅰ.
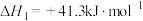 。
。
Ⅱ.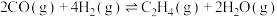
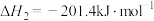 。
。
向某密闭容器中加入1mol 和3mol
和3mol  ,在一定条件下发生上述反应。研究发现,乙烯的平衡产率随温度变化曲线如图所示,请解释550K以后曲线变化的原因:
,在一定条件下发生上述反应。研究发现,乙烯的平衡产率随温度变化曲线如图所示,请解释550K以后曲线变化的原因:______ 。 和3mol
和3mol  加入某密闭容器中合成低碳烯烃:n
加入某密闭容器中合成低碳烯烃:n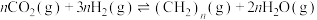 ,40min时反应达到平衡,此时测得的转化率和各含碳产物占所有含碳产物的物质的量分数如表。
,40min时反应达到平衡,此时测得的转化率和各含碳产物占所有含碳产物的物质的量分数如表。
反应达到平衡后, 的分压是
的分压是______ kPa(结果保留三位有效数字,下同),从反应开始到平衡时, 的反应速率是
的反应速率是______ kPa·min-1。
(2)正丁烷催化脱氢可得到2-丁烯,其转化关系如下。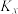 ,表示反应的体积分数平衡常数(即浓度平衡常数中的浓度用体积分数代替)。上述三个反应的体积分数平衡常数的对数
,表示反应的体积分数平衡常数(即浓度平衡常数中的浓度用体积分数代替)。上述三个反应的体积分数平衡常数的对数 ,与温度的变化关系如图所示。
,与温度的变化关系如图所示。
______ (用含a、c的代数式表示)。
②在 K时,向某密闭容器中加入2mol正丁烷,测得生成的顺-2-丁烯为0.15mol,则平衡体系中
K时,向某密闭容器中加入2mol正丁烷,测得生成的顺-2-丁烯为0.15mol,则平衡体系中 为
为______ mol。保持恒温、恒压下,再向该容器中充入一定量稀有气体He,则反-2-丁烯的体积分数将会______ (填“增大”“减小”或“不变”)。
(1)我国学者用
 催化
催化 加氢合成低碳烯烃,反应过程如图所示。
加氢合成低碳烯烃,反应过程如图所示。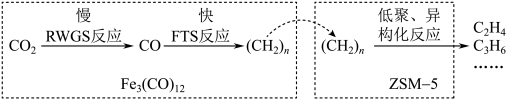
 存在下,
存在下, 加氢反应中,RWGS反应的活化能与FTS反应的活化能的关系是
加氢反应中,RWGS反应的活化能与FTS反应的活化能的关系是a.前者大于后者 b.前者小于后者 .无法判断
②已知:Ⅰ.

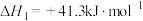 。
。Ⅱ.
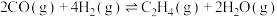
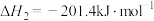 。
。向某密闭容器中加入1mol
 和3mol
和3mol  ,在一定条件下发生上述反应。研究发现,乙烯的平衡产率随温度变化曲线如图所示,请解释550K以后曲线变化的原因:
,在一定条件下发生上述反应。研究发现,乙烯的平衡产率随温度变化曲线如图所示,请解释550K以后曲线变化的原因: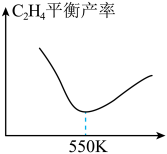
 和3mol
和3mol  加入某密闭容器中合成低碳烯烃:n
加入某密闭容器中合成低碳烯烃:n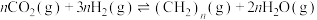 ,40min时反应达到平衡,此时测得的转化率和各含碳产物占所有含碳产物的物质的量分数如表。
,40min时反应达到平衡,此时测得的转化率和各含碳产物占所有含碳产物的物质的量分数如表。
| 各含碳产物占所有含碳产物的物质的量分数/% | ||
|
| 其他 | |
60.0 | 60.0 | 40.0 | 0 |
 的分压是
的分压是 的反应速率是
的反应速率是(2)正丁烷催化脱氢可得到2-丁烯,其转化关系如下。

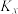 ,表示反应的体积分数平衡常数(即浓度平衡常数中的浓度用体积分数代替)。上述三个反应的体积分数平衡常数的对数
,表示反应的体积分数平衡常数(即浓度平衡常数中的浓度用体积分数代替)。上述三个反应的体积分数平衡常数的对数 ,与温度的变化关系如图所示。
,与温度的变化关系如图所示。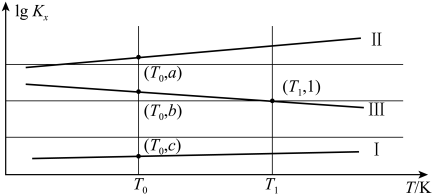

②在
 K时,向某密闭容器中加入2mol正丁烷,测得生成的顺-2-丁烯为0.15mol,则平衡体系中
K时,向某密闭容器中加入2mol正丁烷,测得生成的顺-2-丁烯为0.15mol,则平衡体系中 为
为
您最近一年使用:0次
8 . 回答下列问题:
(1)已知: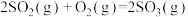
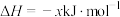
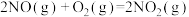
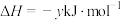
则反应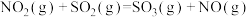 的
的 =
=___________  。
。
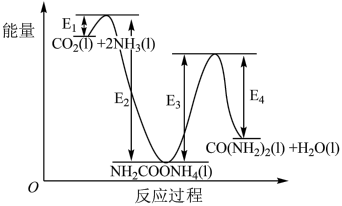
(2)二十世纪初,工业上以CO2和NH3,为原料在一定温度和压强下合成尿素。反应分两步:
i.CO2和NH3生成NH2COONH4;ii.NH2COONH4分解生成尿素。
①合成尿素反应的热化学方程式为___________ 。
②结合反应过程中能量变化示意图1,下列说法正确的是___________ (填序号)。
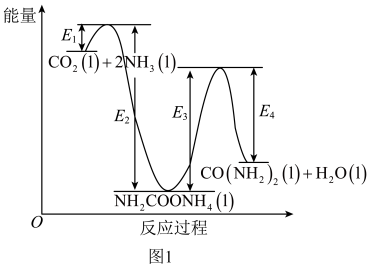
a.活化能:反应i<反应ii
b.i为放热反应,ii为吸热反应
c.对总反应速率影响较大的是反应i
(3)某研究团队合成的低配位Cu在碱性条件下催化CO2还原生成乙烯的电化学装置如图2所示。
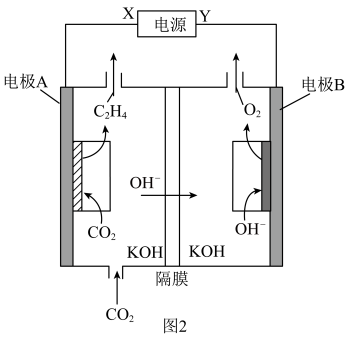
①Y为电源的___________ (填“正极”或“负极”)。
②电极A上的电极反应式为___________ 。
③理论上电极A上消耗的 与电极B上生成的
与电极B上生成的 的物质的量之比为
的物质的量之比为___________ 。
(4)以Al和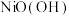 为电极,NaOH溶液为电解液组成一种新型电池,该电池保护地下铁管道不被腐蚀,铁管道应连接电池的
为电极,NaOH溶液为电解液组成一种新型电池,该电池保护地下铁管道不被腐蚀,铁管道应连接电池的___________ 电极[填“Al”或“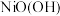 ”]。
”]。
(1)已知:
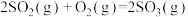
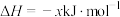
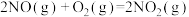
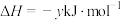
则反应
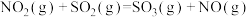 的
的 =
= 。
。(2)二十世纪初,工业上以CO2和NH3,为原料在一定温度和压强下合成尿素。反应分两步:
i.CO2和NH3生成NH2COONH4;ii.NH2COONH4分解生成尿素。
①合成尿素反应的热化学方程式为
②结合反应过程中能量变化示意图1,下列说法正确的是

a.活化能:反应i<反应ii
b.i为放热反应,ii为吸热反应
c.对总反应速率影响较大的是反应i
(3)某研究团队合成的低配位Cu在碱性条件下催化CO2还原生成乙烯的电化学装置如图2所示。

①Y为电源的
②电极A上的电极反应式为
③理论上电极A上消耗的
 与电极B上生成的
与电极B上生成的 的物质的量之比为
的物质的量之比为(4)以Al和
 为电极,NaOH溶液为电解液组成一种新型电池,该电池保护地下铁管道不被腐蚀,铁管道应连接电池的
为电极,NaOH溶液为电解液组成一种新型电池,该电池保护地下铁管道不被腐蚀,铁管道应连接电池的 ”]。
”]。
您最近一年使用:0次
解题方法
9 . 与氮气相关的化学变化是氮循环和转化的重要一环,对生产、生活有重要的价值。
(1)合成氨是目前转化空气中氮最有效的工业方法,其反应历程和能量变化的简图如下:
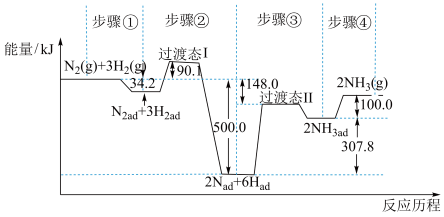
①由图可知合成氨反应 的
的 =
=___________  对总反应速率影响较大的是步骤
对总反应速率影响较大的是步骤___________ 。(填写编号)
②若改变某一条件,使合成氨的化学反应速率加快,下列解释正确的是___________ 。
A.升高温度,使单位体积内活化分子百分数增加
B.增加反应物的浓度,使单位体积内活化分子百分数增加
C.使用催化剂,能降低反应活化能,使单位体积内活化分子数增加
D.增大压强,能降低反应的活化能,使单位体积内活化分子数增加
(2)氨是极具前景的氢能载体和性能卓越的“零碳”燃料,利用 的燃烧反应(
的燃烧反应(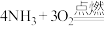
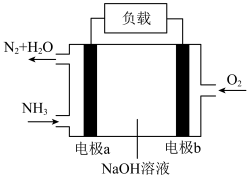
 )能设计成燃料电池其工作原理如图所示。电极b为
)能设计成燃料电池其工作原理如图所示。电极b为___________ (选填“正”或“负”)极;电极a的电极反应式为___________ ,当正负极共消耗3.136L(标准状况)气体时,通过负载的电子数为___________ 个。
(3)合成氨厂的 可用于合成重要化工原料
可用于合成重要化工原料 ,主要反应为:
,主要反应为: 。向两个容积固定为2L的密闭容器中分别充入比例相同,但总量不同的
。向两个容积固定为2L的密闭容器中分别充入比例相同,但总量不同的 和
和 气体,
气体, 的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如下图所示。
的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如下图所示。

①若 时,向容器中充入
时,向容器中充入 mol气体(3mol
mol气体(3mol  和1mol
和1mol  ),反应至5min时达到平衡,则0~5min内
),反应至5min时达到平衡,则0~5min内 的平均反应速率
的平均反应速率
___________ 。
②由上图可判断该反应是___________ (选填“吸热”或“放热”)反应,在___________ (填“较高”或“较低”)温度下有利于该反应自发进行。
(1)合成氨是目前转化空气中氮最有效的工业方法,其反应历程和能量变化的简图如下:

①由图可知合成氨反应
 的
的 =
= 对总反应速率影响较大的是步骤
对总反应速率影响较大的是步骤②若改变某一条件,使合成氨的化学反应速率加快,下列解释正确的是
A.升高温度,使单位体积内活化分子百分数增加
B.增加反应物的浓度,使单位体积内活化分子百分数增加
C.使用催化剂,能降低反应活化能,使单位体积内活化分子数增加
D.增大压强,能降低反应的活化能,使单位体积内活化分子数增加
(2)氨是极具前景的氢能载体和性能卓越的“零碳”燃料,利用
 的燃烧反应(
的燃烧反应(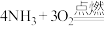
 )能设计成燃料电池其工作原理如图所示。电极b为
)能设计成燃料电池其工作原理如图所示。电极b为
(3)合成氨厂的
 可用于合成重要化工原料
可用于合成重要化工原料 ,主要反应为:
,主要反应为: 。向两个容积固定为2L的密闭容器中分别充入比例相同,但总量不同的
。向两个容积固定为2L的密闭容器中分别充入比例相同,但总量不同的 和
和 气体,
气体, 的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如下图所示。
的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如下图所示。
①若
 时,向容器中充入
时,向容器中充入 mol气体(3mol
mol气体(3mol  和1mol
和1mol  ),反应至5min时达到平衡,则0~5min内
),反应至5min时达到平衡,则0~5min内 的平均反应速率
的平均反应速率
②由上图可判断该反应是
您最近一年使用:0次
10 . 尿素[CO(NH2)2]合成的发展体现了化学科学与技术的不断进步。回答下列问题:
(1)十九世纪初,用氰酸银(AgOCN)与 在一定条件下反应制得
在一定条件下反应制得 ,实现了由无机物到有机物的合成。该反应的化学方程式是
,实现了由无机物到有机物的合成。该反应的化学方程式是___________ 。
(2)二十世纪初,工业以 和
和 为原料,在一定温度和压强下合成尿素。反应分两步进行,反应过程能量变化如图。总反应
为原料,在一定温度和压强下合成尿素。反应分两步进行,反应过程能量变化如图。总反应

___________ (用 、
、 、
、 、
、 表示);快反应的化学方程式为
表示);快反应的化学方程式为___________ 。
(3)研究发现,电催化 和含氮物质(
和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题,电解原理如图所示。b是电源的
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题,电解原理如图所示。b是电源的___________ 极;生成尿素的电极反应为___________ ,若生成 ,经过质子交换膜的
,经过质子交换膜的 的物质的量为
的物质的量为___________ mol。

(4)尿素样品含氮量的测定方法如下。已知:溶液中 不能直接用NaOH溶液准确滴定。
不能直接用NaOH溶液准确滴定。

①“消化液”中的含氮粒子是___________ 。
②步骤iv中标准NaOH溶液的浓度和消耗的体积分别为c和V,计算样品含氮量还需要的实验数据有___________ 。

(1)十九世纪初,用氰酸银(AgOCN)与
 在一定条件下反应制得
在一定条件下反应制得 ,实现了由无机物到有机物的合成。该反应的化学方程式是
,实现了由无机物到有机物的合成。该反应的化学方程式是(2)二十世纪初,工业以
 和
和 为原料,在一定温度和压强下合成尿素。反应分两步进行,反应过程能量变化如图。总反应
为原料,在一定温度和压强下合成尿素。反应分两步进行,反应过程能量变化如图。总反应

 、
、 、
、 、
、 表示);快反应的化学方程式为
表示);快反应的化学方程式为(3)研究发现,电催化
 和含氮物质(
和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题,电解原理如图所示。b是电源的
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题,电解原理如图所示。b是电源的 ,经过质子交换膜的
,经过质子交换膜的 的物质的量为
的物质的量为
(4)尿素样品含氮量的测定方法如下。已知:溶液中
 不能直接用NaOH溶液准确滴定。
不能直接用NaOH溶液准确滴定。
①“消化液”中的含氮粒子是
②步骤iv中标准NaOH溶液的浓度和消耗的体积分别为c和V,计算样品含氮量还需要的实验数据有
您最近一年使用:0次




