1 . 烯丙醇是生产甘油、医药、农药、香料和化妆品的中间体。已知烯丙醇与水在一定条件下发生加成反应的原理如下:
Ⅰ:CH2=CHCH2OH(g)+H2O(g) HOCH2CH2CH2OH(g) △H1 △S1
HOCH2CH2CH2OH(g) △H1 △S1
Ⅱ:CH2=CHCH2OH(g)+H2O(g) CH3CH(OH)CH2OH(g) △H2
CH3CH(OH)CH2OH(g) △H2
已知:相关物质在298K时的标准摩尔生成焓(101kPa时,该温度下由最稳定单质生成1 mol某纯物质的焓变)如下表所示:
(1)△H2=_______ kJ/mol;反应CH2=CHCH2OH(g)+H2O(g) HOCH2CH2CH2OH(l)的熵变为△S1',则△S1
HOCH2CH2CH2OH(l)的熵变为△S1',则△S1_______ △S1' (填“>”“=”或“<”)。
(2)若向绝热恒容容器中加入CH2=CHCH2OH(g)和H2O(g),发生反应Ⅰ和Ⅱ,下列事实不能说明体系达到平衡状态的是_______(填选项字母)。
(3)已知:反应的压强平衡常数(K)满足方程Kp=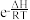 +C(e为自然对数的底数, R、C均为常数)。据此判断,下图所示曲线L1~L5中,能分别代表反应Ⅰ和Ⅱ的Kp与温度T关系的曲线为
+C(e为自然对数的底数, R、C均为常数)。据此判断,下图所示曲线L1~L5中,能分别代表反应Ⅰ和Ⅱ的Kp与温度T关系的曲线为_______ 和_______ 。
①该温度下,反应Ⅱ的压强平衡常数K=_______ 。
②若其他条件不变,初始时不充入He(g),而是按1:1的体积比充入CH2=CHCH2OH(g)和H2O(g),达到新平衡时,H2O(g)的转化率将_______ (填“增大”“减小”或“不变”),解释其原因为_______ 。
(5)烯丙醇的电氧化过程有重要应用。其在阳极放电时,同时存在三种电极反应(烯丙醇→丙烯酸、烯丙醇→丙烯醛、烯丙醇→丙二酸),各反应决速步骤的活化能如下表所示。
①该条件下,相同时间内,阳极产物中含量最多的为_______ 。
②碱性条件下,烯丙醇在电极上生成丙烯醛(CH2=CHCHO)的电极反应式为_______ 。
Ⅰ:CH2=CHCH2OH(g)+H2O(g)
 HOCH2CH2CH2OH(g) △H1 △S1
HOCH2CH2CH2OH(g) △H1 △S1Ⅱ:CH2=CHCH2OH(g)+H2O(g)
 CH3CH(OH)CH2OH(g) △H2
CH3CH(OH)CH2OH(g) △H2 已知:相关物质在298K时的标准摩尔生成焓(101kPa时,该温度下由最稳定单质生成1 mol某纯物质的焓变)如下表所示:
| 物质 | CH2=CHCH2OH(g) | H2O(g) | HOCH2CH2CH2OH(g) | CH3CH(OH)CH2OH(g) |
| 标准摩尔生成焓/(kJ/mol) | -171.8 | -241.8 | -464.9 | -485.7 |
(1)△H2=
 HOCH2CH2CH2OH(l)的熵变为△S1',则△S1
HOCH2CH2CH2OH(l)的熵变为△S1',则△S1(2)若向绝热恒容容器中加入CH2=CHCH2OH(g)和H2O(g),发生反应Ⅰ和Ⅱ,下列事实不能说明体系达到平衡状态的是_______(填选项字母)。
| A.容器内气体的压强不变 | B.容器内温度不变 |
| C.容器内气体的密度不变 | D.容器内气体的平均相对分子质量不变 |
(3)已知:反应的压强平衡常数(K)满足方程Kp=
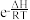 +C(e为自然对数的底数, R、C均为常数)。据此判断,下图所示曲线L1~L5中,能分别代表反应Ⅰ和Ⅱ的Kp与温度T关系的曲线为
+C(e为自然对数的底数, R、C均为常数)。据此判断,下图所示曲线L1~L5中,能分别代表反应Ⅰ和Ⅱ的Kp与温度T关系的曲线为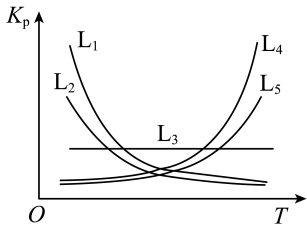
①该温度下,反应Ⅱ的压强平衡常数K=
②若其他条件不变,初始时不充入He(g),而是按1:1的体积比充入CH2=CHCH2OH(g)和H2O(g),达到新平衡时,H2O(g)的转化率将
(5)烯丙醇的电氧化过程有重要应用。其在阳极放电时,同时存在三种电极反应(烯丙醇→丙烯酸、烯丙醇→丙烯醛、烯丙醇→丙二酸),各反应决速步骤的活化能如下表所示。
| 反应 | 烯丙醇→丙烯酸 | 烯丙醇→丙烯醛 | 烯丙醇→丙二酸 |
| 活化能(单位:eV) | 8.6a | 2.5 a | 13.7a |
②碱性条件下,烯丙醇在电极上生成丙烯醛(CH2=CHCHO)的电极反应式为
您最近一年使用:0次
名校
2 . 环境科学研究发现, 也是一种温室效应气体,与
也是一种温室效应气体,与 相比,虽然
相比,虽然 在大气中的含量很低,增温潜势却是二氧化碳的298倍,对全球气候的增温效应在未来将越来越显著,已引起科学家的极大关注。
在大气中的含量很低,增温潜势却是二氧化碳的298倍,对全球气候的增温效应在未来将越来越显著,已引起科学家的极大关注。 的能量变化如上图所示,则无催化剂条件下该反应的逆反应的活化能为
的能量变化如上图所示,则无催化剂条件下该反应的逆反应的活化能为__________ ;在相同温度和压强下,1mol  和1mol CO经过相同反应时间测得如下实验数据:
和1mol CO经过相同反应时间测得如下实验数据:
试分析在相同温度时,催化剂2催化下 的转化率更高的原因是
的转化率更高的原因是___________ 。
(2)在容积均为1L的密闭容器A(起始500℃,恒温)、B(起始500℃,绝热)两个容器中分别加入0.1mol 、0.4mol CO和相同催化剂。实验测得A、B容器中
、0.4mol CO和相同催化剂。实验测得A、B容器中 的转化率随时间的变化关系如图所示:
的转化率随时间的变化关系如图所示: 的转化率随时间的变化关系是图中的
的转化率随时间的变化关系是图中的___________ 曲线(填“a”或“b”)。
②要缩短b曲线对应容器达到平衡的时间,但不改变 的平衡转化率,在催化剂一定的情况下可采取的措施是
的平衡转化率,在催化剂一定的情况下可采取的措施是___________ (答出一条即可)。
③500℃该反应的化学平衡常数K=___________ (用最简分数表示)。
④实验测定该反应的反应速率 ,
, ,
, 、
、 分别是正、逆反应速率常数,c为物质的量浓度,计算M处的
分别是正、逆反应速率常数,c为物质的量浓度,计算M处的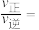
___________ (保留两位小数)。
 也是一种温室效应气体,与
也是一种温室效应气体,与 相比,虽然
相比,虽然 在大气中的含量很低,增温潜势却是二氧化碳的298倍,对全球气候的增温效应在未来将越来越显著,已引起科学家的极大关注。
在大气中的含量很低,增温潜势却是二氧化碳的298倍,对全球气候的增温效应在未来将越来越显著,已引起科学家的极大关注。
 的能量变化如上图所示,则无催化剂条件下该反应的逆反应的活化能为
的能量变化如上图所示,则无催化剂条件下该反应的逆反应的活化能为 和1mol CO经过相同反应时间测得如下实验数据:
和1mol CO经过相同反应时间测得如下实验数据:| 实验 | 温度/℃ | 催化剂 |  的转化率/% 的转化率/% |
| 实验1 | 400 | 催化剂1 | 9.5 |
| 400 | 催化剂2 | 10.6 | |
| 实验2 | 500 | 催化剂1 | 12.3 |
| 500 | 催化剂2 | 13.5 |
 的转化率更高的原因是
的转化率更高的原因是(2)在容积均为1L的密闭容器A(起始500℃,恒温)、B(起始500℃,绝热)两个容器中分别加入0.1mol
 、0.4mol CO和相同催化剂。实验测得A、B容器中
、0.4mol CO和相同催化剂。实验测得A、B容器中 的转化率随时间的变化关系如图所示:
的转化率随时间的变化关系如图所示:
 的转化率随时间的变化关系是图中的
的转化率随时间的变化关系是图中的②要缩短b曲线对应容器达到平衡的时间,但不改变
 的平衡转化率,在催化剂一定的情况下可采取的措施是
的平衡转化率,在催化剂一定的情况下可采取的措施是③500℃该反应的化学平衡常数K=
④实验测定该反应的反应速率
 ,
, ,
, 、
、 分别是正、逆反应速率常数,c为物质的量浓度,计算M处的
分别是正、逆反应速率常数,c为物质的量浓度,计算M处的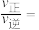
您最近一年使用:0次
名校
解题方法
3 . CO2催化加氢制烯烃(CnH2n)是缓解化石能源消耗、实现减排的重要途径之一。FT转化路径(CO2→CO→COnH2n)涉及的主要反应如下:
ⅰ. CO2(g)+H2(g)=CO(g)+H2O(g) ΔH1=41.1kJ·mol−1
ⅱ. nCO(g)+2nH2(g)=CnH2n(g)+nH2O(g) n=2时,ΔH2=-210.2kJ·mol−1
ⅲ. CO(g)+3H2(g)=CH4(g)+H2O(g) ΔH3=−205.9kJ·mol−1
(1)2CO2(g)+6H2(g)=C2H4(g)+4H2O(g) ΔH=_______ kJ·mol−1。
(2)有利于提高CO2平衡转化率的措施有_______(填标号)。
(3) n(CO2):n(H2)投料比为1:3、压力为1MPa时,无烷烃产物的平衡体系中CO2转化率和产物选择性随反应温度变化曲线如图。
①有利于短链烯烃(n≤4)生成的温度范围为_______ (填标号)。
A.373~573K B.573~773K C.773~973K D.973~1173K
②计算1083K时,反应ⅰ的Kp=_______ 。
③373~1273K范围内,CO2的转化率先降低后升高的原因是_______ 。
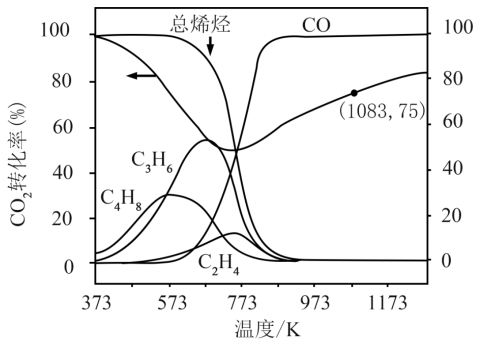
(4)FT转化路径存在CH4含量过高问题,我国科学家采用Cr2O3(SG)和H-SAPO-34复合催化剂极大提高短链烯烃选择性。CO2在催化剂Cr2O3 (SG)表面转化为甲醇的各步骤所需要克服的能垒及甲醇在H-SAPO-34作用下产生乙烯、丙烯示意图如下。
①吸附态用*表示,CO2→甲氧基(H3CO*)过程中,_______ 的生成是决速步骤(填化学式)。
②H-SAPO-34具有氧八元环构成的笼状结构(直径0.94nm),笼口为小的八环孔(直径0.38nm)。从结构角度推测,短链烯烃选择性性提高的原因_______ 。
ⅰ. CO2(g)+H2(g)=CO(g)+H2O(g) ΔH1=41.1kJ·mol−1
ⅱ. nCO(g)+2nH2(g)=CnH2n(g)+nH2O(g) n=2时,ΔH2=-210.2kJ·mol−1
ⅲ. CO(g)+3H2(g)=CH4(g)+H2O(g) ΔH3=−205.9kJ·mol−1
(1)2CO2(g)+6H2(g)=C2H4(g)+4H2O(g) ΔH=
(2)有利于提高CO2平衡转化率的措施有_______(填标号)。
| A.增大n(CO2):n(H2)投料比 | B.增大体系压强 |
| C.使用高效催化剂 | D.及时分离H2O |

①有利于短链烯烃(n≤4)生成的温度范围为
A.373~573K B.573~773K C.773~973K D.973~1173K
②计算1083K时,反应ⅰ的Kp=
③373~1273K范围内,CO2的转化率先降低后升高的原因是
(4)FT转化路径存在CH4含量过高问题,我国科学家采用Cr2O3(SG)和H-SAPO-34复合催化剂极大提高短链烯烃选择性。CO2在催化剂Cr2O3 (SG)表面转化为甲醇的各步骤所需要克服的能垒及甲醇在H-SAPO-34作用下产生乙烯、丙烯示意图如下。

①吸附态用*表示,CO2→甲氧基(H3CO*)过程中,
②H-SAPO-34具有氧八元环构成的笼状结构(直径0.94nm),笼口为小的八环孔(直径0.38nm)。从结构角度推测,短链烯烃选择性性提高的原因
您最近一年使用:0次
2022-03-04更新
|
825次组卷
|
2卷引用:福建省厦门市2022届高三毕业班第二次质量检测化学试题
解题方法
4 . 工业合成氨是人类科学技术的一项重大突破。
(1)已知:3H2(g)+N2(g) 2NH3(g) ΔH= -92.2 kJ/mol ,若起始时向容器内放入2mol N2和6 mol H2,达平衡时放出的热量为Q,则Q
2NH3(g) ΔH= -92.2 kJ/mol ,若起始时向容器内放入2mol N2和6 mol H2,达平衡时放出的热量为Q,则Q_______ 184.4kJ(填“>”“<”或“=”)。
(2)合成氨生产流程如图所示。
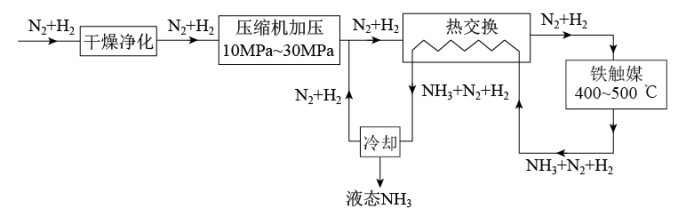
流程中,有利于提高原料利用率的措施是_______ (任写两种)。
(3)合成氨的反应条件研究:实验测定不同条件下,平衡时氨气的含量与起始氢氮比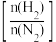 之间的关系如图所示。
之间的关系如图所示。
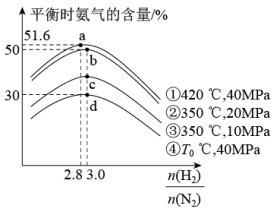
①T0_______ 420(填“>”“<”或“=”,下同)。
②d点时的转化率:α(N2)_______ α(H2)。
③a、b、c三点对应平衡常数的大小关系为_______ (用 Ka、Kb、Kc表示)。
④p(N2)、p(H2)、p( NH3)分别代表N2、H2、NH3的分压,Kp代表压力平衡常数(用平衡时的分压代替平衡时的浓度表示),一定条件下,上述合成氨反应接近平衡时,遵循如下方程: v(NH3)=k正×p(N2) 。其中v(NH3)为氨合成反应的净速率(即正逆反应速率差),a为常数,与催化剂性质及反应条件有关, k正、k逆为速率常数,该条件下,实验测得a =0.5,则反应达到平衡时,k正、k逆、Kp三者的关系式为
。其中v(NH3)为氨合成反应的净速率(即正逆反应速率差),a为常数,与催化剂性质及反应条件有关, k正、k逆为速率常数,该条件下,实验测得a =0.5,则反应达到平衡时,k正、k逆、Kp三者的关系式为_______ 。
(4)可用作合成氨的催化剂有很多,如Os、Fe、Pt、Mn、Co等金属及相应的合金或化合物。该反应在LaCoSi催化作用的化学吸附及初步表面反应历程如下:

注:方框内包含微粒种类及个数、微粒的相对总能量(括号里数字的单位:eV)其中,TS表示过渡态,*表示吸附态。
①请写出N2参与化学吸附的反应方程式_______ 。
②以上历程须克服的最大势垒为_______ kJ/mol(列出计算式)。(已知:1 eV=1.6 ×10-22 kJ)
(1)已知:3H2(g)+N2(g)
 2NH3(g) ΔH= -92.2 kJ/mol ,若起始时向容器内放入2mol N2和6 mol H2,达平衡时放出的热量为Q,则Q
2NH3(g) ΔH= -92.2 kJ/mol ,若起始时向容器内放入2mol N2和6 mol H2,达平衡时放出的热量为Q,则Q(2)合成氨生产流程如图所示。

流程中,有利于提高原料利用率的措施是
(3)合成氨的反应条件研究:实验测定不同条件下,平衡时氨气的含量与起始氢氮比
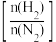 之间的关系如图所示。
之间的关系如图所示。
①T0
②d点时的转化率:α(N2)
③a、b、c三点对应平衡常数的大小关系为
④p(N2)、p(H2)、p( NH3)分别代表N2、H2、NH3的分压,Kp代表压力平衡常数(用平衡时的分压代替平衡时的浓度表示),一定条件下,上述合成氨反应接近平衡时,遵循如下方程: v(NH3)=k正×p(N2)
 。其中v(NH3)为氨合成反应的净速率(即正逆反应速率差),a为常数,与催化剂性质及反应条件有关, k正、k逆为速率常数,该条件下,实验测得a =0.5,则反应达到平衡时,k正、k逆、Kp三者的关系式为
。其中v(NH3)为氨合成反应的净速率(即正逆反应速率差),a为常数,与催化剂性质及反应条件有关, k正、k逆为速率常数,该条件下,实验测得a =0.5,则反应达到平衡时,k正、k逆、Kp三者的关系式为(4)可用作合成氨的催化剂有很多,如Os、Fe、Pt、Mn、Co等金属及相应的合金或化合物。该反应在LaCoSi催化作用的化学吸附及初步表面反应历程如下:

注:方框内包含微粒种类及个数、微粒的相对总能量(括号里数字的单位:eV)其中,TS表示过渡态,*表示吸附态。
①请写出N2参与化学吸附的反应方程式
②以上历程须克服的最大势垒为
您最近一年使用:0次
名校
5 . 山东“十四五”规划提出“推动绿色发展,绘就绿水青山齐鲁画卷”。CO2加氢可缓解CO2带来的环境压力,同时带来巨大的经济效益。CO2加氢过程,主要发生的三个竞争反应为:
反应Ⅰ:
反应Ⅱ:

反应Ⅲ:

回答下列问题:
(1)①由CO、H2合成甲醇的热化学方程式为_______ 。
②相同时间内,在不同催化剂下用CO2和H2合成甲醇(其他条件均相同),CO2的转化率随温度变化如图所示,其中活化能最低的反应所用的催化剂是催化剂_______ (填“A”、“B”或“C”)。
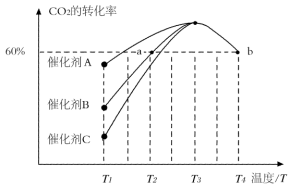
③在 催化剂表面上反应Ⅱ的前三步反应历程如图所示(吸附在
催化剂表面上反应Ⅱ的前三步反应历程如图所示(吸附在 催化剂表面用“·”标注,
催化剂表面用“·”标注, 表示过渡态),则物质吸附在催化剂表面,形成过渡态的过程会
表示过渡态),则物质吸附在催化剂表面,形成过渡态的过程会_______ (填“放出热量”或“吸收热量”),反应历程中最小能垒(活化能)步骤的化学方程式为_______ 。

(2)我国科学家研究了不同反应温度对含碳产物组成的影响。在反应器中按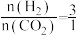 通入
通入 和
和 ,分别在
,分别在 和
和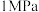 下进行反应。实验中温度对平衡组成体系的(
下进行反应。实验中温度对平衡组成体系的( 、
、 、
、 )三种物质分析,其
)三种物质分析,其 和
和 的影响如下图所示(该反应条件下甲醇产量极低,因此忽略“反应Ⅰ”,只考虑反应Ⅱ和反应Ⅲ)。
的影响如下图所示(该反应条件下甲醇产量极低,因此忽略“反应Ⅰ”,只考虑反应Ⅱ和反应Ⅲ)。

①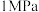 时,表示
时,表示 和
和 平衡组成随温度变化关系的曲线分别是
平衡组成随温度变化关系的曲线分别是_______ 、_______ 。 点平衡组成含量高于
点平衡组成含量高于 点的原因是
点的原因是_______ 。
②当 和
和 平衡组成均为
平衡组成均为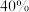 时,该温度下反应Ⅲ的平衡常数
时,该温度下反应Ⅲ的平衡常数 为
为_______ 。
(3) 超干重整
超干重整 得到的
得到的 经偶联反应可制得
经偶联反应可制得 (草酸)。在水溶液中
(草酸)。在水溶液中 、
、 和
和 物质的量分数与
物质的量分数与 关系如图所示,则c点溶液
关系如图所示,则c点溶液
_______ 。
反应Ⅰ:

反应Ⅱ:


反应Ⅲ:


回答下列问题:
(1)①由CO、H2合成甲醇的热化学方程式为
②相同时间内,在不同催化剂下用CO2和H2合成甲醇(其他条件均相同),CO2的转化率随温度变化如图所示,其中活化能最低的反应所用的催化剂是催化剂

③在
 催化剂表面上反应Ⅱ的前三步反应历程如图所示(吸附在
催化剂表面上反应Ⅱ的前三步反应历程如图所示(吸附在 催化剂表面用“·”标注,
催化剂表面用“·”标注, 表示过渡态),则物质吸附在催化剂表面,形成过渡态的过程会
表示过渡态),则物质吸附在催化剂表面,形成过渡态的过程会
(2)我国科学家研究了不同反应温度对含碳产物组成的影响。在反应器中按
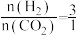 通入
通入 和
和 ,分别在
,分别在 和
和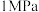 下进行反应。实验中温度对平衡组成体系的(
下进行反应。实验中温度对平衡组成体系的( 、
、 、
、 )三种物质分析,其
)三种物质分析,其 和
和 的影响如下图所示(该反应条件下甲醇产量极低,因此忽略“反应Ⅰ”,只考虑反应Ⅱ和反应Ⅲ)。
的影响如下图所示(该反应条件下甲醇产量极低,因此忽略“反应Ⅰ”,只考虑反应Ⅱ和反应Ⅲ)。
①
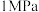 时,表示
时,表示 和
和 平衡组成随温度变化关系的曲线分别是
平衡组成随温度变化关系的曲线分别是 点平衡组成含量高于
点平衡组成含量高于 点的原因是
点的原因是②当
 和
和 平衡组成均为
平衡组成均为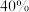 时,该温度下反应Ⅲ的平衡常数
时,该温度下反应Ⅲ的平衡常数 为
为(3)
 超干重整
超干重整 得到的
得到的 经偶联反应可制得
经偶联反应可制得 (草酸)。在水溶液中
(草酸)。在水溶液中 、
、 和
和 物质的量分数与
物质的量分数与 关系如图所示,则c点溶液
关系如图所示,则c点溶液

您最近一年使用:0次
2021-01-07更新
|
624次组卷
|
3卷引用:山东省济宁市2021届高三上学期期末考试化学试题
名校
解题方法
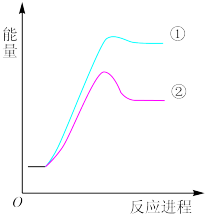
6 . 丙烷与溴原子能发生以下两种反应:
① CH3CH2CH3(g) + Br·(g) → CH3CH2CH2·(g) + HBr(g)
② CH3CH2CH3(g) + Br·(g) → CH3CH·CH3 (g) + HBr(g)
反应过程的能量变化如图所示。下列说法正确的是
① CH3CH2CH3(g) + Br·(g) → CH3CH2CH2·(g) + HBr(g)
② CH3CH2CH3(g) + Br·(g) → CH3CH·CH3 (g) + HBr(g)
反应过程的能量变化如图所示。下列说法正确的是

| A.反应①是放热反应 |
| B.反应②使用了催化剂 |
| C.产物中 CH3CH2CH2·(g)含量比 CH3CH·CH3(g)低 |
| D.CH3CH2CH2·(g)转变为 CH3CH·CH3(g)时需要吸热 |
您最近一年使用:0次
2020-12-23更新
|
2367次组卷
|
9卷引用:上海市闵行区2021届高三一模化学试题
上海市闵行区2021届高三一模化学试题(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)黑龙江省大庆市实验中学2021-2022学年高三上学期开学考试化学试题2021年辽宁高考化学试题变式题11-19上海市徐汇区2023届高三一模化学试题(已下线)专题12 反应机理和能量变化



