名校
1 . 已知 ,在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注,
,在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注, 为过渡态)。
为过渡态)。
 ,在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注,
,在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注, 为过渡态)。
为过渡态)。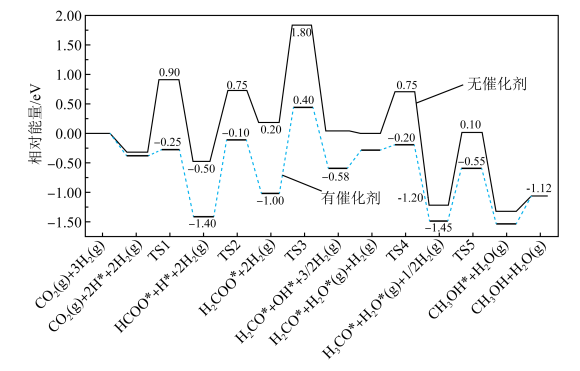
A. |
B.无催化剂时,决速步骤的方程式为 |
| C.使用催化剂,降低了反应的活化能和焓变 |
| D.该反应在低温下易自发进行 |
您最近一年使用:0次
昨日更新
|
51次组卷
|
2卷引用:2024届海南省琼海市嘉积中学高三下学期模拟预测化学试题
名校
2 . 湖南大学课题组研究钴催化腈与胺电氢化的反应机理如下图所示(其中Ph表示苯基, 表示
表示 ),下列说法错误的是
),下列说法错误的是
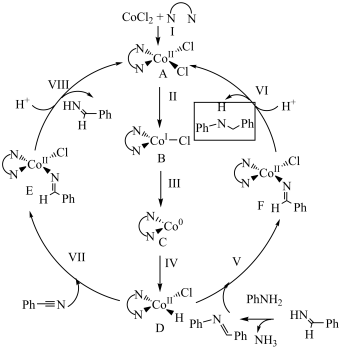
A. 是反应的中间产物 是反应的中间产物 |
B.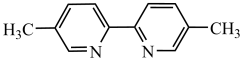 中所有碳原子可能共平面 中所有碳原子可能共平面 |
| C.所涉及Co的配合物中,Co的配位数不同,N的杂化方式不相同 |
D.该反应的总方程式为Ph—≡N+PhNH2+4H++4e-  +NH3 +NH3 |
您最近一年使用:0次
昨日更新
|
112次组卷
|
3卷引用:黑龙江省大庆市实验中学实验二部2023-2024学年高三下学期得分训练化学试题(五)
名校
3 . PtNiFe—LDHGO催化甲醛氧化的反应机理如图:
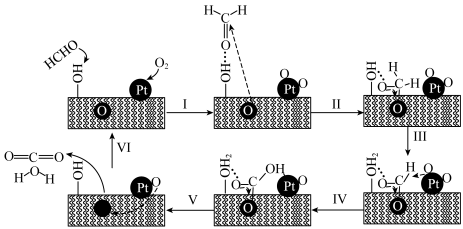
A.步骤Ⅰ中甲醛通过氢键吸附在催化剂表面的 上 上 |
| B.上述反应机理涉及极性键和非极性键的形成 |
C.该反应每生成1 mol ,转移电子的数目约为 ,转移电子的数目约为 |
| D.PtNiFe—LDHGO降低了该反应的活化能 |
您最近一年使用:0次
7日内更新
|
288次组卷
|
2卷引用:江苏省南通市海安高级中学2024届高三下学期第二次模拟考试化学试题
4 . 甲烷是非常重要的化工原料,利用甲烷催化重整技术可制备多种化工品和能源品。回答下列问题:
(1)现有甲烷、水蒸气催化重整制氢工艺: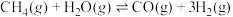
 ,此反应分两步进行,第I步和第Ⅱ步的反应原理如下,反应的
,此反应分两步进行,第I步和第Ⅱ步的反应原理如下,反应的 关系如图1所示。
关系如图1所示。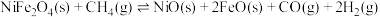

Ⅱ.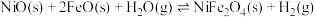

1000℃时,反应 的平衡常数
的平衡常数
___________ 。
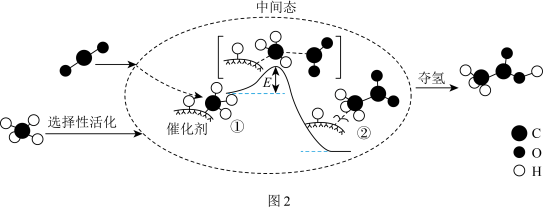
(2)一种甲烷和二氧化碳的共转化催化反应历程如图2所示:
根据上述信息,写出该催化反应的热化学方程式:___________ 。
(3)某研究团队认为甲烷催化制甲酸的转化过程如图3所示:___________ 。
②已知上述步骤Ⅱ反应的 。一定温度下,向10L恒容密闭钢瓶中充入1mol
。一定温度下,向10L恒容密闭钢瓶中充入1mol (g)和1mol
(g)和1mol (g),在催化剂作用下发生步骤Ⅱ的反应。10min末达到平衡,测得钢瓶中
(g),在催化剂作用下发生步骤Ⅱ的反应。10min末达到平衡,测得钢瓶中 (g)的物质的量为0.6mol。0~10min内,平均反应速率
(g)的物质的量为0.6mol。0~10min内,平均反应速率
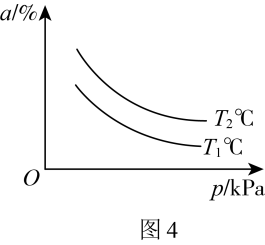
___________ 。改变条件重复实验,测得 的平衡转化率(
的平衡转化率( )与温度(T)和压强(p)的关系如图4所示,则
)与温度(T)和压强(p)的关系如图4所示,则
___________ (填“ ”“
”“ ”或“
”或“ ”)
”) 。
。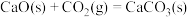
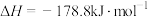 。500℃时,
。500℃时, 与水蒸气重整制氢时主要发生的反应有:
与水蒸气重整制氢时主要发生的反应有: ,
, ,实际生产中可向重整反应体系中加入适量多孔CaO,理由是
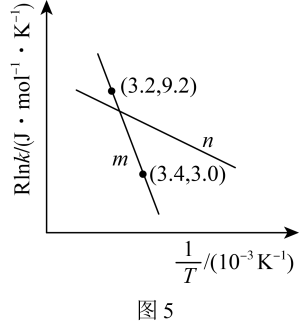
,实际生产中可向重整反应体系中加入适量多孔CaO,理由是___________ 。在m和n两种催化剂作用下,反应 的阿伦尼乌斯经验公式实验数据如图5所示,已知阿伦尼乌斯经验公式
的阿伦尼乌斯经验公式实验数据如图5所示,已知阿伦尼乌斯经验公式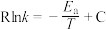 (
( 为活化能,k为速率常数,R和C为常数),m和n两种催化剂中对该反应催化效果较差的是
为活化能,k为速率常数,R和C为常数),m和n两种催化剂中对该反应催化效果较差的是___________ ,用m作催化剂时,该反应的活化能为___________  。
。
(1)现有甲烷、水蒸气催化重整制氢工艺:
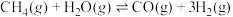
 ,此反应分两步进行,第I步和第Ⅱ步的反应原理如下,反应的
,此反应分两步进行,第I步和第Ⅱ步的反应原理如下,反应的 关系如图1所示。
关系如图1所示。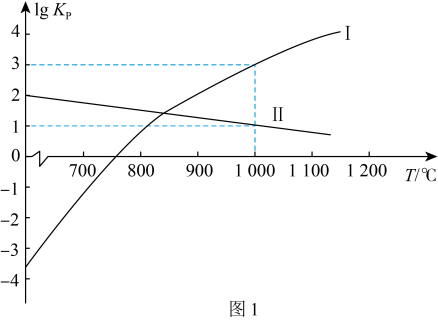
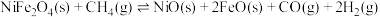

Ⅱ.
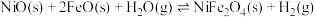

1000℃时,反应
 的平衡常数
的平衡常数
(2)一种甲烷和二氧化碳的共转化催化反应历程如图2所示:
| 共价键 | C—H | 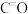 | O—H | C—O | C—C |
键能( ) ) | 413 | 497 | 462 | 351 | 348 |
(3)某研究团队认为甲烷催化制甲酸的转化过程如图3所示:
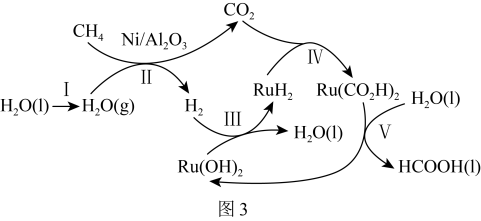
②已知上述步骤Ⅱ反应的
 。一定温度下,向10L恒容密闭钢瓶中充入1mol
。一定温度下,向10L恒容密闭钢瓶中充入1mol (g)和1mol
(g)和1mol (g),在催化剂作用下发生步骤Ⅱ的反应。10min末达到平衡,测得钢瓶中
(g),在催化剂作用下发生步骤Ⅱ的反应。10min末达到平衡,测得钢瓶中 (g)的物质的量为0.6mol。0~10min内,平均反应速率
(g)的物质的量为0.6mol。0~10min内,平均反应速率
 的平衡转化率(
的平衡转化率( )与温度(T)和压强(p)的关系如图4所示,则
)与温度(T)和压强(p)的关系如图4所示,则
 ”“
”“ ”或“
”或“ ”)
”) 。
。
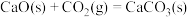
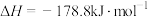 。500℃时,
。500℃时, 与水蒸气重整制氢时主要发生的反应有:
与水蒸气重整制氢时主要发生的反应有: ,
, ,实际生产中可向重整反应体系中加入适量多孔CaO,理由是
,实际生产中可向重整反应体系中加入适量多孔CaO,理由是 的阿伦尼乌斯经验公式实验数据如图5所示,已知阿伦尼乌斯经验公式
的阿伦尼乌斯经验公式实验数据如图5所示,已知阿伦尼乌斯经验公式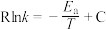 (
( 为活化能,k为速率常数,R和C为常数),m和n两种催化剂中对该反应催化效果较差的是
为活化能,k为速率常数,R和C为常数),m和n两种催化剂中对该反应催化效果较差的是 。
。
您最近一年使用:0次
7日内更新
|
74次组卷
|
3卷引用:2024届河北省保定市唐县第一中学高三下学期二模化学试题
5 . “碳达峰·碳中和”是我国社会发展重大战略之一, 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应有:
是实现“双碳”经济的有效途径之一,相关的主要反应有:
反应1:

反应2:

请回答下列问题:
(1)
 ,该反应正反应的活化能
,该反应正反应的活化能___________  (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。
(2)恒压、 时,
时, 和
和 按物质的量之比
按物质的量之比 投料,反应经如下流程(主要产物已标出)可实现
投料,反应经如下流程(主要产物已标出)可实现 的高效转化。
的高效转化。 需吸收的能量为
需吸收的能量为___________ 。
②过程 平衡后通入
平衡后通入 ,一段时间内
,一段时间内 的物质的量
的物质的量___________ (填“增大”“减小”或“不变”)。
(3)将 与
与 在
在 恒容密闭容器中反应制取
恒容密闭容器中反应制取 和
和 时,发生反应1和反应
时,发生反应1和反应 ,
, 和
和 的平衡转化率随温度变化的关系如图所示。
的平衡转化率随温度变化的关系如图所示。___________ (填“ ”或“
”或“ ”)代表
”)代表 的平衡转化率。
的平衡转化率。
②计算 时反应1的化学平衡常数
时反应1的化学平衡常数
___________ (计算结果保留两位小数)。
③ 还原能力
还原能力 可衡量
可衡量 的转化效率,
的转化效率, (同一时段内
(同一时段内 与
与 的物质的量变化量之比),从平衡移动的角度分析,随着温度升高,
的物质的量变化量之比),从平衡移动的角度分析,随着温度升高, 值逐渐减小直至近似等于1的可能原因是
值逐渐减小直至近似等于1的可能原因是___________ 。
④催化剂 可提高
可提高 值,常压下
值,常压下 和
和 按物质的量之比
按物质的量之比 投料,某一段时间内
投料,某一段时间内 的转化率、
的转化率、 值随温度变化如下表:
值随温度变化如下表:
下列说法正确的是___________ (填标号)。
A. 值提高是由于催化剂
值提高是由于催化剂 选择性地提高反应2的速率
选择性地提高反应2的速率
B.温度越低,含氢产物中 占比越低
占比越低
C.温度升高, 的转化率增加,
的转化率增加, 的转化率降低,
的转化率降低, 值减小
值减小
D.改变催化剂可提高平衡时的 值
值
 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应有:
是实现“双碳”经济的有效途径之一,相关的主要反应有:反应1:


反应2:


请回答下列问题:
(1)

 ,该反应正反应的活化能
,该反应正反应的活化能 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。(2)恒压、
 时,
时, 和
和 按物质的量之比
按物质的量之比 投料,反应经如下流程(主要产物已标出)可实现
投料,反应经如下流程(主要产物已标出)可实现 的高效转化。
的高效转化。
 需吸收的能量为
需吸收的能量为②过程
 平衡后通入
平衡后通入 ,一段时间内
,一段时间内 的物质的量
的物质的量(3)将
 与
与 在
在 恒容密闭容器中反应制取
恒容密闭容器中反应制取 和
和 时,发生反应1和反应
时,发生反应1和反应 ,
, 和
和 的平衡转化率随温度变化的关系如图所示。
的平衡转化率随温度变化的关系如图所示。
 ”或“
”或“ ”)代表
”)代表 的平衡转化率。
的平衡转化率。②计算
 时反应1的化学平衡常数
时反应1的化学平衡常数
③
 还原能力
还原能力 可衡量
可衡量 的转化效率,
的转化效率, (同一时段内
(同一时段内 与
与 的物质的量变化量之比),从平衡移动的角度分析,随着温度升高,
的物质的量变化量之比),从平衡移动的角度分析,随着温度升高, 值逐渐减小直至近似等于1的可能原因是
值逐渐减小直至近似等于1的可能原因是④催化剂
 可提高
可提高 值,常压下
值,常压下 和
和 按物质的量之比
按物质的量之比 投料,某一段时间内
投料,某一段时间内 的转化率、
的转化率、 值随温度变化如下表:
值随温度变化如下表:温度 | 480 | 500 | 520 | 550 |
 转化率 转化率 | 7.9 | 11.5 | 20.2 | 34.8 |
 | 2.6 | 2.4 | 2.1 | 1.8 |
A.
 值提高是由于催化剂
值提高是由于催化剂 选择性地提高反应2的速率
选择性地提高反应2的速率B.温度越低,含氢产物中
 占比越低
占比越低C.温度升高,
 的转化率增加,
的转化率增加, 的转化率降低,
的转化率降低, 值减小
值减小D.改变催化剂可提高平衡时的
 值
值
您最近一年使用:0次
名校
6 . 含 的溶液中发生反应的反应机理如图所示。下列说法正确的是
的溶液中发生反应的反应机理如图所示。下列说法正确的是
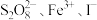 的溶液中发生反应的反应机理如图所示。下列说法正确的是
的溶液中发生反应的反应机理如图所示。下列说法正确的是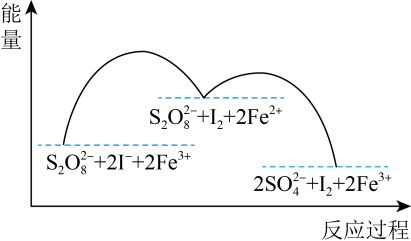
A.由图可知 不能氧化 不能氧化 |
| B.反应过程中包含三个基元反应 |
C.若不加 ,该反应的化学反应速率更大 ,该反应的化学反应速率更大 |
D. 和 和 不能大量共存 不能大量共存 |
您最近一年使用:0次
7日内更新
|
68次组卷
|
2卷引用:2024届河北省部分高中高三下学期二模化学试题
名校
7 . 相同条件下,测得以下三个反应的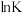 与
与 数据如下:
数据如下:
反应①:
反应②:
反应③:
关于以上三个反应的说法正确的是
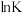 与
与 数据如下:
数据如下:反应①:

反应②:

反应③:

关于以上三个反应的说法正确的是
| A.反应①、反应②、反应③均为氧化还原反应 |
B.其他条件不变时,增大压强,反应②的v(正)、v(逆)以及 均增大 均增大 |
C.反应③的活化能: (逆) (逆) (正) (正) |
D.反应②与反应③的反应热的比值: |
您最近一年使用:0次
8 . 工业生产 过程中发生反应
过程中发生反应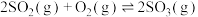 。下列说法正确的是
。下列说法正确的是
 过程中发生反应
过程中发生反应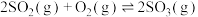 。下列说法正确的是
。下列说法正确的是A.反应的平衡常数 |
B.该反应 、 、 |
| C.使用合适的催化剂,可以降低反应的活化能,加快反应速率 |
D.上述反应中每消耗1mol  ,转移电子的数目约为 ,转移电子的数目约为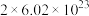 |
您最近一年使用:0次
名校
解题方法
9 . CO2和H2在某催化剂表面合成CH3OH: △H,反应历程如图1所示,其中吸附在催化剂表面上的物种用*标注。△G随温度关系如图2所示。
△H,反应历程如图1所示,其中吸附在催化剂表面上的物种用*标注。△G随温度关系如图2所示。
 △H,反应历程如图1所示,其中吸附在催化剂表面上的物种用*标注。△G随温度关系如图2所示。
△H,反应历程如图1所示,其中吸附在催化剂表面上的物种用*标注。△G随温度关系如图2所示。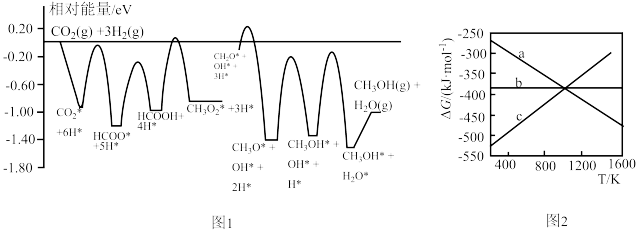
| A.该历程中的基元反应全部是放热反应 |
| B.图2中表示该反应△G随温度的变化的是直线a |
C.该反应历程中活化能最小的基元反应是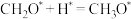 |
D. 过程中发生非极性键的断裂和生成 过程中发生非极性键的断裂和生成 |
您最近一年使用:0次
解题方法
10 . 催化剂在反应中能够改变反应历程,即改变反应速率。 在催化剂(
在催化剂(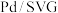 )上还原NO生成
)上还原NO生成 和
和 的机理及活化能(
的机理及活化能( )如图所示。下列说法正确的是
)如图所示。下列说法正确的是
 在催化剂(
在催化剂(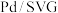 )上还原NO生成
)上还原NO生成 和
和 的机理及活化能(
的机理及活化能( )如图所示。下列说法正确的是
)如图所示。下列说法正确的是
A. 还原NO生成 还原NO生成 过程中,速率最慢的步骤为⑦ 过程中,速率最慢的步骤为⑦ |
B.在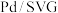 催化剂上,NO被 催化剂上,NO被 还原为 还原为 比还原为 比还原为 更容易 更容易 |
C.决定NO生成 速率的基元反应为 速率的基元反应为 |
D.生成 的各基元反应中,N元素均被还原 的各基元反应中,N元素均被还原 |
您最近一年使用:0次
7日内更新
|
139次组卷
|
2卷引用:2024届辽宁省部分学校高三下学期联考三模化学试题



