解题方法
1 . 利用甲烷制取氢气等气体是科学家研究的热点课题。
(1)一定条件下, 分解反应
分解反应 的部分反应历程如下图所示。
的部分反应历程如下图所示。
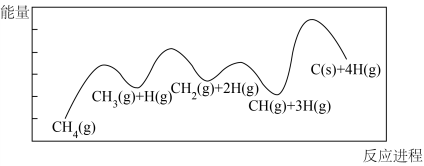
①该历程图表示___________ 步反应,其中正反应活化能最大步骤的反应方程式为___________ 。
② 分解反应
分解反应___________ 。
A.高温下能自发进行 B.低温下能自发进行
C.任何温度都能自发进行 D.任何温度都不能自发进行
(2)科学家提出以吸附性活性炭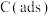 为催化剂,利用
为催化剂,利用 与
与 制备“合成气”(
制备“合成气”( 、
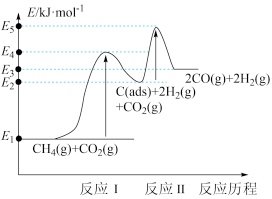
、 )。其反应历程分两步,反应历程的能量变化如下图:
)。其反应历程分两步,反应历程的能量变化如下图:
反应Ⅰ: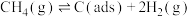 (慢反应)
(慢反应)
反应Ⅱ: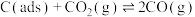 (快反应)
(快反应)
①加入活性炭C(ads)使该反应的活化能___________ (填“升高”“降低”或“不变”)。
② 与
与 制备“合成气”的反应为
制备“合成气”的反应为___________ 反应(填“放热”或“吸热”),其热化学方程式为___________ ( 用
用 表示),能量变化图中:
表示),能量变化图中:
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(1)一定条件下,
 分解反应
分解反应 的部分反应历程如下图所示。
的部分反应历程如下图所示。
①该历程图表示
②
 分解反应
分解反应A.高温下能自发进行 B.低温下能自发进行
C.任何温度都能自发进行 D.任何温度都不能自发进行
(2)科学家提出以吸附性活性炭
 为催化剂,利用
为催化剂,利用 与
与 制备“合成气”(
制备“合成气”( 、
、 )。其反应历程分两步,反应历程的能量变化如下图:
)。其反应历程分两步,反应历程的能量变化如下图:
反应Ⅰ:
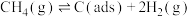 (慢反应)
(慢反应)反应Ⅱ:
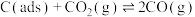 (快反应)
(快反应)①加入活性炭C(ads)使该反应的活化能
②
 与
与 制备“合成气”的反应为
制备“合成气”的反应为 用
用 表示),能量变化图中:
表示),能量变化图中:
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
名校
解题方法
2 . 自科学家们开始研究物质的结构与性质以来,氢元素时常担任主角,例如氢原子光谱启发了人们对原子结构的探索。此外,氢气与氢能源也是时下热门的一种绿色能源。氢能是最具发展潜力的清洁能源,但当下的生产条件非常苛刻且纯度不高。因此,科学家们正在寻找更经济、环境友好的方法,电解水便是其中一种。
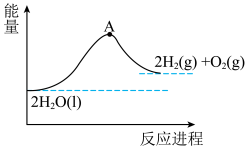
(1)已知在298K和100kPa的条件下,液态水分解生成氢气: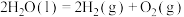
 。下图为该反应的能量变化示意图,而在实际生产生活中常会使用催化剂,例如
。下图为该反应的能量变化示意图,而在实际生产生活中常会使用催化剂,例如 ,那么图中A点将
,那么图中A点将___________ (填“升高”、“降低”或“不变”)。
(2)部分化学键的键能和反应焓变的数据如下:
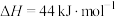 ,
, ,
,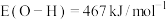 ,
,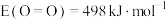 ,由此可计算得上述反应的
,由此可计算得上述反应的 为
为___________ 。又知该反应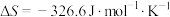 ,那么该反应在298K条件下能否自发进行?
,那么该反应在298K条件下能否自发进行?___________ 。
(3)试从绿色化学的角度比较并评价直接电解海水与太阳能( 作催化剂)分解淡水两种制备氢气的方案
作催化剂)分解淡水两种制备氢气的方案___________ 。
(1)已知在298K和100kPa的条件下,液态水分解生成氢气:
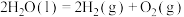
 。下图为该反应的能量变化示意图,而在实际生产生活中常会使用催化剂,例如
。下图为该反应的能量变化示意图,而在实际生产生活中常会使用催化剂,例如 ,那么图中A点将
,那么图中A点将
(2)部分化学键的键能和反应焓变的数据如下:

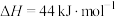 ,
, ,
,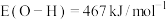 ,
,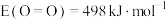 ,由此可计算得上述反应的
,由此可计算得上述反应的 为
为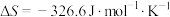 ,那么该反应在298K条件下能否自发进行?
,那么该反应在298K条件下能否自发进行?(3)试从绿色化学的角度比较并评价直接电解海水与太阳能(
 作催化剂)分解淡水两种制备氢气的方案
作催化剂)分解淡水两种制备氢气的方案
您最近一年使用:0次
名校
3 . 已知正丁烷和异丁烷可以相互转化: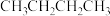 (g,正丁烷)
(g,正丁烷) (
( ,异丁烷)。在恒容密闭容器中充入正丁烷发生异构化反应,正丁烷浓度
,异丁烷)。在恒容密闭容器中充入正丁烷发生异构化反应,正丁烷浓度 随时间
随时间 的变化曲线如图所示(图中
的变化曲线如图所示(图中 为温度)。已知:速率方程式为
为温度)。已知:速率方程式为 (
( 为速率常数,与温度、催化剂等有关,与浓度无关),
为速率常数,与温度、催化剂等有关,与浓度无关), 点反应速率相等,即
点反应速率相等,即 。
。

回答下列问题:
(1)bf段平均反应速率
___________ mol∙L-1∙min-1。
(2)
___________  (填“>”“<”或“=”),判断依据是
(填“>”“<”或“=”),判断依据是___________ 。
(3)活化分子总数:
___________  (填“>”“<”或“=”),判断依据是
(填“>”“<”或“=”),判断依据是___________ 。
(4)
___________ 。
(5)速率常数:
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
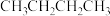 (g,正丁烷)
(g,正丁烷) (
( ,异丁烷)。在恒容密闭容器中充入正丁烷发生异构化反应,正丁烷浓度
,异丁烷)。在恒容密闭容器中充入正丁烷发生异构化反应,正丁烷浓度 随时间
随时间 的变化曲线如图所示(图中
的变化曲线如图所示(图中 为温度)。已知:速率方程式为
为温度)。已知:速率方程式为 (
( 为速率常数,与温度、催化剂等有关,与浓度无关),
为速率常数,与温度、催化剂等有关,与浓度无关), 点反应速率相等,即
点反应速率相等,即 。
。
回答下列问题:
(1)bf段平均反应速率

(2)

 (填“>”“<”或“=”),判断依据是
(填“>”“<”或“=”),判断依据是(3)活化分子总数:

 (填“>”“<”或“=”),判断依据是
(填“>”“<”或“=”),判断依据是(4)

(5)速率常数:

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
您最近一年使用:0次
2023-12-01更新
|
41次组卷
|
2卷引用:海南省海南华侨中学 海南省农垦中学2023-2024学年高二上学期11月学业水平测试期中联考化学试题
解题方法
4 .  在一定条件下发生反应的能量变化如图所示,请根据所学知识回答下列问题:
在一定条件下发生反应的能量变化如图所示,请根据所学知识回答下列问题:
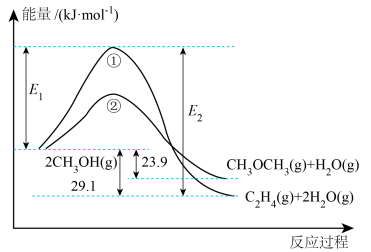
(1)写出图中所示反应①、反应②的热化学方程式:___________ 、___________ 。
(2) 为反应
为反应___________ (填“①”或“②”)___________ (填“正”或“逆”)反应的活化能。由图可知,若在一定条件下,某容器中同时发生反应①、反应②,则开始时,___________ [填“ ”或“
”或“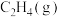 ”]的生成速率快。
”]的生成速率快。
(3) 与
与 为
为___________ (填“同素异形体”、“同分异构体”或“同系物”)。
(4)若 同时发生反应①、反应②,当
同时发生反应①、反应②,当 完全转化为
完全转化为 和
和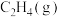 后,测得反应放出的总热量为
后,测得反应放出的总热量为 。则反应产物中
。则反应产物中 和
和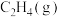 的物质的量分别为
的物质的量分别为___________ mol、___________ mol。
 在一定条件下发生反应的能量变化如图所示,请根据所学知识回答下列问题:
在一定条件下发生反应的能量变化如图所示,请根据所学知识回答下列问题:
(1)写出图中所示反应①、反应②的热化学方程式:
(2)
 为反应
为反应 ”或“
”或“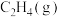 ”]的生成速率快。
”]的生成速率快。(3)
 与
与 为
为(4)若
 同时发生反应①、反应②,当
同时发生反应①、反应②,当 完全转化为
完全转化为 和
和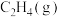 后,测得反应放出的总热量为
后,测得反应放出的总热量为 。则反应产物中
。则反应产物中 和
和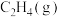 的物质的量分别为
的物质的量分别为
您最近一年使用:0次
2023-11-19更新
|
130次组卷
|
2卷引用:广东省湛江市2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
5 . 甲醇水蒸气催化重整是当前制取清洁能源氢气的主要方法,其原理为:CH3OH(g) + H2O(g) CO2(g) + 3H2(g) ΔH,该反应历程如下,写出决速步的化学方程式
CO2(g) + 3H2(g) ΔH,该反应历程如下,写出决速步的化学方程式___________ 。
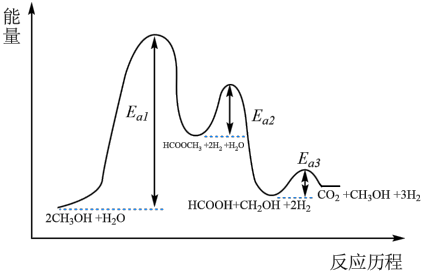
 CO2(g) + 3H2(g) ΔH,该反应历程如下,写出决速步的化学方程式
CO2(g) + 3H2(g) ΔH,该反应历程如下,写出决速步的化学方程式
您最近一年使用:0次
6 .  、
、 都是大气污染物。请回答下列有关问题:
都是大气污染物。请回答下列有关问题:
(1)碘循环工艺能吸收 ,降低环境污染,同时又能制得氢气,反应过程如下图:
,降低环境污染,同时又能制得氢气,反应过程如下图:_______ ,氧化剂与还原剂的物质的量之比为_______ ,反应温度控制在20~100℃的原因是_______ 。
②若有196g 生成,理论上产生氢气的体积为
生成,理论上产生氢气的体积为_______ L(标准状况)。
(2)工业上用 溶液吸收
溶液吸收 ,生成等物质的量的两种钠盐,其中一种为
,生成等物质的量的两种钠盐,其中一种为 ,同时还有一种气体生成,则该反应的离子方程式为
,同时还有一种气体生成,则该反应的离子方程式为_______ 。
(3)工业上脱出 ,也可以在加热和催化剂作用下用
,也可以在加热和催化剂作用下用 还原生成
还原生成 和
和 ,实验测得温度高于400℃时,
,实验测得温度高于400℃时, 脱出率减小,其原因可能是
脱出率减小,其原因可能是_______ 。
(4)工业上可用 吸收含
吸收含 的烟气得到
的烟气得到 ,将50.7g
,将50.7g 受热分解,分解过程中的热重曲线(固体质量随温度变化的曲线)如图所示。
受热分解,分解过程中的热重曲线(固体质量随温度变化的曲线)如图所示。_______ 。
②1160℃时,所得固体的化学式为_______ 。
 、
、 都是大气污染物。请回答下列有关问题:
都是大气污染物。请回答下列有关问题:(1)碘循环工艺能吸收
 ,降低环境污染,同时又能制得氢气,反应过程如下图:
,降低环境污染,同时又能制得氢气,反应过程如下图: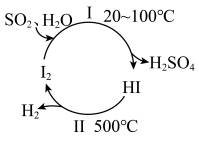
②若有196g
 生成,理论上产生氢气的体积为
生成,理论上产生氢气的体积为(2)工业上用
 溶液吸收
溶液吸收 ,生成等物质的量的两种钠盐,其中一种为
,生成等物质的量的两种钠盐,其中一种为 ,同时还有一种气体生成,则该反应的离子方程式为
,同时还有一种气体生成,则该反应的离子方程式为(3)工业上脱出
 ,也可以在加热和催化剂作用下用
,也可以在加热和催化剂作用下用 还原生成
还原生成 和
和 ,实验测得温度高于400℃时,
,实验测得温度高于400℃时, 脱出率减小,其原因可能是
脱出率减小,其原因可能是(4)工业上可用
 吸收含
吸收含 的烟气得到
的烟气得到 ,将50.7g
,将50.7g 受热分解,分解过程中的热重曲线(固体质量随温度变化的曲线)如图所示。
受热分解,分解过程中的热重曲线(固体质量随温度变化的曲线)如图所示。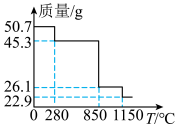
②1160℃时,所得固体的化学式为
您最近一年使用:0次
2023-11-05更新
|
140次组卷
|
2卷引用:重庆市2023-2024学年高三上学期11月调研测试化学试题
名校
解题方法
7 . 电喷雾电离等方法得到的 (
( 、
、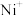 、
、 等)与
等)与 反应可得
反应可得 。
。 与
与 反应能高选择性地生成甲醇,体系的能量随反应进程的变化如下图所示:
反应能高选择性地生成甲醇,体系的能量随反应进程的变化如下图所示:

(1)步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是_______ (填“Ⅰ”或“Ⅱ”)。
(2)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则 与
与 反应的能量变化应为图中曲线
反应的能量变化应为图中曲线_______ (填“c”或“d”)。
(3)若 与
与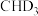 反应,生成的氘代甲醇有
反应,生成的氘代甲醇有_______ 种。
 (
( 、
、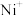 、
、 等)与
等)与 反应可得
反应可得 。
。 与
与 反应能高选择性地生成甲醇,体系的能量随反应进程的变化如下图所示:
反应能高选择性地生成甲醇,体系的能量随反应进程的变化如下图所示:
(1)步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是
(2)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则
 与
与 反应的能量变化应为图中曲线
反应的能量变化应为图中曲线(3)若
 与
与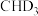 反应,生成的氘代甲醇有
反应,生成的氘代甲醇有
您最近一年使用:0次
名校
8 . 某研究小组同学用活性炭还原处理氮氧化物,向 恒容密闭容器中加入足量C与
恒容密闭容器中加入足量C与 发生反应,
发生反应,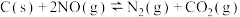 。在不同实验条件下,平衡时
。在不同实验条件下,平衡时 与温度T的关系如图所示:
与温度T的关系如图所示:
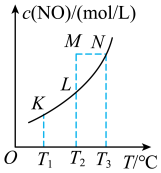
(1)结合图中数据,判断该反应的
___________ 0(填“>”或“<”),理由是___________ 。
(2)K、L、M、N四点对应的平衡常数分别为 、
、 、
、 、
、 ,判断其大小关系
,判断其大小关系_____ 。
使用氢能源可以减少汽车尾气中氮氧化合物的排放。利用甲醇与水蒸气反应可以制备氢气: ,该反应过程中的能量变化如图:
,该反应过程中的能量变化如图:

(3)
___________ 0(填“>”“=”或“<”),途径(I)的活化能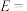
___________ 。
(4)途径(I)变为途径(II):改变的条件是___________ ,反应热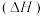
___________ (填“增大”“减小”或“不变”)。
(5)下列有关活化分子的说法正确的是___________。
 恒容密闭容器中加入足量C与
恒容密闭容器中加入足量C与 发生反应,
发生反应,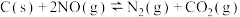 。在不同实验条件下,平衡时
。在不同实验条件下,平衡时 与温度T的关系如图所示:
与温度T的关系如图所示:
(1)结合图中数据,判断该反应的

(2)K、L、M、N四点对应的平衡常数分别为
 、
、 、
、 、
、 ,判断其大小关系
,判断其大小关系使用氢能源可以减少汽车尾气中氮氧化合物的排放。利用甲醇与水蒸气反应可以制备氢气:
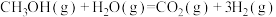 ,该反应过程中的能量变化如图:
,该反应过程中的能量变化如图:
(3)

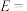
(4)途径(I)变为途径(II):改变的条件是
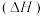
(5)下列有关活化分子的说法正确的是___________。
| A.增大反应物浓度可以提高活化分子百分数 |
| B.增大体系的压强一定能提高活化分子百分数 |
| C.使用合适的催化剂可以增大活化分子的能量 |
| D.升高温度能提高活化分子百分数 |
您最近一年使用:0次
2023-04-15更新
|
407次组卷
|
5卷引用:上海市卢湾高级中学2022-2023学年高二下学期期中考试(等级考)化学试题
上海市卢湾高级中学2022-2023学年高二下学期期中考试(等级考)化学试题上海市徐汇中学2022-2023学年高二下学期 5月月考化学(等级)试题(已下线)专题05 影响化学平衡的因素【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)天津市第一中学2023-2024学年高二上学期10月月考化学试题山西省大同市第一中学校2023-2024学年高二上学期9月月考化学试题
9 . 汽车发动机代用燃料包括乙醇、氢气和甲烷等。回答下列问题:
(1)在25℃、 下,一定质量的无水乙醇完全燃烧,转移6mol电子,放出热量
下,一定质量的无水乙醇完全燃烧,转移6mol电子,放出热量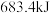 ,则乙醇燃烧热的热化学方程式为
,则乙醇燃烧热的热化学方程式为_______ 。
(2)根据图甲中的能量关系,可求得 键的键能为
键的键能为_______  。
。
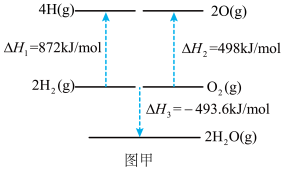
(3)甲烷完全燃烧反应的能量关系如图乙所示。

①

_______ (用含 和
和 的关系式表示)
的关系式表示)
②为提高燃料利用率,加入甲烷燃烧的催化剂,则
_______ (填“变大”、“变小”或“不变”,下同),该反应的 =
=_______ 。
(4)已知氢气的燃烧热为 ,甲烷的燃烧热为
,甲烷的燃烧热为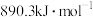 ,根据乙醇、氢气和甲烷的燃烧热,说明氢气作为能源的优点
,根据乙醇、氢气和甲烷的燃烧热,说明氢气作为能源的优点_______ ,_______ 。
(1)在25℃、
 下,一定质量的无水乙醇完全燃烧,转移6mol电子,放出热量
下,一定质量的无水乙醇完全燃烧,转移6mol电子,放出热量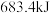 ,则乙醇燃烧热的热化学方程式为
,则乙醇燃烧热的热化学方程式为(2)根据图甲中的能量关系,可求得
 键的键能为
键的键能为 。
。
(3)甲烷完全燃烧反应的能量关系如图乙所示。

①


 和
和 的关系式表示)
的关系式表示)②为提高燃料利用率,加入甲烷燃烧的催化剂,则

 =
=(4)已知氢气的燃烧热为
 ,甲烷的燃烧热为
,甲烷的燃烧热为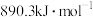 ,根据乙醇、氢气和甲烷的燃烧热,说明氢气作为能源的优点
,根据乙醇、氢气和甲烷的燃烧热,说明氢气作为能源的优点
您最近一年使用:0次
名校
10 . 依据教材内容,写出下列方程式。
(1)2mol (g)在
(g)在 中完全燃烧生成
中完全燃烧生成 和液态水,放出2599.2kJ的热量。写出该物质燃烧热的热化学方程式
和液态水,放出2599.2kJ的热量。写出该物质燃烧热的热化学方程式_________ 。
(2)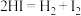 实际是经过两步基元反应。根据反应机理填空:
实际是经过两步基元反应。根据反应机理填空:

_________
_________ →_________
(3)在重铬酸钾溶液中存在的平衡_________ 。
(4)用 制备
制备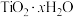 的反应
的反应_________ 。
(1)2mol
 (g)在
(g)在 中完全燃烧生成
中完全燃烧生成 和液态水,放出2599.2kJ的热量。写出该物质燃烧热的热化学方程式
和液态水,放出2599.2kJ的热量。写出该物质燃烧热的热化学方程式(2)
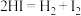 实际是经过两步基元反应。根据反应机理填空:
实际是经过两步基元反应。根据反应机理填空:
(3)在重铬酸钾溶液中存在的平衡
(4)用
 制备
制备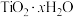 的反应
的反应
您最近一年使用:0次
2022-12-02更新
|
198次组卷
|
2卷引用:黑龙江省哈尔滨市第三中学校2022-2023学年高二上学期第三次验收考试化学试题



