某研究小组同学用活性炭还原处理氮氧化物,向 恒容密闭容器中加入足量C与
恒容密闭容器中加入足量C与 发生反应,
发生反应,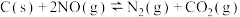 。在不同实验条件下,平衡时
。在不同实验条件下,平衡时 与温度T的关系如图所示:
与温度T的关系如图所示:
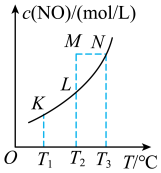
(1)结合图中数据,判断该反应的
___________ 0(填“>”或“<”),理由是___________ 。
(2)K、L、M、N四点对应的平衡常数分别为 、
、 、
、 、
、 ,判断其大小关系
,判断其大小关系_____ 。
使用氢能源可以减少汽车尾气中氮氧化合物的排放。利用甲醇与水蒸气反应可以制备氢气: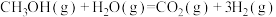 ,该反应过程中的能量变化如图:
,该反应过程中的能量变化如图:

(3)
___________ 0(填“>”“=”或“<”),途径(I)的活化能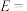
___________ 。
(4)途径(I)变为途径(II):改变的条件是___________ ,反应热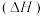
___________ (填“增大”“减小”或“不变”)。
(5)下列有关活化分子的说法正确的是___________。
 恒容密闭容器中加入足量C与
恒容密闭容器中加入足量C与 发生反应,
发生反应,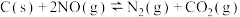 。在不同实验条件下,平衡时
。在不同实验条件下,平衡时 与温度T的关系如图所示:
与温度T的关系如图所示:
(1)结合图中数据,判断该反应的

(2)K、L、M、N四点对应的平衡常数分别为
 、
、 、
、 、
、 ,判断其大小关系
,判断其大小关系使用氢能源可以减少汽车尾气中氮氧化合物的排放。利用甲醇与水蒸气反应可以制备氢气:
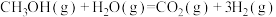 ,该反应过程中的能量变化如图:
,该反应过程中的能量变化如图:
(3)

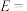
(4)途径(I)变为途径(II):改变的条件是
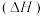
(5)下列有关活化分子的说法正确的是___________。
| A.增大反应物浓度可以提高活化分子百分数 |
| B.增大体系的压强一定能提高活化分子百分数 |
| C.使用合适的催化剂可以增大活化分子的能量 |
| D.升高温度能提高活化分子百分数 |
22-23高二下·上海黄浦·期中 查看更多[5]
山西省大同市第一中学校2023-2024学年高二上学期9月月考化学试题天津市第一中学2023-2024学年高二上学期10月月考化学试题(已下线)专题05 影响化学平衡的因素【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)上海市徐汇中学2022-2023学年高二下学期 5月月考化学(等级)试题上海市卢湾高级中学2022-2023学年高二下学期期中考试(等级考)化学试题
更新时间:2023-04-15 18:12:54
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】研究发现铁催化剂表面上合成氨的反应历程如图所示,其中吸附在铁催化剂表面上的微粒用*标注。 N2(g)+
N2(g)+ H2(g)
H2(g)  NH3(g)的 △H=
NH3(g)的 △H=_____ kJ·mol-1(用图中字母表示)。
2.推测该反应的正逆反应的活化能:Ea(正)_____ Ea(逆)。
A.> B.= C.<
3.该反应历程中决定化学反应速率快慢的基元反应是_____。
 N2(g)+
N2(g)+ H2(g)
H2(g)  NH3(g)的 △H=
NH3(g)的 △H=2.推测该反应的正逆反应的活化能:Ea(正)
A.> B.= C.<
3.该反应历程中决定化学反应速率快慢的基元反应是_____。
A. N2(g)+ N2(g)+ H2(g)=N*+ H2(g)=N*+ H2* H2* | B.N*+H*=NH* |
| C.NH2*+H*=NH2* | D.NH2*+H*=NH3* |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】汽车尾气中的氮氧化物是城市空气的主要污染物之一,如何降低汽车尾气污染已成为环保领域的热点。
回答下列问题:
(1)科技工作者用甲烷将氮氧化物还原为 N2和 H2O,涉及的反应如下:
CH4(g)+4NO2(g) =4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ/mol
CH4(g)+2NO2(g) =CO2(g)+2H2O(g)+N2(g) ΔH2=-867 kJ/mol
则 CH4(g)还原 NO(g)生成 N2(g)的热化学方程式为___________ 。
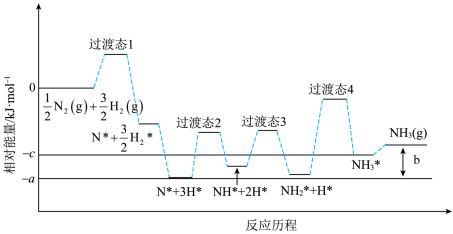
(2)使用氢能源可以减少汽车尾气中有害气体的排放。利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g) =CO2(g)+3H2(g) ΔH,该反应过程中的能量变化如图:
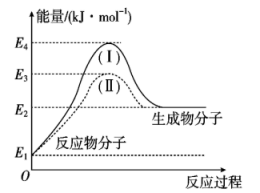
①ΔH___________ 0(填“>”“=”或“<”)。
②途径(Ⅰ)的活化能 E=___________ 。
③途径(Ⅰ)变为途径(Ⅱ):改变的条件是___________ ,反应热(ΔH)___________ (填“增大”“减小”或“不变”)。
回答下列问题:
(1)科技工作者用甲烷将氮氧化物还原为 N2和 H2O,涉及的反应如下:
CH4(g)+4NO2(g) =4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ/mol
CH4(g)+2NO2(g) =CO2(g)+2H2O(g)+N2(g) ΔH2=-867 kJ/mol
则 CH4(g)还原 NO(g)生成 N2(g)的热化学方程式为
(2)使用氢能源可以减少汽车尾气中有害气体的排放。利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g) =CO2(g)+3H2(g) ΔH,该反应过程中的能量变化如图:

①ΔH
②途径(Ⅰ)的活化能 E=
③途径(Ⅰ)变为途径(Ⅱ):改变的条件是
您最近一年使用:0次
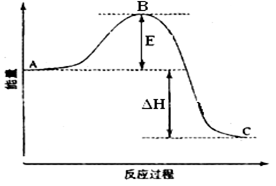
【推荐3】在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子。使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ·mol-1表示。请认真观察下图,然后回答问题。
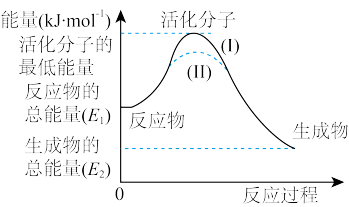
(1)图中反应是_________ (填“吸热”或“放热”)反应,该反应_______ (填“需要”或“不需要”)环境先提供能量,该反应的ΔH=__________ (用含E1、E2的代数式表示)
(2)已知:H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1。则其逆反应的活化能为
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1。则其逆反应的活化能为_______
(3)对于同一反应,图中虚线(Ⅱ)与实线(I)相比,活化能________ (填“升高”“降低”或“不变”),对反应热是否有影响?_______________________ ,原因是______________________

(1)图中反应是
(2)已知:H2(g)+
 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1。则其逆反应的活化能为
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1。则其逆反应的活化能为(3)对于同一反应,图中虚线(Ⅱ)与实线(I)相比,活化能
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】在碳循环中,以 为原料生产尿素的反应历程与能量变化示意图如图所示。
为原料生产尿素的反应历程与能量变化示意图如图所示。
_______ 0(填“>”、“<”或“=”)。从图像分析决定生产尿素的总反应的反应速率的步骤是第_______ 步反应,并说明理由______________ 。
 为原料生产尿素的反应历程与能量变化示意图如图所示。
为原料生产尿素的反应历程与能量变化示意图如图所示。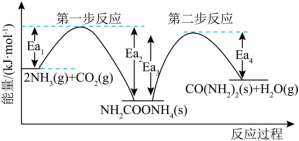

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。
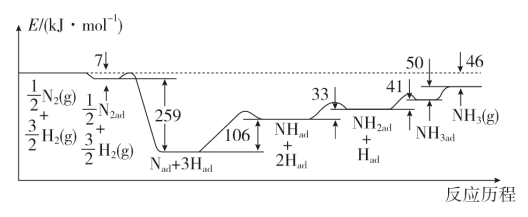
由图可知合成氨反应 N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g)的ΔH=
NH3(g)的ΔH=_______ kJ•mol-1。该历程中反应速率最慢的步骤的化学方程式为______ 。

由图可知合成氨反应
 N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g)的ΔH=
NH3(g)的ΔH=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
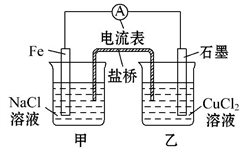
【推荐3】(1)如图为某实验小组依据氧化还原反应(用离子方程式表示)________ 设计的原电池装置。反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________ mol电子。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= - 24.8kJ/mol
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H= - 47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:__________ 。
(3)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。该反应通常用V2O5作催化剂,加V2O5会使图中B点_________ (填“升高”还是“降低”),△H______ (填“变大”、“变小”或“不变”)。

(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= - 24.8kJ/mol
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H= - 47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
(3)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。该反应通常用V2O5作催化剂,加V2O5会使图中B点

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】二氧化硫的污染治理是化学研究的重要课题。
(1)石灰石-石膏法是一种常见的“钙基固硫”方法。其中,石灰石的溶解率与脱硫效果有着密切的关系。
可将催化条件下CaCO3吸收SO2宏观反应分为三步:
i.CaCO3由固相溶解进入液相,溶解速率为RA;
ii.SO2由气相扩散进入液相,扩散速率为RB;
iii.在催化剂作用下,溶解的SO2和Ca2+发生化学反应,且反应在液相中进行,反应速率为RC。温度变化对总反应速率的影响如图所示。___________ (填“RA”、“RB”或“Rc”)控制。
②45~55℃(催化剂活性不变)曲线呈下降趋势的原因:一是二氧化硫溶解度随温度升高而降低;二是___________ 。
(2)利用MnO2与SO2反应既可消除污染又可以制备MnSO4,将含有SO2尾气和一定比例的空气通入MnO2悬浊液中,保持温度不变的情况下,测得溶液中c(Mn2+)和c( )随反应时间的变化如图所示。导致溶液中c(Mn2+)和c(
)随反应时间的变化如图所示。导致溶液中c(Mn2+)和c( )的变化产生明显差异的原因是:
)的变化产生明显差异的原因是:_______ 。 与NO2反应的离子方程式为
与NO2反应的离子方程式为___________ 。
②请描述水催化促进硫酸盐形成的化学机制:通过“水分子桥”,处于纳米液滴中的 或
或 可以将电子快速转移给周围的气相NO2分子,
可以将电子快速转移给周围的气相NO2分子,___________ 。
(1)石灰石-石膏法是一种常见的“钙基固硫”方法。其中,石灰石的溶解率与脱硫效果有着密切的关系。
可将催化条件下CaCO3吸收SO2宏观反应分为三步:
i.CaCO3由固相溶解进入液相,溶解速率为RA;
ii.SO2由气相扩散进入液相,扩散速率为RB;
iii.在催化剂作用下,溶解的SO2和Ca2+发生化学反应,且反应在液相中进行,反应速率为RC。温度变化对总反应速率的影响如图所示。
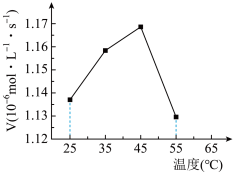
②45~55℃(催化剂活性不变)曲线呈下降趋势的原因:一是二氧化硫溶解度随温度升高而降低;二是
(2)利用MnO2与SO2反应既可消除污染又可以制备MnSO4,将含有SO2尾气和一定比例的空气通入MnO2悬浊液中,保持温度不变的情况下,测得溶液中c(Mn2+)和c(
 )随反应时间的变化如图所示。导致溶液中c(Mn2+)和c(
)随反应时间的变化如图所示。导致溶液中c(Mn2+)和c( )的变化产生明显差异的原因是:
)的变化产生明显差异的原因是: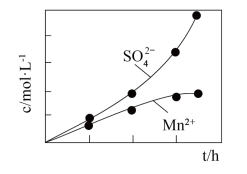
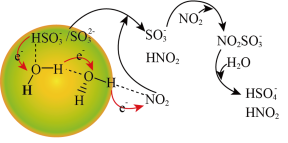
 与NO2反应的离子方程式为
与NO2反应的离子方程式为②请描述水催化促进硫酸盐形成的化学机制:通过“水分子桥”,处于纳米液滴中的
 或
或 可以将电子快速转移给周围的气相NO2分子,
可以将电子快速转移给周围的气相NO2分子,
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】根据要求回答问题:
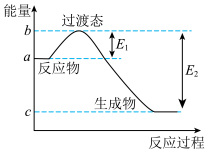
(1)如图是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,活化能E1的变化是_____ (填“增大”“减小”或“不变”,下同),ΔH的变化是_____ 。图中最稳定的是_____ (填“反应物”“过渡态”或“生成物”)。
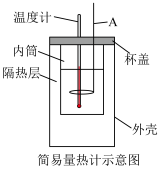
(2)50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热(设溶液的密度均为1g•cm-3,反应后溶液的比热容c=4.18J•g-1•℃-1)。回答下列问题:
从实验装置上看,图中仪器A的名称是_____ ,隔热层的作用是_____ 。根据表中数据,结合题干信息,请写出生成1molH2O的热化学方程式_____ (保留3位有效数字)。
(3)生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的1.2~2.0万倍,在大气中的寿命可长达740年之久,表中是几种化学键的键能:
写出N2(g)与F2(g)反应合成NF3(g)的热化学方程式_____ 。
(4)在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。这两步反应的能量变化如图:
。这两步反应的能量变化如图:
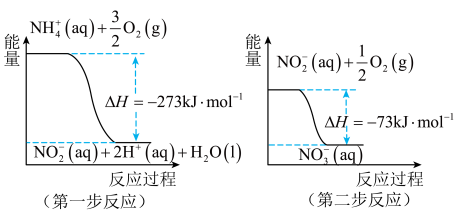
第二步反应是_____ (填“放热”或“吸热”)反应。1molNH (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是_____ 。
(1)如图是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,活化能E1的变化是

(2)50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热(设溶液的密度均为1g•cm-3,反应后溶液的比热容c=4.18J•g-1•℃-1)。回答下列问题:
 | 实验次数 | 反应物的温度/℃ | 反应前体系的温度 | 反应后体系的温度 | 温度差 | |
| 盐酸 | NaOH溶液 | t1/℃ | t2/℃ | (t2-t1)/℃ | ||
| 1 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 | |
| 2 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 | |
| 3 | 25.6 | 25.4 | 25.5 | 29.0 | 3.5 | |
(3)生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的1.2~2.0万倍,在大气中的寿命可长达740年之久,表中是几种化学键的键能:
| 化学键 | N≡N | F-F | N-F |
| 键能/kJ•mol-1 | 941.7 | 154.8 | 283.0 |
(4)在微生物作用的条件下,NH
 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。这两步反应的能量变化如图:
。这两步反应的能量变化如图:
第二步反应是
 (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】过氧化氢(H2O2)的水溶液俗称双氧水。双氧水常被称为化学反应中的“绿色试剂”。已知,在含少量I-的溶液中,H2O2会较快分解,反应如下:反应①:H2O2+I- → H2O+IO-; 反应②:H2O2+IO- → H2O+O2+I-,完成下列填空:
(1)反应①中的氧化产物是_________ ,被还原的元素是___________ 。
(2)标出反应②中电子转移的方向和数目。_______________
(3)H2O2分解过程中,I-的作用是__________ 。
(4)根据反应①和反应②,请说明双氧水被称为“绿色试剂”的主要原因是_____ 。
(5)H2O2是一种二元弱酸,写出第一步电离的电离方程式:________ ,双氧水可漂白纤维织物,目前认为是其中过氧化氢离子(HOO-)的作用。为了增强其漂白效果,应选择在____ (填“酸”、“碱”或“中”)性条件下进行。
(6)向盐酸酸化的FeCl2溶液中加入双氧水,溶液由浅绿色变为棕黄色,写出该变化的化学反应方程式:_____________ 。
(1)反应①中的氧化产物是
(2)标出反应②中电子转移的方向和数目。
(3)H2O2分解过程中,I-的作用是
(4)根据反应①和反应②,请说明双氧水被称为“绿色试剂”的主要原因是
(5)H2O2是一种二元弱酸,写出第一步电离的电离方程式:
(6)向盐酸酸化的FeCl2溶液中加入双氧水,溶液由浅绿色变为棕黄色,写出该变化的化学反应方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】300℃时,将2molA和2molB两种气体混合于2L密闭容器中,发生如下反应3A(g)+B(g) 2C(g)+2D(g) △H=Q,2min末达到平衡,生成生成0.8mol D。
2C(g)+2D(g) △H=Q,2min末达到平衡,生成生成0.8mol D。
(1)300℃时,该反应的平衡常数表达式为:K=__________________ ;已知K300℃<K350℃,则△H______ 0(填“>”或“<”)。
(2)在2min末时,B的平衡浓度为_____________ ,D的平均反应速率为____________ ;
(3)若温度不变,缩小容器容积,则A的转化率___________ (填“增大”、“减小”或“不变”),原因是___________ ;
 2C(g)+2D(g) △H=Q,2min末达到平衡,生成生成0.8mol D。
2C(g)+2D(g) △H=Q,2min末达到平衡,生成生成0.8mol D。(1)300℃时,该反应的平衡常数表达式为:K=
(2)在2min末时,B的平衡浓度为
(3)若温度不变,缩小容器容积,则A的转化率
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。烟道气和汽车尾气 、
、 等)是造成雾霾天气的原因之一,对这些排放气的处理以及再利用是化学工作者研究的重要课题。请思考回答下列问题:
等)是造成雾霾天气的原因之一,对这些排放气的处理以及再利用是化学工作者研究的重要课题。请思考回答下列问题:
(1) 在一定条件下可发生分解:
在一定条件下可发生分解: ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量 进行该反应,能判断反应已达到化学平衡状态的是_______(填字母)。
进行该反应,能判断反应已达到化学平衡状态的是_______(填字母)。
(2)在有氧参与和新型催化剂作用下, 和
和 可以反应生成
可以反应生成 。将一定比例的
。将一定比例的 、
、 和
和 通入装有新型催化剂的反应器。测得相同时间内
通入装有新型催化剂的反应器。测得相同时间内 去除率随温度变化如图所示:
去除率随温度变化如图所示:
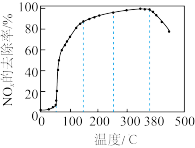
在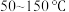 范围内,
范围内, 的去除率快速上升的原因为
的去除率快速上升的原因为_______ ;在 后,
后, 的去除率下降的原因,一可能为催化剂活性降低,二可能为
的去除率下降的原因,一可能为催化剂活性降低,二可能为_______ 。
(3)工业上可用“氨催化氧化法”生产 ,以氨气、氧气为原料,在催化剂存在下生成
,以氨气、氧气为原料,在催化剂存在下生成 和副产物
和副产物 的化学方程式如下:
的化学方程式如下:
I.
Ⅱ.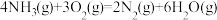
已知: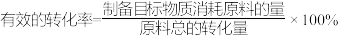
1L恒容密闭容器中充入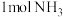 、
、 ,在催化剂作用下发生两个竞争反应I、Ⅱ,测得不同温度下反应相同时间有关物质的量关系如图所示:
,在催化剂作用下发生两个竞争反应I、Ⅱ,测得不同温度下反应相同时间有关物质的量关系如图所示:
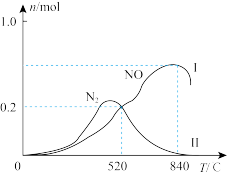
① 时,
时, 的有效转化率为
的有效转化率为_______ 。
②工业用氨催化氧化制备 ,选择的最佳温度是
,选择的最佳温度是_______ 。
③ 时,反应Ⅱ的平衡常数
时,反应Ⅱ的平衡常数
_______ (保留3位有效数字)。
 、
、 等)是造成雾霾天气的原因之一,对这些排放气的处理以及再利用是化学工作者研究的重要课题。请思考回答下列问题:
等)是造成雾霾天气的原因之一,对这些排放气的处理以及再利用是化学工作者研究的重要课题。请思考回答下列问题:(1)
 在一定条件下可发生分解:
在一定条件下可发生分解: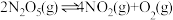 ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量 进行该反应,能判断反应已达到化学平衡状态的是_______(填字母)。
进行该反应,能判断反应已达到化学平衡状态的是_______(填字母)。A. 和 和 的浓度比保持不变 的浓度比保持不变 | B.容器中压强不再变化 |
C.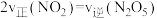 | D.气体的密度保持不变 |
(2)在有氧参与和新型催化剂作用下,
 和
和 可以反应生成
可以反应生成 。将一定比例的
。将一定比例的 、
、 和
和 通入装有新型催化剂的反应器。测得相同时间内
通入装有新型催化剂的反应器。测得相同时间内 去除率随温度变化如图所示:
去除率随温度变化如图所示:
在
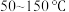 范围内,
范围内, 的去除率快速上升的原因为
的去除率快速上升的原因为 后,
后, 的去除率下降的原因,一可能为催化剂活性降低,二可能为
的去除率下降的原因,一可能为催化剂活性降低,二可能为(3)工业上可用“氨催化氧化法”生产
 ,以氨气、氧气为原料,在催化剂存在下生成
,以氨气、氧气为原料,在催化剂存在下生成 和副产物
和副产物 的化学方程式如下:
的化学方程式如下:I.

Ⅱ.
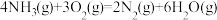
已知:
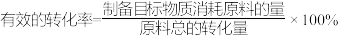
1L恒容密闭容器中充入
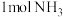 、
、 ,在催化剂作用下发生两个竞争反应I、Ⅱ,测得不同温度下反应相同时间有关物质的量关系如图所示:
,在催化剂作用下发生两个竞争反应I、Ⅱ,测得不同温度下反应相同时间有关物质的量关系如图所示:
①
 时,
时, 的有效转化率为
的有效转化率为②工业用氨催化氧化制备
 ,选择的最佳温度是
,选择的最佳温度是③
 时,反应Ⅱ的平衡常数
时,反应Ⅱ的平衡常数
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】硫酸工业中2SO2(g)+O2(g) 2SO3(g) ΔH<0(放热反应)有关实验数据如下:
2SO3(g) ΔH<0(放热反应)有关实验数据如下:
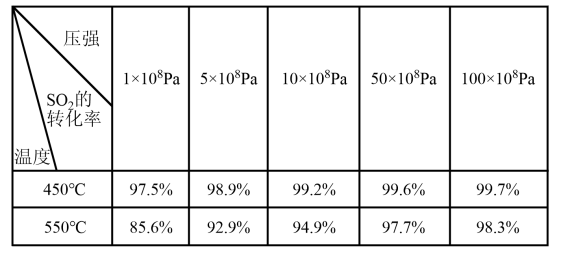
(1)在生产中常用过量的空气是为了________ 。
(2)高温对该反应有何影响?________ ,实际生产中采用400~500 ℃的温度除了考虑速率因素外,还考虑到________ 。
(3)增大压强对上述反应有何影响?__________ ,但工业上又常采用常压进行反应,其原因是______________ 。
(4)常用浓H2SO4而不用水吸收SO3是由于______ ,尾气中SO2必须回收,主要是为了________ 。
 2SO3(g) ΔH<0(放热反应)有关实验数据如下:
2SO3(g) ΔH<0(放热反应)有关实验数据如下:
(1)在生产中常用过量的空气是为了
(2)高温对该反应有何影响?
(3)增大压强对上述反应有何影响?
(4)常用浓H2SO4而不用水吸收SO3是由于
您最近一年使用:0次



