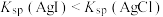解题方法
1 . 过氧乙酸(CH3COOOH)不仅在卫生医疗、食品消毒及漂白剂领域有广泛应用,也应用于环境工程、精细化工等领域。实验室利用醋酸(CH3COOH)与双氧水(H2O2)共热,在固体酸的催化下制备过氧乙酸(CH3COOOH),其装置如下图所示。请回答下列问题:
实验步骤:
Ⅰ.先在反应瓶中加入冰醋酸、乙酸丁酯和固体酸催化剂,开通仪器1和8,温度维持为55℃;
Ⅱ.待真空度达到反应要求时,打开仪器3的活塞,逐滴滴入浓度为35%的双氧水,再通入冷却水;
Ⅲ.从仪器5定期放出乙酸丁酯和水的混合物,待反应结束后分离反应器2中的混合物,得到粗产品。
(1)反应器 2中制备过氧乙酸(CH3COOOH)的化学反应方程式为_______ 。
(2)反应中维持冰醋酸过量,目的是提高_______ ;分离反应器 中的混合物得到粗产品,分离的方法是
中的混合物得到粗产品,分离的方法是_______ 。
(3)实验中加入乙酸丁酯的主要作用是_______(选填字母序号)。
(4)待观察到_______ (填现象)时,反应结束。
(5)粗产品中过氧乙酸(CH3COOOH)含量的测定:取一定体积的样品V mL,分成6等份,用过量KI溶液与过氧化物作用,以0.1 mol·L-1的硫代硫酸钠溶液滴定碘(I2+2S2O =2I-+S4O
=2I-+S4O );重复3次,平均消耗量为V1 mL。再以0.02 mol·L-1的酸性高锰酸钾溶液滴定样品,重复3次,平均消耗量为V2 mL。则样品中的过氧乙酸的浓度为
);重复3次,平均消耗量为V1 mL。再以0.02 mol·L-1的酸性高锰酸钾溶液滴定样品,重复3次,平均消耗量为V2 mL。则样品中的过氧乙酸的浓度为_______ mol·L-1。
(6)通过研究发现Fe3+、Cu2+可催化过氧乙酸分解为氧气和乙酸,现需设计实验比较Fe3+、Cu2+对过氧乙酸的催化效率。可供选择的试剂和主要器材有:a. 过氧乙酸溶液、b. 1mol·L-1的FeCl3溶液、c. 0.5 mol·L-1的Fe2(SO4)3溶液、d. 0.5 mol·L-1的CuCl2溶液、e.1 mol·L-1的CuSO4溶液、f.计时器、g.测量气体体积的针筒、i. 带导气管的试管。
你设计的实验方案为_______ 。

实验步骤:
Ⅰ.先在反应瓶中加入冰醋酸、乙酸丁酯和固体酸催化剂,开通仪器1和8,温度维持为55℃;
Ⅱ.待真空度达到反应要求时,打开仪器3的活塞,逐滴滴入浓度为35%的双氧水,再通入冷却水;
Ⅲ.从仪器5定期放出乙酸丁酯和水的混合物,待反应结束后分离反应器2中的混合物,得到粗产品。
(1)反应器 2中制备过氧乙酸(CH3COOOH)的化学反应方程式为
(2)反应中维持冰醋酸过量,目的是提高
 中的混合物得到粗产品,分离的方法是
中的混合物得到粗产品,分离的方法是(3)实验中加入乙酸丁酯的主要作用是_______(选填字母序号)。
| A.作为反应溶剂,提高反应速率 |
| B.与固体酸一同作为催化剂使用,提高反应速率 |
| C.与水形成沸点更低的混合物,利于水的蒸发,提高产率 |
| D.增大油水分离器5的液体量,便于实验观察 |
(5)粗产品中过氧乙酸(CH3COOOH)含量的测定:取一定体积的样品V mL,分成6等份,用过量KI溶液与过氧化物作用,以0.1 mol·L-1的硫代硫酸钠溶液滴定碘(I2+2S2O
 =2I-+S4O
=2I-+S4O );重复3次,平均消耗量为V1 mL。再以0.02 mol·L-1的酸性高锰酸钾溶液滴定样品,重复3次,平均消耗量为V2 mL。则样品中的过氧乙酸的浓度为
);重复3次,平均消耗量为V1 mL。再以0.02 mol·L-1的酸性高锰酸钾溶液滴定样品,重复3次,平均消耗量为V2 mL。则样品中的过氧乙酸的浓度为(6)通过研究发现Fe3+、Cu2+可催化过氧乙酸分解为氧气和乙酸,现需设计实验比较Fe3+、Cu2+对过氧乙酸的催化效率。可供选择的试剂和主要器材有:a. 过氧乙酸溶液、b. 1mol·L-1的FeCl3溶液、c. 0.5 mol·L-1的Fe2(SO4)3溶液、d. 0.5 mol·L-1的CuCl2溶液、e.1 mol·L-1的CuSO4溶液、f.计时器、g.测量气体体积的针筒、i. 带导气管的试管。
你设计的实验方案为
您最近一年使用:0次
2022-06-25更新
|
156次组卷
|
2卷引用:辽宁省部分中学2021-2022学年高二下学期期末检测化学试题
名校
2 . 下列设计的实验方案不能达到实验目的的是
选项 | 实验目的 | 实验过程 |
A | 配制 | 将一定质量的 固体放入烧杯中,直接用蒸馏水溶解 固体放入烧杯中,直接用蒸馏水溶解 |
B | 验证 结合 结合 的能力比 的能力比 的弱 的弱 | 室温下,用pH试纸测得0.1  溶液的pH为10,0.1 溶液的pH为10,0.1  溶液的pH约为5 溶液的pH约为5 |
C | 证明: | 向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液,一支试管中产生黄色沉淀,另一支中无明显现象 |
D | 探究催化剂对 分解速率的影响 分解速率的影响 | 在相同条件下,向一支试管中加入2mL 5%  和1mL 和1mL ,向另一支试管中加入2mL 5% ,向另一支试管中加入2mL 5%  和1mL 和1mL  溶液,观察并比较实验现象 溶液,观察并比较实验现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 下列有关实验操作能达到实验目的的是
| 选项 | 实验操作 | 实验目的 |
| A | 分别向体积相同的两个密闭容器中通入2mol和4mol 气体,在相同温度下反应相同时间,比较两容器内气体颜色深浅 气体,在相同温度下反应相同时间,比较两容器内气体颜色深浅 | 探究压强对化学平衡移动的影响 |
| B | 向两支试管中分别加入2mL0.5mol/L 溶液,将其中一支试管加热,然后置于冷水中,观察并记录现象,与另一支试管进行比较 溶液,将其中一支试管加热,然后置于冷水中,观察并记录现象,与另一支试管进行比较 | 探究压强对化学平衡移动的影响 |
| C | 向滴有 的 的 溶液中加入少量 溶液中加入少量 固体,观察烧杯中溶液颜色变化 固体,观察烧杯中溶液颜色变化 | 探究压强对化学平衡移动的影响 |
| D | 分别向两支装有5mL0.5mol/L 溶液的试管中滴加5滴相同浓度的 溶液的试管中滴加5滴相同浓度的 溶液和 溶液和 溶液,比较两支试管产生气泡快慢 溶液,比较两支试管产生气泡快慢 | 探究 与 与 对 对 分解的催化效率 分解的催化效率 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
4 . 下列实验能达到预期目的是
| 实验内容 | 实验目的 | |
| A | 将 的KI溶液和 的KI溶液和 的 的 溶液等体积混合,充分反应后,取少许混合液滴加 溶液等体积混合,充分反应后,取少许混合液滴加 溶液 溶液 | 验证 与 与 的反应有一定限度 的反应有一定限度 |
| B | 将碱式滴定管的尖嘴朝下,慢慢挤压胶管内玻璃球将气泡排出 | 除去碱式滴定管胶管内气泡 |
| C | 相同条件下,向一支试管中加入 和 和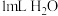 向另一支试管中加入 向另一支试管中加入 和 和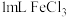 溶液,观察并比较实验现象 溶液,观察并比较实验现象 | 探究 对 对 分解速率的影响 分解速率的影响 |
| D | 向2支盛有5mL不同浓度 溶液的试管中,同时加入 溶液的试管中,同时加入 溶液,观察并比较实验现象 溶液,观察并比较实验现象 | 探究浓度对反应速率的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-10-13更新
|
414次组卷
|
4卷引用:辽宁省朝阳市建平县高级中学2021-2022学年高二上学期第二次月考化学试题
名校
5 . 用下列装置进行相应实验,能达到实验目的的是
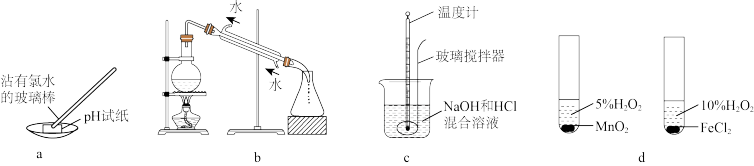

A.用装置a测定氯水的 | B.用装置b蒸馏海水得到淡水 |
| C.用装置c测定反应热 | D.用装置d比较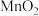 和 和 的催化效果 的催化效果 |
您最近一年使用:0次
2022-10-14更新
|
106次组卷
|
2卷引用:辽宁省朝阳市凌源市实验中学2022-2023学年高二上学期10月月考化学试题
名校
解题方法
6 . 用下列装置进行相应实验,能达到实验目的的是

A.用装置a测定氯水的 | B.用装置b蒸馏海水得到淡水 |
| C.用装置c测定反应热 | D.用装置d比较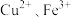 对反应速率的影响 对反应速率的影响 |
您最近一年使用:0次
名校
7 . 根据下列实验所得结论正确的是
| 选项 | A | B |
| 装置 | 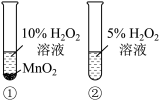 | 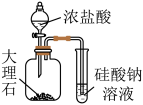 |
| 现象 | ①中产生大量气泡,②中无明显现象 | 试管中溶液出现浑浊 |
| 结论 | MnO2是H2O2分解的催化剂 | 酸性:碳酸>硅酸 |
| 选项 | C | D |
| 装置 | 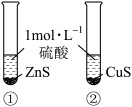 |  H2(g)+I2(g)⇌2HI(g)达到平衡状态 |
| 现象 | ①中固体溶解,②中固体不溶解 | 压缩体积,气体颜色加深 |
| 结论 | ZnS的溶解度大于CuS | 增大压强,上述平衡逆向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
8 . 雾霾已经成为城市发展的障碍。雾霾形成的最主要原因是人为排放,其中汽车尾气污染对雾霾的“贡献”逐年增加。为了减轻大气污染,可在汽车尾气排放处加装“催化净化器”装置。
(1)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.0kJ/mol;C(s)+ O2(g)=CO(g) ΔH2=-110.0kJ/mol;N2(g)+O2(g)=2NO(g) ΔH3=+180.0kJ/mol。通过汽车“催化净化器”的CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的热化学方程式:
O2(g)=CO(g) ΔH2=-110.0kJ/mol;N2(g)+O2(g)=2NO(g) ΔH3=+180.0kJ/mol。通过汽车“催化净化器”的CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的热化学方程式:___ 。
(2)一定条件下进行上述反应,测得CO的平衡转化率与温度、起始投料比m[m=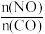 ]的关系如图所示。
]的关系如图所示。
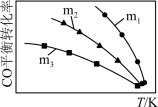
回答下列问题:
①投料比m1、m2、m3中,最大的是___ 。
②随着温度的升高,不同投料比下CO平衡转化率趋于相近的原因是___ 。
(3)为研究气缸中NO的生成,在体积可变的恒压密闭容器中,高温下充入物质的量均为1mol的氮气和氧气,发生反应N2(g)+O2(g) 2NO(g)。
2NO(g)。
①为减小平衡混合气中NO的体积分数,可采取的措施是___ (填“升高温度”或“降低温度”)。
②对于气缸中NO的生成,化学家提出了如下反应历程:第一步O2 2O慢反应,第二步O+N2
2O慢反应,第二步O+N2 NO+N较快平衡,第三步N+O2
NO+N较快平衡,第三步N+O2 NO+O快速平衡。下列说法正确的是
NO+O快速平衡。下列说法正确的是___ (填序号)。.
A.N、O原子均为该反应的催化剂
B.第一步反应不从N2分解开始,是因为N2比O2稳定
C.三步反应中第一步反应活化能最小
D.三步反应的速率都随温度升高而增大
(4)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH1,如图是该反应的能量变化图:
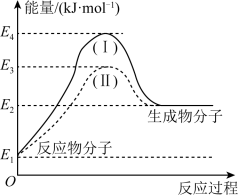
①通过图中信息可判断反应CH3OH(g)+H2O(g)↑=CO2(g)+3H2(g)的ΔH1___ (选填“>”“=”或“<”)0。
②图中途径(II)使用了催化剂。则途径(II)的活化能___ (选填“>”“=”或“<”)途径(I)的活化能。
(1)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.0kJ/mol;C(s)+
 O2(g)=CO(g) ΔH2=-110.0kJ/mol;N2(g)+O2(g)=2NO(g) ΔH3=+180.0kJ/mol。通过汽车“催化净化器”的CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的热化学方程式:
O2(g)=CO(g) ΔH2=-110.0kJ/mol;N2(g)+O2(g)=2NO(g) ΔH3=+180.0kJ/mol。通过汽车“催化净化器”的CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的热化学方程式:(2)一定条件下进行上述反应,测得CO的平衡转化率与温度、起始投料比m[m=
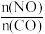 ]的关系如图所示。
]的关系如图所示。
回答下列问题:
①投料比m1、m2、m3中,最大的是
②随着温度的升高,不同投料比下CO平衡转化率趋于相近的原因是
(3)为研究气缸中NO的生成,在体积可变的恒压密闭容器中,高温下充入物质的量均为1mol的氮气和氧气,发生反应N2(g)+O2(g)
 2NO(g)。
2NO(g)。①为减小平衡混合气中NO的体积分数,可采取的措施是
②对于气缸中NO的生成,化学家提出了如下反应历程:第一步O2
 2O慢反应,第二步O+N2
2O慢反应,第二步O+N2 NO+N较快平衡,第三步N+O2
NO+N较快平衡,第三步N+O2 NO+O快速平衡。下列说法正确的是
NO+O快速平衡。下列说法正确的是A.N、O原子均为该反应的催化剂
B.第一步反应不从N2分解开始,是因为N2比O2稳定
C.三步反应中第一步反应活化能最小
D.三步反应的速率都随温度升高而增大
(4)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH1,如图是该反应的能量变化图:

①通过图中信息可判断反应CH3OH(g)+H2O(g)↑=CO2(g)+3H2(g)的ΔH1
②图中途径(II)使用了催化剂。则途径(II)的活化能
您最近一年使用:0次
2022-01-05更新
|
130次组卷
|
3卷引用:辽宁省渤海大学附属高级中学2021-2022学年高二上学期期中考试化学试题