1 . 合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3⇌[Cu(NH3)3CO]Ac。完成下空:
(1)如果要提高上述反应的反应速率,可以采取的措施是
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的足量的氨可吸收二氧化碳,写出该反应的化学方程式
(3)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为
(4)已知与CO2与CS2分子结构相似,熔点CS2高于CO2,其原因是
(5)某研究性学习组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
实验序号 | 实验温度 | KMnO4溶液 | H2C2O4溶液 | H2O | 溶液褪色时间 | ||
V(mL) | c(mol/L) | V(mL) | c(mol/L) | V(mL) | t(s) | ||
A | 293K | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313K | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
①其中V1=
②反应一段时间后该反应速率会加快,造成此种变化的原因可能是
 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )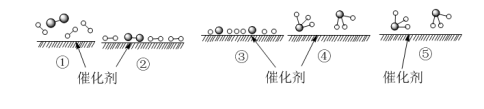
| A.使用催化剂,改变了反应的途径,使合成氨反应放出的热量减少 |
| B.该过程中,N2、H2吸收能量后断键形成N原子和H原子 |
| C.该过程中,N原子和H原子形成含有非极性键的NH3分子 |
| D.合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量 |
 ,下列措施能增大化学反应速率的是( )
,下列措施能增大化学反应速率的是( )①增大体系容积 ②升高体系温度 ③使用合适的催化剂 ④恒容条件下,再通入

| A.①④ | B.①③④ | C.②③④ | D.①②③④ |
 2Cl2(g)+2H2O(g)。一定条件下,测得数据如下:
2Cl2(g)+2H2O(g)。一定条件下,测得数据如下:| t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
| c(Cl2)/10-3mol•L-1 | 0 | 1.8 | 3.7 | 5.4 | 7.2 | 7.2 |
| A.条件不变时,12min时v正(Cl2)=v逆(H2O) |
| B.2.0~4.0min内的平均反应速率大于6.0~8.0min内的 |
| C.0~8.0min内HCl的平均反应速率为1.8mol·L-1·min-1 |
| D.加入高效催化剂,达到平衡所用时间小于8.0min |
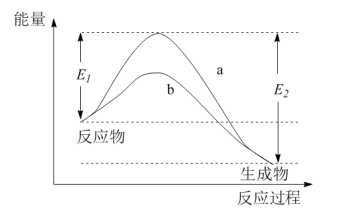
 2C(g) △H<0,下列叙述正确的( )
2C(g) △H<0,下列叙述正确的( )| A.增大反应物的浓度,可以提高活化分子百分数,所以v(正)会增大,v(逆)会减小 |
| B.升高温度可以提高物质的能量,提高活化分子百分数,所以v(正)、v(逆)都增大 |
| C.采用催化剂,可以提高活化分子百分数,所以会引起v(正)、v(逆)同时增大,并改变反应的热效应 |
| D.减小压强可以降低单位体积内活化分子的数目,所以v(正)减小、v(逆)增大 |
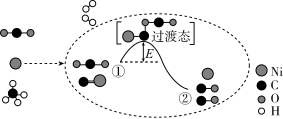
下列说法不正确的是
| A.合成气的主要成分为CO和H2 | B.①→②既有碳氧键的断裂,又有碳氧键的形成 |
| C.Ni在该反应中做催化剂 | D.①→②吸收能量 |
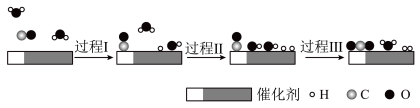
下列说法正确的是
| A.过程Ⅰ和过程Ⅲ均为放热过程 |
| B.图示过程中的H2O均参与了反应过程 |
| C.过程Ⅲ生成了具有极性共价键的H2、CO2 |
| D.使用催化剂降低了水煤气变换反应的ΔH |
| 实验 序号 | 实验温度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
| KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
| V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
| A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | 6 |
| B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
| C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t1 |
(1)通过实验A、B,可探究出浓度的改变对反应速率的影响,其中V1=
(2)C组实验中溶液褪色时间t1
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示,并以此分析造成n(Mn2+)突变的可能的原因是:
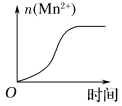
(1)请你帮助他们完成实验报告:
| 实验过程 | 实验现象 | 实验结论 |
| 在一支试管中加入5 mL 5%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管 | FeCl3溶液可以催化H2O2分解 |
(2)已知FeCl3在水中可电离出Fe3+和Cl-,同学们提出以下猜想。
甲同学的猜想:真正催化H2O2分解的是FeCl3溶液中的H2O;
乙同学的猜想:真正催化H2O2分解的是FeCl3溶液中的Fe3+;
丙同学的猜想:真正催化H2O2分解的是FeCl3溶液中的Cl-。
你认为最不可能的是
(3)同学们对余下的两个猜想用实验进行了探究。请你仔细分析后完成下表:
| 实验过程 | 实验现象 | 实验结论 |
| 向盛有5 mL 5%的H2O2溶液的试管中加入少量的盐酸,并把带火星的木条伸入试管 | 无明显现象 | |
| 向盛有5 mL 5%的H2O2溶液的试管中加入少量的 |
试剂:4% H2O2溶液,12% H2O2溶液,lmol/LFeCl3溶液
仪器:试管、带刻度的胶头滴管、酒精灯
| 组别 | 实验温度 (℃) | H2O2溶液 | FeCl3溶液 (1mol/L) |
| 1 | 30 | 5mL 4% | 1mL |
| 2 | 60 | 5mL 4% | 1mL |
| 3 | 30 | 5mL 12% | 0mL |
| 4 | 30 | 5mL 4% | 0mL |
(2)乙同学进行实验3与实验4,发现气体均缓慢产生,无法说明“浓度改变会影响化学反应速率”,你的改进方法是
(3)丙同学进行了实验1与实验4,你认为他想探究的是



