解题方法
1 . 为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。下列叙述中不正确的是


| A.图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小 |
| B.相同环境下若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 |
| C.用图乙所示装置测定反应速率,只能通过测定反应产生的气体体积 |
| D.为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 |
您最近一年使用:0次
名校
2 . 依据图中氮元素及其化合物的转化关系,回答问题:
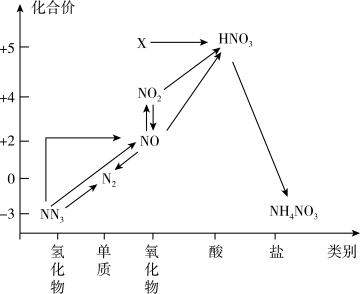
(1)图中X的化学式为_______ ,从化合价上看,X与水反应所得产物具有_______ 性(填“氧化”或“还原”)。
(2)氮氧化合物溶于水是形成酸雨的主要原因,请问:
①酸雨的pH_______ 5.6;
②请用化学方程式表示硝酸型酸雨形成的原因:_______ ;
(3)在一个容积3L的密闭容器里进行如下反应N2(g)+3H2(g)⇌2NH3(g),反应开始时n(N2)=1.5mol,n(H2)=4.4mol,2min末n(H2)=0.8mol。
①前2min内用NH3表示该反应的反应速率_______ ;
②到2min末N2的转化率为_______ ;
(4)下列条件能加快该反应的反应速率的有_______;
(5)一段时间后,下列条件下能说明该反应已达到平衡状态的是:_______ 。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N﹣H键的同时生成2n mol H﹣H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
d.混合气体的平均摩尔质量不变
e.容器内的气体密度不变
f.容器内气体的压强不变

(1)图中X的化学式为
(2)氮氧化合物溶于水是形成酸雨的主要原因,请问:
①酸雨的pH
②请用化学方程式表示硝酸型酸雨形成的原因:
(3)在一个容积3L的密闭容器里进行如下反应N2(g)+3H2(g)⇌2NH3(g),反应开始时n(N2)=1.5mol,n(H2)=4.4mol,2min末n(H2)=0.8mol。
①前2min内用NH3表示该反应的反应速率
②到2min末N2的转化率为
(4)下列条件能加快该反应的反应速率的有_______;
| A.保持体积不变,再向容器中充N2 |
| B.保持体积不变,再向容器中充He |
| C.保持压强不变,再向容器中充He |
| D.选择合适的催化剂 |
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N﹣H键的同时生成2n mol H﹣H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
d.混合气体的平均摩尔质量不变
e.容器内的气体密度不变
f.容器内气体的压强不变
您最近一年使用:0次
解题方法
3 . 我国科研人员提出了由 和
和 转化为高附加值产品
转化为高附加值产品 的催化反应历程,示意图如下。
的催化反应历程,示意图如下。

下列说法不正确的是
 和
和 转化为高附加值产品
转化为高附加值产品 的催化反应历程,示意图如下。
的催化反应历程,示意图如下。
下列说法不正确的是
A. 中存在极性共价键 中存在极性共价键 |
B.生成 总反应的原子利用率为100% 总反应的原子利用率为100% |
| C.①→②放出能量并形成了C—C键 |
D.该催化剂降低了活化能,使总反应的 变小 变小 |
您最近一年使用:0次
解题方法
4 .  分解速率受多种因素影响。实验测得70℃时不同条件下
分解速率受多种因素影响。实验测得70℃时不同条件下 浓度随时间的变化如图所示。
浓度随时间的变化如图所示。

下列说法错误的是
 分解速率受多种因素影响。实验测得70℃时不同条件下
分解速率受多种因素影响。实验测得70℃时不同条件下 浓度随时间的变化如图所示。
浓度随时间的变化如图所示。
下列说法错误的是
A.图甲表明,其他条件相同时, 浓度越大,其分解速率越快 浓度越大,其分解速率越快 |
B.图乙表明,其他条件相同时,溶液pH越大, 分解速率越快 分解速率越快 |
C.图丙表明,少量 存在时,溶液碱性越强, 存在时,溶液碱性越强, 分解速率越快 分解速率越快 |
D.图丙和图丁表明,碱性溶液中, 对 对 分解速率的影响大 分解速率的影响大 |
您最近一年使用:0次
2022-07-13更新
|
194次组卷
|
2卷引用:河南省商丘名校2021-2022学年高一下期期末联考化学试题
名校
5 . 以 为催化剂的光热化学循环分解
为催化剂的光热化学循环分解 的反应,为室温气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时能量变化如图所示:
的反应,为室温气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时能量变化如图所示:
 为催化剂的光热化学循环分解
为催化剂的光热化学循环分解 的反应,为室温气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时能量变化如图所示:
的反应,为室温气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时能量变化如图所示: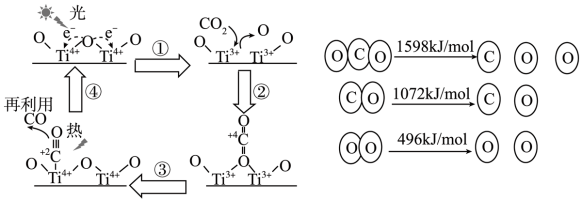
| A.过程①中吸收能量使得钛氧键发生了断裂 |
| B.该反应中,光能和热能转化为化学能 |
| C.使用催化剂可以提高化学反应速率 |
| D.2 mol二氧化碳完全分解生成2 mol一氧化碳和1 mol氧气需要吸收30kJ能量 |
您最近一年使用:0次
2022-06-26更新
|
710次组卷
|
11卷引用:河南省洛阳市2022-2023学年高一下学期期末质量检测化学试卷
河南省洛阳市2022-2023学年高一下学期期末质量检测化学试卷北京市中国人民大学附属中学 2019-2020 学年高一下学期期末练习化学试题江西省景德镇一中2020-2021学年高一下学期期中考试化学(2班)试题湖南省长沙市南雅中学2021-2022学年高一上学期期中考试化学试题浙江省慈溪市2021-2022学年高一下学期期末考试化学试题辽宁省鞍山市第三中学2021-2022学年高一下学期期末考试化学试题湖南省长沙市南雅中学2021-2022学年高一下学期期中考试化学试题云南省开远市第一中学校2022-2023学年高一下学期6月半月考化学试题北京市中国人民大学附属中学2021-2022学年高一下学期期末考试化学试题江苏省连云港市赣榆区2023-2024学年高一下学期4月期中考试化学试题(已下线)卷02 小题素养卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)
名校
解题方法
6 . 某化学小组欲测定KClO3溶液与NaHSO3溶液反应的化学反应速率。所用试剂为10mL0.1mol/LKClO3溶液和10mL0.3mol/L NaHSO3溶液,所得数据如图所示。
已知:ClO +3HSO
+3HSO =Cl-+3SO
=Cl-+3SO +3H+。
+3H+。
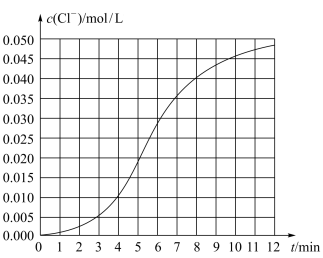
(1)根据实验数据可知,该反应在0~4min的平均反应速率:v(Cl-)=____ mol/(L·min)。
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大,12min后逐渐变慢(12min后图略)。
i.小组同学针对这一现象进一步通过测定c(Cl-)随时间变化的曲线探究速率先增大的原因,具体如表所示。
①补全方案I中的实验操作:____ 。
②方案II中的假设为____ 。
③除I、II、III中的假设外,还可以提出的假设是____ 。
④在已知方案I的假设不成立的情况下,某同学从控制变量的角度思考,认为方案III中实验操作设计不严谨,请进行改进:____ 。
ii.12min后,化学反应速率变慢的原因是_____ 。
已知:ClO
 +3HSO
+3HSO =Cl-+3SO
=Cl-+3SO +3H+。
+3H+。
(1)根据实验数据可知,该反应在0~4min的平均反应速率:v(Cl-)=
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大,12min后逐渐变慢(12min后图略)。
i.小组同学针对这一现象进一步通过测定c(Cl-)随时间变化的曲线探究速率先增大的原因,具体如表所示。
| 方案 | 假设 | 实验操作 |
| I | 该反应放热,使溶液温度升高,反应速率加快 | 向烧杯中加入10mL0.1mol/LKClO3溶液和10mL0.3mol/LNaHSO3溶液,_____ |
| II | ____ | 取10mL0.1mol/L KClO3溶液加入烧杯中,向其中加入少量NaCl固体,再加入10mL0.3mol/LNaHSO3溶液 |
| III | 溶液酸性增强加快了化学反应速率 | 分别向2只烧杯中加入10mL0.1mol/LKClO3溶液;向烧杯①中加入1mL水,向烧杯②中加入1mL0.2mol/L盐酸;再分别向2只烧杯中加入10mL0.3mol/LNaHSO3溶液 |
②方案II中的假设为
③除I、II、III中的假设外,还可以提出的假设是
④在已知方案I的假设不成立的情况下,某同学从控制变量的角度思考,认为方案III中实验操作设计不严谨,请进行改进:
ii.12min后,化学反应速率变慢的原因是
您最近一年使用:0次
2022-06-18更新
|
461次组卷
|
12卷引用:河南省洛阳市2020-2021学年高一下学期期中考试化学试题
河南省洛阳市2020-2021学年高一下学期期中考试化学试题【全国百强校】浙江省余姚中学2018-2019学年高一下学期3月月考化学试题课时1 化学反应的速率——A学习区 夯实基础(人教版必修2)课时1 化学反应的速率——A学习区 夯实基础(人教版(2019)第二册)必修第二册RJ第6章第二节 化学反应的速率与限度 课时1贵州省“三新”改革联盟2021-2022学年高一下学期校联考等级考(四)化学试题北京海淀区八一学校2021-2022学年高一下学期6月月考化学试题2019版鲁科化学必修第二册第2章本章自我评价课后习题人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第一节 化学反应速率 课时2 影响化学反应速率的因素选择性必修1(SJ)专题2第一单元课时2 影响化学反应速率的因素河北省任丘一中2021-2022学年高二上学期阶段考试(一)化学试题2.1.2影响化学反应速率的因素 课后
7 . 装置正确且能达到相应实验目的的是
| A | B | C | D |
 |  | 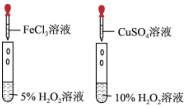 | 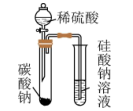 |
制备并收集少量 | 除去乙烷中的杂质乙烯 | 比较 、 、 对 对 分解的催化效果 分解的催化效果 | 比较S、C、 的非金属性强弱 的非金属性强弱 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-06-18更新
|
206次组卷
|
2卷引用:河南省顶级名校2021-2022学年高一下学期6月月考化学试题
名校
8 . 烯烃与氢气混合在常温常压时未反应,高温时反应很慢,但在适当的催化剂存在时可反应生成烧烃,一般认为加氢反应是在催化剂表面上进行。反应过程如图所示:

下列说法错误的是

下列说法错误的是
| A.乙烯和H2生成乙烷的反应是放热反应 | B.催化剂的使用不能提高反应物的转化率 |
| C.该反应过程只有非极性共价键断裂和形成 | D.乙烯和H2生成乙烷的反应类型是加成反应 |
您最近一年使用:0次
2022-06-17更新
|
85次组卷
|
2卷引用:河南省洛阳市强基联盟2023-2024学年高一下学期3月月考化学试题
名校
解题方法
9 . 下列生产或实验事实引出的结论不正确的是
| 选项 | 事实 | 结论 |
| A | 其他条件相同,Na2S2O3和H2SO4溶液反应,升高溶液的温度,析出相同质量的硫所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
| B | 把Ba(OH)2•8H2O晶体与氧化铵晶体放入烧杯,用玻璃棒快速搅拌,烧杯变凉 | 反应物的总能量低于生成物的总能量 |
| C | 在2L的密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g),把密闭容器的容积改为1L,重新发生该反应 2NH3(g),把密闭容器的容积改为1L,重新发生该反应 | 反应速率减慢 |
| D | A、B两支试管中分别加入等体积5%的H2O2溶液,在A试管中加2~3滴蒸馏水,B试管中加入2-3滴氧化铁溶液,B试管中产生气泡较快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-06-12更新
|
252次组卷
|
4卷引用:河南省郸城第一高级中学2021-2022学年高一下学期第二次月考化学试题
名校
10 . 工业上生产硫酸的主要反应为2SO2+O2(g)  2SO3(g)(放热反应);现在一个2L的容积不变的密闭容器中投入2 mol SO2和1molO2,研究温度对SO2的平衡转化率和对催化剂催化效率的影响,结果如图所示。下列说法正确的是
2SO3(g)(放热反应);现在一个2L的容积不变的密闭容器中投入2 mol SO2和1molO2,研究温度对SO2的平衡转化率和对催化剂催化效率的影响,结果如图所示。下列说法正确的是
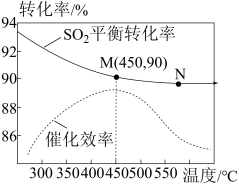
 2SO3(g)(放热反应);现在一个2L的容积不变的密闭容器中投入2 mol SO2和1molO2,研究温度对SO2的平衡转化率和对催化剂催化效率的影响,结果如图所示。下列说法正确的是
2SO3(g)(放热反应);现在一个2L的容积不变的密闭容器中投入2 mol SO2和1molO2,研究温度对SO2的平衡转化率和对催化剂催化效率的影响,结果如图所示。下列说法正确的是
| A.升高温度,正反应速率增大,逆反应速率减小 |
| B.工业合成SO3的最佳温度是450℃ |
| C.SO3的生产速率:V(N)大于V(M) |
| D.450℃时,若5min达到平衡,则v(O2)=0.18mol·L-1·min-1 |
您最近一年使用:0次
2022-06-11更新
|
258次组卷
|
2卷引用:河南省顶级名校2021-2022学年高一下学期期末考试化学试题



