名校
1 . 双功能催化剂(能吸附不同粒子)催化水煤气变换反应: ,反应过程示意图如图:
,反应过程示意图如图:
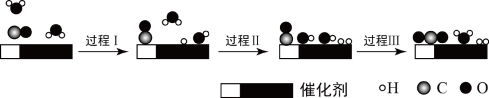
下列说法错误的是
 ,反应过程示意图如图:
,反应过程示意图如图:
下列说法错误的是
| A.过程Ⅰ、Ⅱ中都存在吸附和断键 |
| B.过程Ⅲ既生成极性共价键,又生成非极性共价键 |
C.使用催化剂不改变反应的 |
D.由图可知,整个反应过程中,起始时的2个 只有一个参与了反应 只有一个参与了反应 |
您最近一年使用:0次
名校
2 . 根据所学知识,回答下列问题:
(1)下列变化中,属于放热反应的是_______ ,属于吸热反应的是_______ 。(填标号)
①氧化钙与水反应;②石灰石在高温下的分解反应;③酸碱中和反应;④二氧化碳通过炽热的炭发生的反应;⑤食物因氧化而腐败发生的反应;⑥Ba(OH)2·8H2O与NH4Cl的反应;⑦干冰汽化。
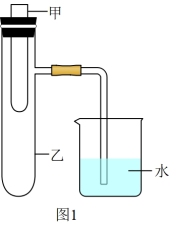
(2)为探究固体M溶于水的热效应,选择图1装置进行实验(在甲中进行)。观察到烧杯里产生气泡,则M溶于水_______ (填“一定”或“可能”)是放热反应,理由是_______ 。
(3)工业上用CO生产燃料甲醇,一定条件下发生反应CO(g)+2H2(g) CH3OH(g),反应过程中的能量变化情况如图2所示。
CH3OH(g),反应过程中的能量变化情况如图2所示。
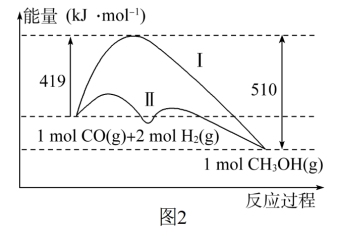
①曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。该反应是_______ (填“吸热”或“放热”)反应。当反应生成1.5molCH3OH(g)时,能量变化值是_______ kJ。
②选择适宜的催化剂_______ (填“能”或“不能”)改变该反应的反应热。
(1)下列变化中,属于放热反应的是
①氧化钙与水反应;②石灰石在高温下的分解反应;③酸碱中和反应;④二氧化碳通过炽热的炭发生的反应;⑤食物因氧化而腐败发生的反应;⑥Ba(OH)2·8H2O与NH4Cl的反应;⑦干冰汽化。
(2)为探究固体M溶于水的热效应,选择图1装置进行实验(在甲中进行)。观察到烧杯里产生气泡,则M溶于水

(3)工业上用CO生产燃料甲醇,一定条件下发生反应CO(g)+2H2(g)
 CH3OH(g),反应过程中的能量变化情况如图2所示。
CH3OH(g),反应过程中的能量变化情况如图2所示。
①曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。该反应是
②选择适宜的催化剂
您最近一年使用:0次
2022-04-20更新
|
217次组卷
|
3卷引用:河南省创新发展联盟2021-2022学年高一下学期联考(三)化学试题
3 . CO2催化加氢制CO技术是兼顾新能源和实现碳达峰的重要途径之一,该反应机理如图所示。下列说法错误的是


A.反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH达到平衡后,若升温,c(H2)降低,则ΔH>0 CO(g)+H2O(g) ΔH达到平衡后,若升温,c(H2)降低,则ΔH>0 |
| B.催化剂表面易于形成氧空位,有效促进CO2的吸附活化 |
| C.图中的a、b、c、d、e五个步骤中,每个步骤都有化学键的断裂与形成 |
| D.催化剂(In2O3)能加快催化加氢的速率,是因为降低了反应的活化能 |
您最近一年使用:0次
2022-03-19更新
|
236次组卷
|
3卷引用:河南省豫南名校2021-2022学年高一下学期六月联考化学试题
河南省豫南名校2021-2022学年高一下学期六月联考化学试题河南省许平汝联盟2021-2022学年高二下学期开学考试化学试题(已下线)押全国卷理综第13题 反应机理图分析、能垒图分析等创新题型及阿伏加德罗常数-备战2022年高考化学临考题号押题(全国卷)
名校
4 . 对于可逆反应CO(g)+H2O(g) CO2(g)+H2(g),其他条件相同,在不加催化剂(甲)和加入合适的催化剂(乙)时,反应速率和时间的图象如图所示。下列说法中正确的是
CO2(g)+H2(g),其他条件相同,在不加催化剂(甲)和加入合适的催化剂(乙)时,反应速率和时间的图象如图所示。下列说法中正确的是
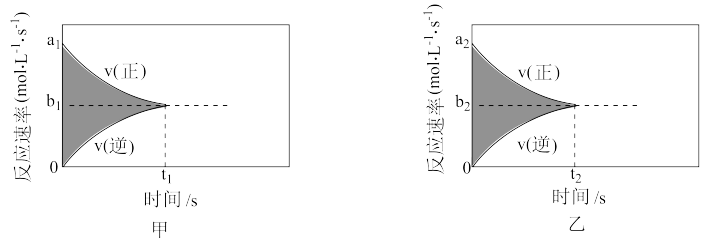
 CO2(g)+H2(g),其他条件相同,在不加催化剂(甲)和加入合适的催化剂(乙)时,反应速率和时间的图象如图所示。下列说法中正确的是
CO2(g)+H2(g),其他条件相同,在不加催化剂(甲)和加入合适的催化剂(乙)时,反应速率和时间的图象如图所示。下列说法中正确的是
| A.乙中,反应由开始到平衡生成的c(H2)=b2t2mol·L-1 |
| B.阴影部分面积S表示物质的浓度变化,S(乙)=S(甲) |
| C.该反应的△H>0 |
| D.甲中用不同物质来表示0到t1内的反应速率,所得的数值不同 |
您最近一年使用:0次
2022-03-18更新
|
247次组卷
|
2卷引用:河南省平顶山第一中学2022-2023学年高一下学期校内质量检测(一)化学试题
名校
5 . 某化学实验小组进行如下实验:将稀盐酸、 和
和 溶液倒入烧杯中,将一根洁净的铁丝制作成心形放入烧杯中,铁丝上有气泡生成,其周围溶液变成红色;一段时间后铁丝周围溶液开始产生大量气泡且生成气泡越来越快。下列说法错误的是
溶液倒入烧杯中,将一根洁净的铁丝制作成心形放入烧杯中,铁丝上有气泡生成,其周围溶液变成红色;一段时间后铁丝周围溶液开始产生大量气泡且生成气泡越来越快。下列说法错误的是
 和
和 溶液倒入烧杯中,将一根洁净的铁丝制作成心形放入烧杯中,铁丝上有气泡生成,其周围溶液变成红色;一段时间后铁丝周围溶液开始产生大量气泡且生成气泡越来越快。下列说法错误的是
溶液倒入烧杯中,将一根洁净的铁丝制作成心形放入烧杯中,铁丝上有气泡生成,其周围溶液变成红色;一段时间后铁丝周围溶液开始产生大量气泡且生成气泡越来越快。下列说法错误的是A.该过程中产生的气体为 和 和 |
B. 能加快 能加快 的分解 的分解 |
C. 、 、 均被氧化 均被氧化 |
| D.反应结束后,向烧杯中加入足量维生素C可使溶液红色褪去 |
您最近一年使用:0次
2022-01-23更新
|
811次组卷
|
5卷引用:河南省郑州市部分中学2021-2022学年高一上学期期末考试化学试题
名校
6 . 铁元素的“价—类”二维图如图所示:
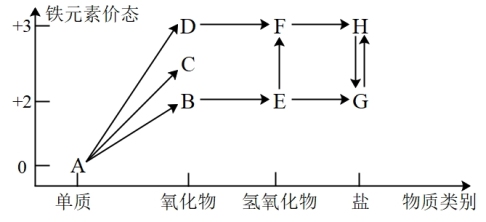
(1)C的化学式是_______ , 反应的化学方程式是
反应的化学方程式是_______ ,反应过程的现象为_______ 。
(2)维生素C可将H转化为G,维生素C具有_______ (填“酸性”、“氧化性”或“还原性”)。
(3)在指定条件下,下列铁及其化合物之间的转化不能实现的是_______ 。
A. B.
B.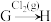 C.
C.
(4)某小组同学设计如下实验,研究亚铁盐与 溶液的反应。
溶液的反应。
试剂:酸化的 溶液,
溶液, 溶液
溶液
①上述实验中 溶液与G溶液反应的离子方程式是
溶液与G溶液反应的离子方程式是_______ 。
②产生气泡的原因是_______ 。

(1)C的化学式是
 反应的化学方程式是
反应的化学方程式是(2)维生素C可将H转化为G,维生素C具有
(3)在指定条件下,下列铁及其化合物之间的转化不能实现的是
A.
 B.
B.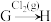 C.
C.
(4)某小组同学设计如下实验,研究亚铁盐与
 溶液的反应。
溶液的反应。试剂:酸化的
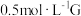 溶液,
溶液, 溶液
溶液| 操作 | 现象 |
取 酸化的G溶液于试管中,加入5滴 酸化的G溶液于试管中,加入5滴 溶液 溶液 | 溶液立即变为棕黄色,稍后,产生气泡。 |
向反应后的溶液中加入 溶液 溶液 | 溶液变红 |
 溶液与G溶液反应的离子方程式是
溶液与G溶液反应的离子方程式是②产生气泡的原因是
您最近一年使用:0次
2022-01-23更新
|
805次组卷
|
8卷引用:河南省宜阳县第一高级中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
7 . 研究表明 与
与 在
在 作用下发生反应,下列说法
作用下发生反应,下列说法不正确 的是
 与
与 在
在 作用下发生反应,下列说法
作用下发生反应,下列说法
A.反应总过程 |
B. 使反应的活化能减小 使反应的活化能减小 |
C. 是该反应的催化剂 是该反应的催化剂 |
D. 、 、 两步反应均为放热反应 两步反应均为放热反应 |
您最近一年使用:0次
2021-11-06更新
|
938次组卷
|
21卷引用:【全国百强校】河南省郑州市第一中学2018-2019学年高一下学期期中考试化学试题
【全国百强校】河南省郑州市第一中学2018-2019学年高一下学期期中考试化学试题河南省范县第一中学2021-2022学年高二上学期期中检测化学试题【全国百强校】广东省佛山市第一中学2018-2019学年高二上学期第一次段考化学试题【全国百强校】山西省太原市第五中学2018-2019学年高二(理)上学期10月月考化学试题【市级联考】广东省清远市2018-2019学年高二第一学期期末质量检测化学试题黑龙江省大庆实验中学2019-2020学年高二上学期第一次月考化学试题江苏省常州市田家炳高级中学 2019-2020学年高二上学期12月份阶段调研考试化学试题北京市海淀人大附中西山学校2020-2021学年高二上学期期中考试化学试题湖南省常德市淮阳中学2019-2020学年高二下学期期中考试化学试题山东省济南市2020-2021学年高二1月学情诊断化学试题重庆市第七中学校2021-2022学年高二上学期第一次月考化学试题北京市第十四中学2021-2022学年高二上学期期中考试化学试题黑龙江省绥化市第一中学2021-2022学年高二上学期期中考试化学试卷山东师范大学附属中学2021-2022学年高二上学期期中考试化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】17宁夏银川市第二中学2021-2022学年高二下学期期末考试化学试题(已下线)第23讲化学反应与热能云南省昆明市西山区2022-2023学年高二上学期1月期末考试化学试题辽宁省重点高中沈阳市郊联体2022-2023学年高三上学期期中考试化学试题广东省广州市第八十九中学2023-2024学年高二上学期10月月考化学试题山东省聊城颐中外国语学校2023-2024学年高二上学期期中考试化学试题
名校
解题方法
8 . H2O2分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法不正确的是
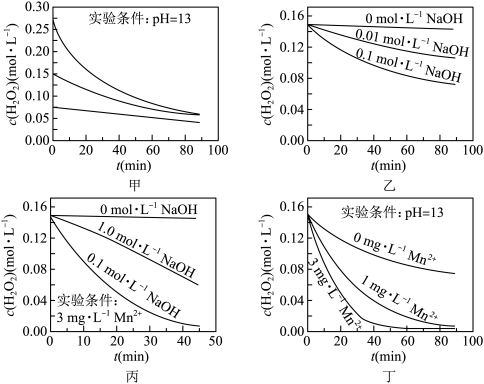

| A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越慢 |
| B.图乙表明,其他条件相同时,溶液碱性越弱,H2O2分解速率越慢 |
| C.图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快 |
| D.图丙和图丁表明,碱性溶液中,c(Mn2+)对H2O2分解速率的影响大 |
您最近一年使用:0次
名校
9 . 研究化学反应速率是为了控制化学反应速率,使生产、生活中的大部分化学反应的速率都尽可能随着人们的意向改变。回答下列问题:
(1)某同学为探究 分解的影响因素(温度为
分解的影响因素(温度为 ,控制温度装置已省略)设计如图实验,不同时间测得的实验数据如表(
,控制温度装置已省略)设计如图实验,不同时间测得的实验数据如表( 的起始浓度为
的起始浓度为 )。
)。
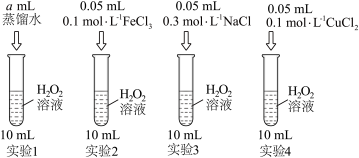
①
___________ 。
②探究 对
对 分解速率的影响,应选择的实验有实验2、
分解速率的影响,应选择的实验有实验2、___________ ,实验前10min平均反应速率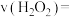
___________  ,实验2还能验证
,实验2还能验证___________ 对反应速率的影响。
③在②的基础上,实验2、实验4对比证明了___________ (填“ ”或“
”或“ ”)的催化能力较强。
”)的催化能力较强。
(2) 分解的化学方程式为
分解的化学方程式为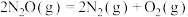 ,该反应生成物的总能量小于反应物的总能量。将
,该反应生成物的总能量小于反应物的总能量。将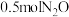 置于某恒容绝热反应器中发生该反应,反应速率与时间的关系如图。
置于某恒容绝热反应器中发生该反应,反应速率与时间的关系如图。
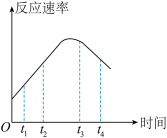
① 反应速率增加的原因是
反应速率增加的原因是___________ 。
②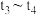 反应速率降低的原因是
反应速率降低的原因是___________ 。
(1)某同学为探究
 分解的影响因素(温度为
分解的影响因素(温度为 ,控制温度装置已省略)设计如图实验,不同时间测得的实验数据如表(
,控制温度装置已省略)设计如图实验,不同时间测得的实验数据如表( 的起始浓度为
的起始浓度为 )。
)。
时间/min 浓度/ 实验编号 | 0 | 2 | 10 | 15 | 20 |
| 1 | 1 | 几乎无变化 | 几乎无变化 | 几乎无变化 | 几乎无变化 |
| 2 | 1 | 0.80 | 0.65 | 0.52 | 0.40 |
| 3 | 1 | 几乎无变化 | 几乎无变化 | 几乎无变化 | 几乎无变化 |
| 4 | 1 | 0.90 | 0.82 | 0.75 | 0.70 |

②探究
 对
对 分解速率的影响,应选择的实验有实验2、
分解速率的影响,应选择的实验有实验2、
 ,实验2还能验证
,实验2还能验证③在②的基础上,实验2、实验4对比证明了
 ”或“
”或“ ”)的催化能力较强。
”)的催化能力较强。(2)
 分解的化学方程式为
分解的化学方程式为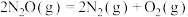 ,该反应生成物的总能量小于反应物的总能量。将
,该反应生成物的总能量小于反应物的总能量。将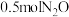 置于某恒容绝热反应器中发生该反应,反应速率与时间的关系如图。
置于某恒容绝热反应器中发生该反应,反应速率与时间的关系如图。
①
 反应速率增加的原因是
反应速率增加的原因是②
 反应速率降低的原因是
反应速率降低的原因是
您最近一年使用:0次
2021-07-21更新
|
238次组卷
|
2卷引用:河南省南阳市第一中学校2022-2023学年高一下学期第二次月考化学试题
解题方法
10 . 实验发现加入M能提高 和I-的反应速率,其原理如图所示,依次发生反应1、2,下列说法正确的是
和I-的反应速率,其原理如图所示,依次发生反应1、2,下列说法正确的是
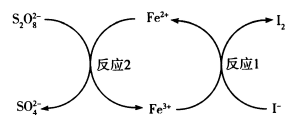
 和I-的反应速率,其原理如图所示,依次发生反应1、2,下列说法正确的是
和I-的反应速率,其原理如图所示,依次发生反应1、2,下列说法正确的是
| A.M可能是Fe(OH)3 |
| B.Fe2+是该反应的催化剂 |
| C.反应1为2Fe3++2I-=2Fe2++I2 |
D.将反应2设计成原电池, 在负极反应 在负极反应 |
您最近一年使用:0次




