名校
1 . I.某实验小组利用压强传感器,数据采集器和计算机等数字化实验设备组成数据采集系统,探究外界条件对双氧水分解速率的影响。实验装置(下图)和所完成实验编号如下。请回答下列问题。
资料显示:通常情况下, 较稳定,不易分解。
较稳定,不易分解。
实验药品: 、
、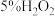 、
、 、
、

(1)用化学方程式表示实验原理_______ 。
(2)编号①和②的实验目的是_______ 。
(3)编号③④⑤探究的是不同催化剂条件下双氧水的分解速率,实验结果如图所示。说明图中曲线的含义_______ 。结合实验条件,分析三条曲线的区别_______ 。

Ⅱ.近期,我国科学家在实验室中成功用二氧化碳合成了淀粉,反应速率大小是评价该研究成果的重要依据。为探究影响反应速率的因素,某同学在实验室中寻找合适试剂进行实验。

(4)为比较 和
和 对
对 分解的催化效果,设计了以下实验:
分解的催化效果,设计了以下实验:
若该实验中反应速率①>②,能否说明 对
对 分解的催化效果一定比
分解的催化效果一定比 好,给出你的判断并简要说明理由
好,给出你的判断并简要说明理由_______ 。
(5)丙酮的碘代反应 的速率方程为
的速率方程为 (其中v为反应速率,k为速率常数,
(其中v为反应速率,k为速率常数,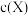 为反应物X的浓度),其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为
为反应物X的浓度),其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为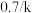 。改变反应物浓度时,反应的瞬时速率如表所示:
。改变反应物浓度时,反应的瞬时速率如表所示:
①该反应的速率常数k的数值为_______ 。
②在过量的 存在时,反应掉
存在时,反应掉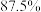 的
的 所需的时间是
所需的时间是_______  。
。
资料显示:通常情况下,
 较稳定,不易分解。
较稳定,不易分解。实验药品:
 、
、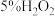 、
、 、
、

| 实验编号 | 实验药品 | 催化剂 |
| ① |  溶液 溶液 |  |
| ② |  溶液 溶液 |  |
| ③ |  溶液 溶液 | 无催化剂 |
| ④ |  溶液 溶液 |  |
| ⑤ |  溶液 溶液 |  |
(2)编号①和②的实验目的是
(3)编号③④⑤探究的是不同催化剂条件下双氧水的分解速率,实验结果如图所示。说明图中曲线的含义

Ⅱ.近期,我国科学家在实验室中成功用二氧化碳合成了淀粉,反应速率大小是评价该研究成果的重要依据。为探究影响反应速率的因素,某同学在实验室中寻找合适试剂进行实验。

(4)为比较
 和
和 对
对 分解的催化效果,设计了以下实验:
分解的催化效果,设计了以下实验:若该实验中反应速率①>②,能否说明
 对
对 分解的催化效果一定比
分解的催化效果一定比 好,给出你的判断并简要说明理由
好,给出你的判断并简要说明理由(5)丙酮的碘代反应
 的速率方程为
的速率方程为 (其中v为反应速率,k为速率常数,
(其中v为反应速率,k为速率常数,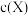 为反应物X的浓度),其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为
为反应物X的浓度),其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为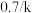 。改变反应物浓度时,反应的瞬时速率如表所示:
。改变反应物浓度时,反应的瞬时速率如表所示: |  |  |
| 0.25 | 0.050 | 1.4 |
| 0.50 | 0.050 | 2.8 |
| 1.00 | 0.050 | 5.6 |
| 0.50 | 0.10 | 2.8 |
②在过量的
 存在时,反应掉
存在时,反应掉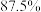 的
的 所需的时间是
所需的时间是 。
。
您最近一年使用:0次
名校
2 . 漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:5HClO2===4ClO2↑+H++Cl-+2H2O。(HClO2为弱酸)向NaClO2溶液中滴加H2SO4,开始时HClO2分解反应缓慢,随后反应迅速加快,其原因是( )
| A.溶液中的H+起催化作用 | B.在酸性条件下,亚氯酸钠的氧化性增强 |
| C.ClO2逸出,使反应的生成物浓度降低 | D.溶液中的Cl-起催化作用 |
您最近一年使用:0次
2019-01-26更新
|
478次组卷
|
10卷引用:陕西省西安市第八十九中学2022-2023学年高二上学期期末测试化学试题
陕西省西安市第八十九中学2022-2023学年高二上学期期末测试化学试题2014-2015广东省深圳市南山区上学期高一化学期末试卷2016-2017学年云南省临沧一中高二上起点考试化学卷四川省成都外国语学校2017-2018学年高二下学期期中考试化学试题成都外国语学校2017-2018学年高二下学期期中考试化学试题【校级联考】重庆市江津中学、合川中学等七校2018-2019学年高二上学期期末考试化学试题【校级联考】安徽省定远重点中学2018-2019学年高二下学期开学考试化学试题吉林省白山市抚松县第六中学2019-2020学年高二上学期期中考试化学试题安徽省池州市第一中学2020-2021学年高二上学期9月月考化学试题广东省汕头市澄海中学2020-2021学年高二上学期期中考试化学(选考)试题
名校
解题方法
3 . 研究不同 pH 时 CuSO4 溶液对 H2O2 分解的催化作用。资料:a.Cu2O 为红色固体,难溶于水,能溶于硫酸,生成 Cu 和Cu2+。b.CuO2 为棕褐色固体,难溶于水,能溶于硫酸,生成 Cu2+和 H2O2。c.H2O2 有弱酸性:H2O2  H+ +HO2-,HO2-
H+ +HO2-,HO2-  H+ +O22-。
H+ +O22-。
(1) 经检验生成的气体均为 O2,Ⅰ中 CuSO4 催化分解 H2O2 的化学方程式是__ 。
(2)对Ⅲ中棕褐色沉淀的成分提出 2 种假设:ⅰ.CuO2,ⅱ.Cu2O 和CuO2 的混合物。为检验上述假设,进行实验Ⅳ:过滤Ⅲ中的沉淀,洗涤,加入过量硫酸,沉淀完全溶解,溶液呈蓝色,并产生少量气泡。
①若Ⅲ中生成的沉淀为 CuO2,其反应的离子方程式是__ 。
②依据Ⅳ中沉淀完全溶解,甲同学认为假设ⅱ不成立,乙同学不同意甲同学的观点,理由是__ 。
③为探究沉淀中是否存在 Cu2O,设计如下实验:
将Ⅲ中沉淀洗涤、干燥后,取 a g 固体溶于过量稀硫酸,充分加热。冷却后调节溶液 pH,以 PAN 为指示剂,向溶液中滴加 c mol·L − 1EDTA 溶液至滴定终点,消耗 EDTA 溶液 V mL。V=__ ,可知沉淀中不含 Cu2O,假设ⅰ成立。(已知:Cu2++EDTA= EDTA-Cu2+,M(CuO2)=96 g·mol − 1,M(Cu2O)=144 g·mol−1)
(3)结合方程式,运用化学反应原理解释Ⅲ中生成的沉淀多于Ⅱ中的原因__ 。
(4)研究Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 分解速率不同的原因。
实验Ⅴ:在试管中分别取 1 mL pH=2、3、5 的 1 mol·L−1 Na2SO4 溶液,向其中各加入 0.5 mL 30% H2O2 溶液,三支试管中均无明显现象。
实验Ⅵ:__ (填实验操作和现象),说明 CuO2 能够催化 H2O2 分解。
(5)综合上述实验,Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 的分解速率不同的原因是__ 。
 H+ +HO2-,HO2-
H+ +HO2-,HO2-  H+ +O22-。
H+ +O22-。| 编号 | 实验 | 现象 |
| Ⅰ | 向 1 mL pH=2 的 1 mol·L− 1 CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 出现少量气泡 |
| Ⅱ | 向 1 mL pH=3 的 1 mol·L− 1 CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 立即产生少量棕黄色沉淀,出现较明显气泡 |
| Ⅲ | 向 1 mL pH=5 的 1 mol·L− 1CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 立即产生大量棕褐色沉淀,产生大量气泡 |
(2)对Ⅲ中棕褐色沉淀的成分提出 2 种假设:ⅰ.CuO2,ⅱ.Cu2O 和CuO2 的混合物。为检验上述假设,进行实验Ⅳ:过滤Ⅲ中的沉淀,洗涤,加入过量硫酸,沉淀完全溶解,溶液呈蓝色,并产生少量气泡。
①若Ⅲ中生成的沉淀为 CuO2,其反应的离子方程式是
②依据Ⅳ中沉淀完全溶解,甲同学认为假设ⅱ不成立,乙同学不同意甲同学的观点,理由是
③为探究沉淀中是否存在 Cu2O,设计如下实验:
将Ⅲ中沉淀洗涤、干燥后,取 a g 固体溶于过量稀硫酸,充分加热。冷却后调节溶液 pH,以 PAN 为指示剂,向溶液中滴加 c mol·L − 1EDTA 溶液至滴定终点,消耗 EDTA 溶液 V mL。V=
(3)结合方程式,运用化学反应原理解释Ⅲ中生成的沉淀多于Ⅱ中的原因
(4)研究Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 分解速率不同的原因。
实验Ⅴ:在试管中分别取 1 mL pH=2、3、5 的 1 mol·L−1 Na2SO4 溶液,向其中各加入 0.5 mL 30% H2O2 溶液,三支试管中均无明显现象。
实验Ⅵ:
(5)综合上述实验,Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 的分解速率不同的原因是
您最近一年使用:0次
2020-04-08更新
|
666次组卷
|
8卷引用:北京市密云二中2023-2024学年高二上学期10月月考化学试卷
北京市密云二中2023-2024学年高二上学期10月月考化学试卷 北京市西城区2020届高三一模化学试题(已下线)考点08 化学反应速率及其影响因素-2020年高考化学命题预测与模拟试题分类精编北京市2020届高三化学高考模拟试题(等级考试模拟试题)(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编:科学探究北京市2020届高三高考模拟试题 (等级考试模拟试题)北京市第五中学2021届高三上学期第二次阶段性考试化学试题河北省实验中学2021届高三上学期第一次月考化学试题
4 . 某研究性学习组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
(1)通过实验A、B,可探究出_______ 的改变对反应速率的影响,其中V1=_____ ,T1=_____ ,通过实验_______ 可探究出温度变化对化学反应速率的影响。
(2)若t1<8,则由实验A、B可以得出的结论是______________________________ ;利用实验B中数据计算,用KMnO4的浓度变化表示的反应速率为____________ 。
(3)该反应中有无色无味气体产生且锰被还原为Mn2+,写出相应反应的离子方程式_________________________ 。
(4)该小组的一位同学通过查阅资料发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是_______________ ,相应的粒子最有可能是(填符号)_______ 。
| 实验序号 | 实验温度 | KMnO4溶液 | H2C2O4溶液 | H2O | 溶液褪色时间 | ||
| V(mL) | C(mol/L) | V(mL) | C(mol/L) | V(mL) | t(s) | ||
| A | 293K | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
| B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
| C | 313K | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(2)若t1<8,则由实验A、B可以得出的结论是
(3)该反应中有无色无味气体产生且锰被还原为Mn2+,写出相应反应的离子方程式
(4)该小组的一位同学通过查阅资料发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是
您最近一年使用:0次
2017-10-19更新
|
418次组卷
|
2卷引用:微专题(2) 控制变量法探究影响化学反应速率的因素
解题方法
5 . 化学需氧量(COD)是指用强氧化剂将1L废水中的还原性物质氧化为二氧化碳和水所消耗的氧化剂的量,并换算成以 为氧化剂时所消耗
为氧化剂时所消耗 的质量。水体COD值常作为水体中有机污染物相对含量的综合指标之一、Fenton(
的质量。水体COD值常作为水体中有机污染物相对含量的综合指标之一、Fenton( )法能产生
)法能产生 和具有强氧化性的羟基自由基(·OH)引发一系列链式反应,被广泛应用于有机废水的治理。
和具有强氧化性的羟基自由基(·OH)引发一系列链式反应,被广泛应用于有机废水的治理。
(1)羟基自由基(·OH)的电子式为_______ 。
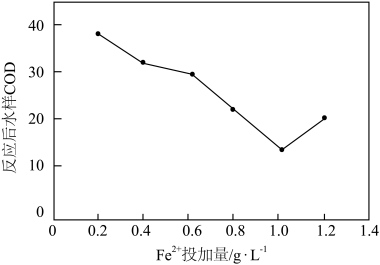
(2)分别取初始pH=4、COD=80的废水200mL,加入200mL ,改变起始投加
,改变起始投加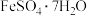 的量,反应相同时间。测得反应后水样COD随
的量,反应相同时间。测得反应后水样COD随 投加量的关系如图所示。当
投加量的关系如图所示。当 投加量超过1
投加量超过1 时,反应后水样COD不降反升的原因可能是
时,反应后水样COD不降反升的原因可能是_______ 。
(3)已知·OH更容易进攻有机物分子中电子云密度较大的基团。1-丁醇比正戊烷更容易受到·OH进攻的原因是_______ 。
(4)在Fenton法的基础上改进的基于硫酸根自由基(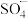 )的氧化技术引起关注。研究发现,一种
)的氧化技术引起关注。研究发现,一种 石墨烯纳米复合材料对催化活化
石墨烯纳米复合材料对催化活化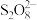 产生
产生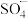 具有很好的效果。
具有很好的效果。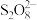 结构为
结构为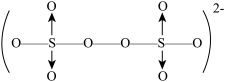 。
。
①与 试剂相比,
试剂相比, 一石墨烯/
一石墨烯/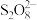 的使用范围更广。
的使用范围更广。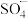 在强碱性条件下反应生成·OH,写出该反应的离子方程式:
在强碱性条件下反应生成·OH,写出该反应的离子方程式:_______ 。
②一种制取 一石墨烯纳米复合材料的物种转化关系可表示为(GO表示石墨烯)
一石墨烯纳米复合材料的物种转化关系可表示为(GO表示石墨烯)
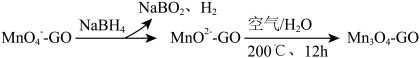
在石墨烯表面制得1mol ,理论上需要消耗
,理论上需要消耗 的物质的量为
的物质的量为_______ mol。
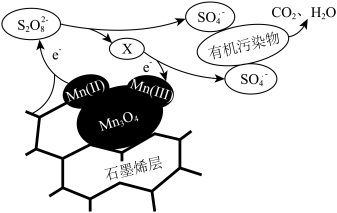
③利用该复合材料催化活化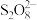 并去除废水中有机污染物的可能反应机理如图所示。该机理可描述为
并去除废水中有机污染物的可能反应机理如图所示。该机理可描述为_______ 。
 为氧化剂时所消耗
为氧化剂时所消耗 的质量。水体COD值常作为水体中有机污染物相对含量的综合指标之一、Fenton(
的质量。水体COD值常作为水体中有机污染物相对含量的综合指标之一、Fenton( )法能产生
)法能产生 和具有强氧化性的羟基自由基(·OH)引发一系列链式反应,被广泛应用于有机废水的治理。
和具有强氧化性的羟基自由基(·OH)引发一系列链式反应,被广泛应用于有机废水的治理。(1)羟基自由基(·OH)的电子式为
(2)分别取初始pH=4、COD=80的废水200mL,加入200mL
 ,改变起始投加
,改变起始投加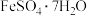 的量,反应相同时间。测得反应后水样COD随
的量,反应相同时间。测得反应后水样COD随 投加量的关系如图所示。当
投加量的关系如图所示。当 投加量超过1
投加量超过1 时,反应后水样COD不降反升的原因可能是
时,反应后水样COD不降反升的原因可能是
(3)已知·OH更容易进攻有机物分子中电子云密度较大的基团。1-丁醇比正戊烷更容易受到·OH进攻的原因是
(4)在Fenton法的基础上改进的基于硫酸根自由基(
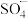 )的氧化技术引起关注。研究发现,一种
)的氧化技术引起关注。研究发现,一种 石墨烯纳米复合材料对催化活化
石墨烯纳米复合材料对催化活化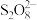 产生
产生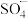 具有很好的效果。
具有很好的效果。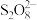 结构为
结构为 。
。①与
 试剂相比,
试剂相比, 一石墨烯/
一石墨烯/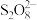 的使用范围更广。
的使用范围更广。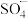 在强碱性条件下反应生成·OH,写出该反应的离子方程式:
在强碱性条件下反应生成·OH,写出该反应的离子方程式:②一种制取
 一石墨烯纳米复合材料的物种转化关系可表示为(GO表示石墨烯)
一石墨烯纳米复合材料的物种转化关系可表示为(GO表示石墨烯)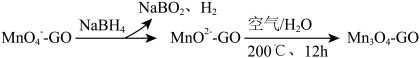
在石墨烯表面制得1mol
 ,理论上需要消耗
,理论上需要消耗 的物质的量为
的物质的量为③利用该复合材料催化活化
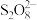 并去除废水中有机污染物的可能反应机理如图所示。该机理可描述为
并去除废水中有机污染物的可能反应机理如图所示。该机理可描述为
您最近一年使用:0次
6 . 下列实验设计及现象、结论合理的是
| 选项 | 实验目的 | 实验设计及现象 | 结论 |
| A | 探究 是否具有还原性 是否具有还原性 | 向一定浓度的 溶液中滴加少量酸性高锰酸钾溶液,高锰酸钾溶液紫红色褪去 溶液中滴加少量酸性高锰酸钾溶液,高锰酸钾溶液紫红色褪去 |  具有还原性 具有还原性 |
| B | 检验 气体中是否混有 气体中是否混有 | 将气体依次通过饱和 溶液和澄清石灰水,澄清石灰水变浑浊 溶液和澄清石灰水,澄清石灰水变浑浊 |  气体中混有 气体中混有 |
| C | 在 与 与 的混合液中再加入 的混合液中再加入 固体 固体 | 溶液颜色变浅 | 增大生成物浓度,平衡逆向移动 |
| D | 探究不同催化剂的催化效率 | 两支试管中分别盛相同温度、相同浓度、相同体积的 溶液,分别滴加相同浓度、相同体积的 溶液,分别滴加相同浓度、相同体积的 溶液与 溶液与 溶液,滴加 溶液,滴加 溶液得试管中产生气体更快 溶液得试管中产生气体更快 |  对 对 分解的催化效率更高 分解的催化效率更高 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
7 . 以 为原料制备甲烷、甲醇等能源物质具有较好的发展前景。回答下列问题:
为原料制备甲烷、甲醇等能源物质具有较好的发展前景。回答下列问题:
(1) 在固体催化表面加氢合成甲烷过程中发生以下两个反应:
在固体催化表面加氢合成甲烷过程中发生以下两个反应:
主反应: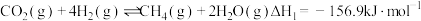
副反应: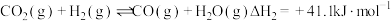
①已知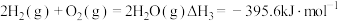 ,则
,则 燃烧的热化学方程式
燃烧的热化学方程式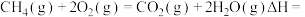
_______  。
。
②对于主反应,在一定条件下存在: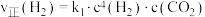 或
或 ,相应的速率与温度关系如图所示。
,相应的速率与温度关系如图所示。
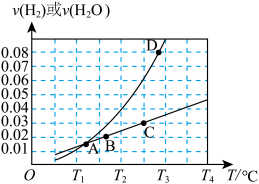
则主反应的平衡常数
_______ (用含 的代数式表示);图中
的代数式表示);图中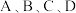 四个点中,能表示反应已达到平衡状态的是
四个点中,能表示反应已达到平衡状态的是_______ 。
(2)某研究小组采用双合金团簇催化甲烷干法重整法(DRM)取得了良好的效果。通过大量的研究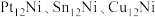 三种双金属合金团簇可用于催化
三种双金属合金团簇可用于催化 反应,在催化剂表面涉及多个基元反应,分别为过程1:甲烷逐步脱氢,过程2:
反应,在催化剂表面涉及多个基元反应,分别为过程1:甲烷逐步脱氢,过程2: 的活化(包括直接活化和氢诱导活化),过程3:
的活化(包括直接活化和氢诱导活化),过程3: 和
和 的氧化,过程4:扩散吸附反应。其反应机理如图所示。
的氧化,过程4:扩散吸附反应。其反应机理如图所示。
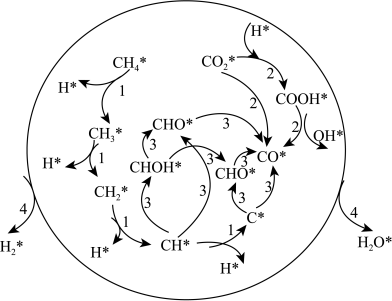
则过程3的最终产物为_______ ,过程4发生扩散吸附反应的微粒为_______ 。
(3)光催化 制甲醇技术也是研究热点。铜基纳米光催化材料还原
制甲醇技术也是研究热点。铜基纳米光催化材料还原 的机理为:光照时,低能价带失去电子并产生空穴(
的机理为:光照时,低能价带失去电子并产生空穴( ,具有强氧化性)。
,具有强氧化性)。
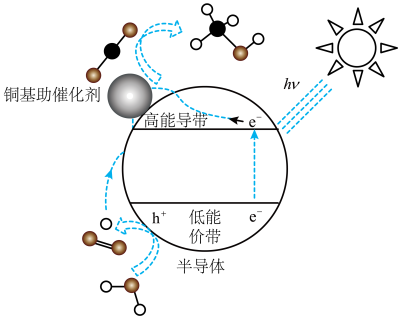
光催化原理与电解原理类似,写出高能导带的电极反应式:_______ 。太阳光激发下,在导带和价带中除了产生电子和空穴外,还会生成_______ (填写微粒名称)参与 的还原再生。
的还原再生。
 为原料制备甲烷、甲醇等能源物质具有较好的发展前景。回答下列问题:
为原料制备甲烷、甲醇等能源物质具有较好的发展前景。回答下列问题:(1)
 在固体催化表面加氢合成甲烷过程中发生以下两个反应:
在固体催化表面加氢合成甲烷过程中发生以下两个反应:主反应:
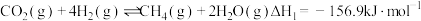
副反应:
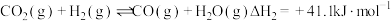
①已知
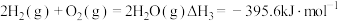 ,则
,则 燃烧的热化学方程式
燃烧的热化学方程式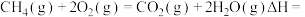
 。
。②对于主反应,在一定条件下存在:
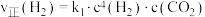 或
或 ,相应的速率与温度关系如图所示。
,相应的速率与温度关系如图所示。
则主反应的平衡常数

 的代数式表示);图中
的代数式表示);图中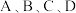 四个点中,能表示反应已达到平衡状态的是
四个点中,能表示反应已达到平衡状态的是(2)某研究小组采用双合金团簇催化甲烷干法重整法(DRM)取得了良好的效果。通过大量的研究
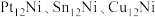 三种双金属合金团簇可用于催化
三种双金属合金团簇可用于催化 反应,在催化剂表面涉及多个基元反应,分别为过程1:甲烷逐步脱氢,过程2:
反应,在催化剂表面涉及多个基元反应,分别为过程1:甲烷逐步脱氢,过程2: 的活化(包括直接活化和氢诱导活化),过程3:
的活化(包括直接活化和氢诱导活化),过程3: 和
和 的氧化,过程4:扩散吸附反应。其反应机理如图所示。
的氧化,过程4:扩散吸附反应。其反应机理如图所示。
则过程3的最终产物为
(3)光催化
 制甲醇技术也是研究热点。铜基纳米光催化材料还原
制甲醇技术也是研究热点。铜基纳米光催化材料还原 的机理为:光照时,低能价带失去电子并产生空穴(
的机理为:光照时,低能价带失去电子并产生空穴( ,具有强氧化性)。
,具有强氧化性)。
光催化原理与电解原理类似,写出高能导带的电极反应式:
 的还原再生。
的还原再生。
您最近一年使用:0次
名校
8 . 下列实验目的、实验操作及现象、结论都正确的是
| 选项 | 实验目的 | 实验及现象 | 结论 |
| A | 验证肉桂醛中含碳碳双键 | 向肉桂醛(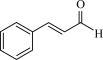 )中加入酸性KMnO4溶液 )中加入酸性KMnO4溶液 | 肉桂醛中含有碳碳双键 |
| B | 比较CuSO4和KMnO4的催化效果 | 向等体积等浓度的H2O2溶液中分别加入5滴等浓度的CuSO4溶液和KMnO4溶液,CuSO4溶液产生气泡速率快 | CuSO4催化H2O2溶液分解效果更好 |
| C | 验证菠菜中含有铁元素 | 将新鲜菠菜剪碎、研磨、溶解、过滤,向滤液中加入几滴KSCN溶液,溶液不变红 | 说明菠菜中不含铁元素 |
| D | 判断强酸和弱酸 | NaHCO3溶液显碱性,NaHSO3溶液显酸性 | 可以确定H2CO3是弱酸,无法判断H2SO3是否为弱酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-06-19更新
|
799次组卷
|
2卷引用:陕西师范大学附属中学2022-2023学年高三下学期第十次模考理综化学试题
名校
解题方法
9 . 选择性催化还原法(SCR法)去除 是脱硝问题研究的热点,催化剂的选取是技术的核心。
是脱硝问题研究的热点,催化剂的选取是技术的核心。
(1)以 为催化剂的催化原理:
为催化剂的催化原理: 与
与 形成能提供氢离子的酸性位(如图所示),
形成能提供氢离子的酸性位(如图所示), 吸附在酸性位上生成中间体继续与NO反应。
吸附在酸性位上生成中间体继续与NO反应。
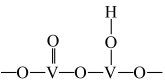
①五价钒在pH为10~13的溶液中会以焦钒酸根(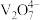 )形式存在,请写出该离子的结构式
)形式存在,请写出该离子的结构式___________ ;
②其他条件相同, 、NO以一定速率,通过一定量
、NO以一定速率,通过一定量 催化剂催化脱硝,当NO含量一定,
催化剂催化脱硝,当NO含量一定,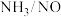 比值大于1.0后NO脱除率变化不大,其原因可能是
比值大于1.0后NO脱除率变化不大,其原因可能是___________ 。
(2)以 为催化剂的反应机理如图1所示:
为催化剂的反应机理如图1所示:

①请写出脱硝过程中总反应方程式:___________ 。
②NO脱除率随温度变化如图2所示,温度高于1000℃时NO脱除率明显下降,可能原因是:___________ 。
(3)以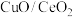 为催化剂
为催化剂
①理想 晶胞如图3所示,实际晶体中会含有部分氧空位。部分
晶胞如图3所示,实际晶体中会含有部分氧空位。部分 填充在由
填充在由 构成的
构成的___________ (填“四面体”或“八面体”)空隙中。

②Cu基催化剂对于使用CO脱去NO有着极为优异的催化性能,现探究不同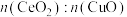 情况下脱硝、脱碳的情况。已知反应机理是CO首先吸附在
情况下脱硝、脱碳的情况。已知反应机理是CO首先吸附在 或CuO表面的活性位点上,由图像可以推断,CO反应的活性位点位于
或CuO表面的活性位点上,由图像可以推断,CO反应的活性位点位于___________ 上(填“ ”或“CuO”);
”或“CuO”);
③测定某催化剂中 质量分数,取催化剂产品0.8000g,用30mL高氯酸和20mL磷酸混合液加热溶解,冷却至室温后,用
质量分数,取催化剂产品0.8000g,用30mL高氯酸和20mL磷酸混合液加热溶解,冷却至室温后,用 硫酸亚铁铵[
硫酸亚铁铵[ ]溶液滴定,已知滴定时发生反应为
]溶液滴定,已知滴定时发生反应为 ,达到滴定终点时消耗硫酸亚铁铵溶液20.50mL,则该产品的纯度为
,达到滴定终点时消耗硫酸亚铁铵溶液20.50mL,则该产品的纯度为___________ (写出计算过程 ,计算结果保留4位有效数字)
 是脱硝问题研究的热点,催化剂的选取是技术的核心。
是脱硝问题研究的热点,催化剂的选取是技术的核心。(1)以
 为催化剂的催化原理:
为催化剂的催化原理: 与
与 形成能提供氢离子的酸性位(如图所示),
形成能提供氢离子的酸性位(如图所示), 吸附在酸性位上生成中间体继续与NO反应。
吸附在酸性位上生成中间体继续与NO反应。
①五价钒在pH为10~13的溶液中会以焦钒酸根(
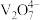 )形式存在,请写出该离子的结构式
)形式存在,请写出该离子的结构式②其他条件相同,
 、NO以一定速率,通过一定量
、NO以一定速率,通过一定量 催化剂催化脱硝,当NO含量一定,
催化剂催化脱硝,当NO含量一定,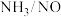 比值大于1.0后NO脱除率变化不大,其原因可能是
比值大于1.0后NO脱除率变化不大,其原因可能是(2)以
 为催化剂的反应机理如图1所示:
为催化剂的反应机理如图1所示:
①请写出脱硝过程中总反应方程式:
②NO脱除率随温度变化如图2所示,温度高于1000℃时NO脱除率明显下降,可能原因是:
(3)以
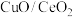 为催化剂
为催化剂①理想
 晶胞如图3所示,实际晶体中会含有部分氧空位。部分
晶胞如图3所示,实际晶体中会含有部分氧空位。部分 填充在由
填充在由 构成的
构成的
②Cu基催化剂对于使用CO脱去NO有着极为优异的催化性能,现探究不同
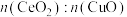 情况下脱硝、脱碳的情况。已知反应机理是CO首先吸附在
情况下脱硝、脱碳的情况。已知反应机理是CO首先吸附在 或CuO表面的活性位点上,由图像可以推断,CO反应的活性位点位于
或CuO表面的活性位点上,由图像可以推断,CO反应的活性位点位于 ”或“CuO”);
”或“CuO”);③测定某催化剂中
 质量分数,取催化剂产品0.8000g,用30mL高氯酸和20mL磷酸混合液加热溶解,冷却至室温后,用
质量分数,取催化剂产品0.8000g,用30mL高氯酸和20mL磷酸混合液加热溶解,冷却至室温后,用 硫酸亚铁铵[
硫酸亚铁铵[ ]溶液滴定,已知滴定时发生反应为
]溶液滴定,已知滴定时发生反应为 ,达到滴定终点时消耗硫酸亚铁铵溶液20.50mL,则该产品的纯度为
,达到滴定终点时消耗硫酸亚铁铵溶液20.50mL,则该产品的纯度为
您最近一年使用:0次
22-23高三上·河北衡水·阶段练习
10 . 利用“萨巴蒂尔反应”,空间站的水气整合系统将 转化为
转化为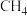 和水蒸气,配合
和水蒸气,配合 生成系统可实现
生成系统可实现 的再生。回答下列问题:
的再生。回答下列问题:
Ⅰ.萨巴蒂尔反应为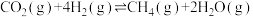

(1)已知25℃和101kPa时,
① 的燃烧热
的燃烧热 ;
;
② 的燃烧热
的燃烧热 ;
;
③
 。
。
则萨巴蒂尔反应的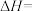
_______  。
。
(2)萨巴蒂尔反应的前三步反应历程如图所示,其中吸附在催化剂 表面的物质用“·”标注,Ts表示过渡态。从物质吸附在催化剂表面到形成过渡态的过程会
表面的物质用“·”标注,Ts表示过渡态。从物质吸附在催化剂表面到形成过渡态的过程会_______ (填“放出”或“吸收”)热量,反应历程中最小能垒(活化能)步骤的化学方程式为_______ 。
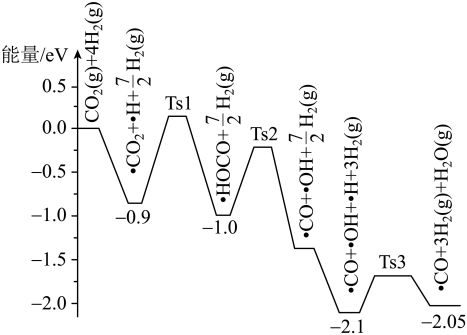
Ⅱ. 在一定条件下能与
在一定条件下能与 发生氧再生反应:
发生氧再生反应:

(3)恒压p0条件下,按 投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度的关系如图所示。350℃时,该反应的平衡常数
投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度的关系如图所示。350℃时,该反应的平衡常数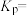
_______ (以分压表示,分压=总压×物质的量分数)。为了提高 的转化率,除升高温度外,还可采取的措施为
的转化率,除升高温度外,还可采取的措施为_______ (写出一条)。
(4)氧再生反应还可以通过酸性条件下半导体光催化转化实现,反应机理如图甲所示:
图甲
①光催化 转化为
转化为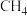 时,阴极的电极反应式为
时,阴极的电极反应式为_______ 。
②催化剂的催化效率和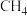 的生成速率随温度的变化关系如图乙所示。300~400℃之间,
的生成速率随温度的变化关系如图乙所示。300~400℃之间,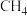 生成速率加快的原因是
生成速率加快的原因是_______ 。
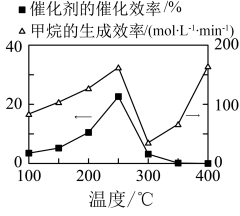
图乙
(5)氧再生反应所需的能量可由合成氨反应提供。合成氨反应的焓变和熵变:

 ,常温(298K)下,合成氨反应的自由能
,常温(298K)下,合成氨反应的自由能
_______  。
。
 转化为
转化为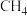 和水蒸气,配合
和水蒸气,配合 生成系统可实现
生成系统可实现 的再生。回答下列问题:
的再生。回答下列问题:Ⅰ.萨巴蒂尔反应为
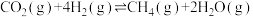

(1)已知25℃和101kPa时,
①
 的燃烧热
的燃烧热 ;
;②
 的燃烧热
的燃烧热 ;
;③

 。
。则萨巴蒂尔反应的
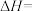
 。
。(2)萨巴蒂尔反应的前三步反应历程如图所示,其中吸附在催化剂
 表面的物质用“·”标注,Ts表示过渡态。从物质吸附在催化剂表面到形成过渡态的过程会
表面的物质用“·”标注,Ts表示过渡态。从物质吸附在催化剂表面到形成过渡态的过程会
Ⅱ.
 在一定条件下能与
在一定条件下能与 发生氧再生反应:
发生氧再生反应:

(3)恒压p0条件下,按
 投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度的关系如图所示。350℃时,该反应的平衡常数
投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度的关系如图所示。350℃时,该反应的平衡常数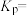
 的转化率,除升高温度外,还可采取的措施为
的转化率,除升高温度外,还可采取的措施为
(4)氧再生反应还可以通过酸性条件下半导体光催化转化实现,反应机理如图甲所示:

图甲
①光催化
 转化为
转化为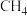 时,阴极的电极反应式为
时,阴极的电极反应式为②催化剂的催化效率和
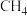 的生成速率随温度的变化关系如图乙所示。300~400℃之间,
的生成速率随温度的变化关系如图乙所示。300~400℃之间,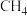 生成速率加快的原因是
生成速率加快的原因是
图乙
(5)氧再生反应所需的能量可由合成氨反应提供。合成氨反应的焓变和熵变:


 ,常温(298K)下,合成氨反应的自由能
,常温(298K)下,合成氨反应的自由能
 。
。
您最近一年使用:0次



