解题方法
1 . 甲醇( )作为重要的清洁燃料和合成化学的关键前驱体,在化工行业需求旺盛。以
)作为重要的清洁燃料和合成化学的关键前驱体,在化工行业需求旺盛。以 为催化剂在水溶液中电催化二氧化碳还原为
为催化剂在水溶液中电催化二氧化碳还原为 和
和 的能量变化如图所示:
的能量变化如图所示:
 )作为重要的清洁燃料和合成化学的关键前驱体,在化工行业需求旺盛。以
)作为重要的清洁燃料和合成化学的关键前驱体,在化工行业需求旺盛。以 为催化剂在水溶液中电催化二氧化碳还原为
为催化剂在水溶液中电催化二氧化碳还原为 和
和 的能量变化如图所示:
的能量变化如图所示: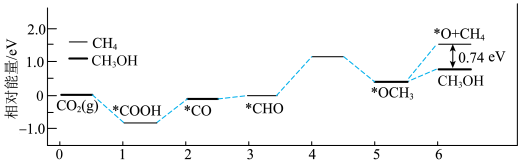
A.生成甲醇反应的决速步为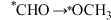 |
| B.两反应只涉及极性键的断裂和生成 |
| C.通过上图分析:甲烷比甲醇稳定 |
D.用 作催化剂可提高甲醇的选择性 作催化剂可提高甲醇的选择性 |
您最近半年使用:0次
解题方法
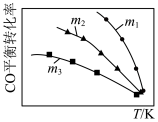
2 . 利用反应2NO(g)+2CO(g) 2CO2(g)+N2(g),可实现汽车尾气无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比
2CO2(g)+N2(g),可实现汽车尾气无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
 2CO2(g)+N2(g),可实现汽车尾气无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比
2CO2(g)+N2(g),可实现汽车尾气无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
| A.若m=2,反应达平衡时,NO的转化率为40%,则N2的体积分数为15.4% |
B.该反应的 |
C.投料比: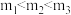 |
| D.汽车排气管中的催化剂可提高NO的平衡转化率 |
您最近半年使用:0次
解题方法
3 . 下列实验中,操作、现象及结论都正确,且有因果关系的是
选项 | 实验操作 | 现象 | 结论 |
A | 将 | 溶液pH变大 | 稀释后, |
B | 取两支试管,分别加入2mL5%的双氧水,试管1中加入 | 试管1产生气泡快 | 加入 |
C | 向含有ZnS和 | 生成黑色沉淀 |
|
D | 用pH试纸分别测定同浓度 | 测得NaClO溶液pH大 |
|
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
4 .  催化重整能够有效去除大气中的
催化重整能够有效去除大气中的 ,是实现“碳中和”的重要途径之一,发生的反应如下:
,是实现“碳中和”的重要途径之一,发生的反应如下:
重整反应:

积炭反应I: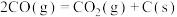

积炭反应II:

在恒压、起始投料比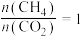 条件下,体系中含碳组分平衡时的物质的量随温度变化关系曲线如图所示。下列说法正确的是
条件下,体系中含碳组分平衡时的物质的量随温度变化关系曲线如图所示。下列说法正确的是

 催化重整能够有效去除大气中的
催化重整能够有效去除大气中的 ,是实现“碳中和”的重要途径之一,发生的反应如下:
,是实现“碳中和”的重要途径之一,发生的反应如下:重整反应:


积炭反应I:
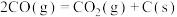

积炭反应II:


在恒压、起始投料比
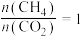 条件下,体系中含碳组分平衡时的物质的量随温度变化关系曲线如图所示。下列说法正确的是
条件下,体系中含碳组分平衡时的物质的量随温度变化关系曲线如图所示。下列说法正确的是
| A.升高温度积碳反应I,正反应速率减小,逆反应速率增大,平衡逆向移动 |
B.曲线B表示 平衡时物质的量随温度的变化 平衡时物质的量随温度的变化 |
C.积炭会导致催化剂失活,降低 的平衡转化率 的平衡转化率 |
D.低于600℃时,降低温度有利于减少积炭的量并去除 气体 气体 |
您最近半年使用:0次
名校
5 . 氢气是一种理想的绿色清洁能源,氢气的制取是氢能源利用领域的研究热点。
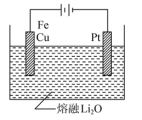
(1)用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O可制H2。
①氧缺位铁酸铜通过两步反应分解水制氢。已知第二步反应为2CuFe2O4=2CuFe2O4-x+xO2↑,则第一步反应的化学方程式为___________ 。
②CuFe2O4可用电化学方法得到,其原理如图所示,则阳极的电极反应式为___________ 。
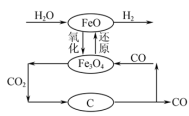
(2)可利用FeO/Fe3O4之间的相互转化,来裂解水制取氢气,其制氢流程如图所示。该工艺制氢的总反应为C(s)+H2O(g)=CO(g)+H2(g),对比水和碳在高温下直接接触反应制氢,分析该工艺制氢的最大优点是___________ 。
(3)硼氢化钠(NaBH4)的强碱溶液在催化剂作用下与水反应可获取氢气,其可能反应机理如图所示。已知:常温下,NaB(OH)4在水中的溶解度不大,易以NaBO2形式结晶析出。
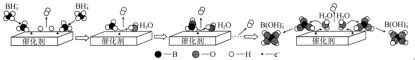
①若用D2O代替H2O,依据反应机理,则反应后生成的气体中含有___________ 。
②其他条件相同时,测得平均每克催化剂使用量下,NaBH4的浓度和放氢速率的变化关系如图所示。随着NaBH4浓度的增大,放氢速率先增大后减小,导致放氢速率下降的原因可能是___________ 。

(1)用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O可制H2。
①氧缺位铁酸铜通过两步反应分解水制氢。已知第二步反应为2CuFe2O4=2CuFe2O4-x+xO2↑,则第一步反应的化学方程式为
②CuFe2O4可用电化学方法得到,其原理如图所示,则阳极的电极反应式为

(2)可利用FeO/Fe3O4之间的相互转化,来裂解水制取氢气,其制氢流程如图所示。该工艺制氢的总反应为C(s)+H2O(g)=CO(g)+H2(g),对比水和碳在高温下直接接触反应制氢,分析该工艺制氢的最大优点是

(3)硼氢化钠(NaBH4)的强碱溶液在催化剂作用下与水反应可获取氢气,其可能反应机理如图所示。已知:常温下,NaB(OH)4在水中的溶解度不大,易以NaBO2形式结晶析出。

①若用D2O代替H2O,依据反应机理,则反应后生成的气体中含有
②其他条件相同时,测得平均每克催化剂使用量下,NaBH4的浓度和放氢速率的变化关系如图所示。随着NaBH4浓度的增大,放氢速率先增大后减小,导致放氢速率下降的原因可能是

您最近半年使用:0次
6 . 二氧化碳合成二甲醚的主要反应有:
Ⅰ.
Ⅱ.
Ⅲ.
一定温度下,将 、
、 和双催化剂(通常由甲醇合成催化剂和甲醇脱水制醚催化剂组成),加入1L密闭容器中充分接触反应,测得各产物占所有含碳物质的物质的量分数(例:CO的物质的量分数
和双催化剂(通常由甲醇合成催化剂和甲醇脱水制醚催化剂组成),加入1L密闭容器中充分接触反应,测得各产物占所有含碳物质的物质的量分数(例:CO的物质的量分数 )随时间变化如图所示
)随时间变化如图所示
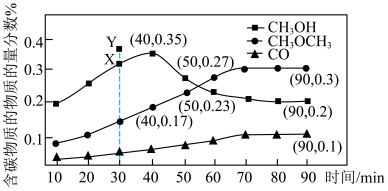
下列说法正确的是
Ⅰ.

Ⅱ.

Ⅲ.

一定温度下,将
 、
、 和双催化剂(通常由甲醇合成催化剂和甲醇脱水制醚催化剂组成),加入1L密闭容器中充分接触反应,测得各产物占所有含碳物质的物质的量分数(例:CO的物质的量分数
和双催化剂(通常由甲醇合成催化剂和甲醇脱水制醚催化剂组成),加入1L密闭容器中充分接触反应,测得各产物占所有含碳物质的物质的量分数(例:CO的物质的量分数 )随时间变化如图所示
)随时间变化如图所示
下列说法正确的是
A.40min前, |
| B.30min时,使用活性更高的甲醇合成催化剂,有可能使图中的X点升至Y点 |
C.40min后, 物质的量分数减小,原因可能是反应Ⅰ向逆反应方向移动 物质的量分数减小,原因可能是反应Ⅰ向逆反应方向移动 |
D.90min时, 的转化率为60% 的转化率为60% |
您最近半年使用:0次
解题方法
7 . 实验小组探究Cu和 溶液的反应原理。
溶液的反应原理。
(1)配制溶液
用 标准试剂配制
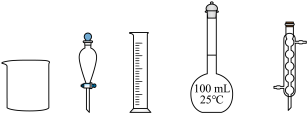
标准试剂配制 溶液,下列仪器中无需使用的有
溶液,下列仪器中无需使用的有_______ (填名称)。
(2)测定 溶液的pH
溶液的pH
用_______ (填仪器名称)测得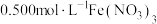 溶液的pH为1.10。
溶液的pH为1.10。
(3)提出假设
假设ⅰ:_______ ,反应的离子方程式为:
假设ⅱ: 将Cu氧化,反应的离子方程式为:
将Cu氧化,反应的离子方程式为:
(4)实验探究
实验Ⅰ:向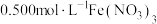 溶液中加入过量铜粉并充分振荡,溶液变成深棕色,无气泡产生。实验小组取少量上层清液于另一洁净试管中,往其中滴加
溶液中加入过量铜粉并充分振荡,溶液变成深棕色,无气泡产生。实验小组取少量上层清液于另一洁净试管中,往其中滴加_______ (填化学式)溶液,观察到_______ 的实验现象,证明了反应中有 生成。
生成。
实验Ⅱ:向pH=1.10的_______ (填化学式)溶液中加入过量铜粉并充分振荡,无明显现象。
探究结论:综合“实验Ⅰ”和“实验Ⅱ”可知,假设_______ (填“ⅰ”或“ⅱ”)成立。
(5)查阅资料知,铜粉与 溶液可能涉及的反应有;
溶液可能涉及的反应有;
反应①: ;
;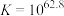 ;速率很慢。
;速率很慢。
反应②: ;
;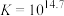 ,速率较快。
,速率较快。
反应③: ;
;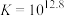 ;速率很快。
;速率很快。
反应④: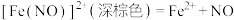
(a)对反应①来说, 起到的作用为
起到的作用为_______ ;为验证这一作用,设计的实验方案为_______ 。
(b)“实验Ⅰ”反应中无论Cu过量多少,始终都能检测到 的存在,原因是
的存在,原因是_______ 。
 溶液的反应原理。
溶液的反应原理。(1)配制溶液
用
 标准试剂配制
标准试剂配制 溶液,下列仪器中无需使用的有
溶液,下列仪器中无需使用的有
(2)测定
 溶液的pH
溶液的pH用
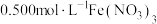 溶液的pH为1.10。
溶液的pH为1.10。(3)提出假设
假设ⅰ:

假设ⅱ:
 将Cu氧化,反应的离子方程式为:
将Cu氧化,反应的离子方程式为:
(4)实验探究
实验Ⅰ:向
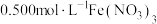 溶液中加入过量铜粉并充分振荡,溶液变成深棕色,无气泡产生。实验小组取少量上层清液于另一洁净试管中,往其中滴加
溶液中加入过量铜粉并充分振荡,溶液变成深棕色,无气泡产生。实验小组取少量上层清液于另一洁净试管中,往其中滴加 生成。
生成。实验Ⅱ:向pH=1.10的
探究结论:综合“实验Ⅰ”和“实验Ⅱ”可知,假设
(5)查阅资料知,铜粉与
 溶液可能涉及的反应有;
溶液可能涉及的反应有;反应①:
 ;
;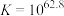 ;速率很慢。
;速率很慢。反应②:
 ;
;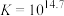 ,速率较快。
,速率较快。反应③:
 ;
;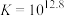 ;速率很快。
;速率很快。反应④:
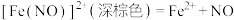
(a)对反应①来说,
 起到的作用为
起到的作用为(b)“实验Ⅰ”反应中无论Cu过量多少,始终都能检测到
 的存在,原因是
的存在,原因是
您最近半年使用:0次
8 . 2021年中国政府工作报告中提出碳中和目标:在2030年前达到最高值,2060年前达到碳中和。因此对二氧化碳的综合利用显得尤为重要。
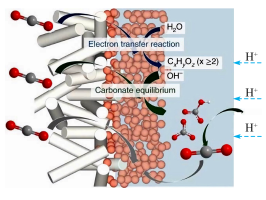

(1)通过电解的方式可实现对二氧化碳的综合利用。2022年7月香港中文大学王莹教授研发新型电解槽实现二氧化碳回收转化效率达到60%以上。转化示意图如图所示,请写出其电极反应方程式:_____ 。
(2)在席夫碱(含“—RC=N—”有机物)修饰的纳米金催化剂上,CO2直接催化加氢成甲酸。其反应历程如图所示,其中吸附在催化剂表面上的物质用*标注。该历程中起决速步骤的化学方程式是_____ 。
(3)通过使用不同新型催化剂,实现二氧化碳加氢合成转化为二甲醚(CH3OCH3)也有广泛的应用。
反应1:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.01KJ/mol
CH3OH(g)+H2O(g) △H=-49.01KJ/mol
反应2:2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-24.52KJ/mol
CH3OCH3(g)+H2O(g) △H=-24.52KJ/mol
反应3:CO2(g)+H2(g) CO(g)+H2O(g) △H=+41.17KJ/mol
CO(g)+H2O(g) △H=+41.17KJ/mol
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H=
CH3OCH3(g)+3H2O(g) △H=_____ KJ/mol
起始压强为4.0MPa、恒压条件下,通入氢气和二氧化碳的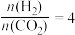 的情况下,不同温度下CO2的平衡转化率和产物的选择性(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)如图所示:
的情况下,不同温度下CO2的平衡转化率和产物的选择性(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)如图所示:
当温度超过290℃,CO2的平衡转化率随温度升高而增大的原因是_____ 。在图中,在200℃时,若经过0.2s该平衡体系即达到平衡。计算CO2分压的平均变化速率为_____ MPa/s;此时对于反应1的Kp=_____ (MPa)-2(计算的表达式)。



(1)通过电解的方式可实现对二氧化碳的综合利用。2022年7月香港中文大学王莹教授研发新型电解槽实现二氧化碳回收转化效率达到60%以上。转化示意图如图所示,请写出其电极反应方程式:
(2)在席夫碱(含“—RC=N—”有机物)修饰的纳米金催化剂上,CO2直接催化加氢成甲酸。其反应历程如图所示,其中吸附在催化剂表面上的物质用*标注。该历程中起决速步骤的化学方程式是
(3)通过使用不同新型催化剂,实现二氧化碳加氢合成转化为二甲醚(CH3OCH3)也有广泛的应用。
反应1:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-49.01KJ/mol
CH3OH(g)+H2O(g) △H=-49.01KJ/mol反应2:2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H=-24.52KJ/mol
CH3OCH3(g)+H2O(g) △H=-24.52KJ/mol反应3:CO2(g)+H2(g)
 CO(g)+H2O(g) △H=+41.17KJ/mol
CO(g)+H2O(g) △H=+41.17KJ/mol2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) △H=
CH3OCH3(g)+3H2O(g) △H=起始压强为4.0MPa、恒压条件下,通入氢气和二氧化碳的
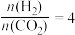 的情况下,不同温度下CO2的平衡转化率和产物的选择性(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)如图所示:
的情况下,不同温度下CO2的平衡转化率和产物的选择性(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)如图所示:当温度超过290℃,CO2的平衡转化率随温度升高而增大的原因是

您最近半年使用:0次
名校
9 . 可逆反应aA(g)+bB(s)⇌cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是
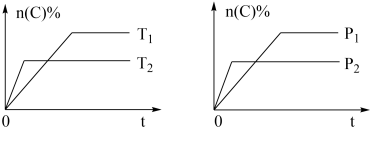

| A.升高温度,平衡向逆反应方向移动 |
| B.使用催化剂,C的物质的量分数增加 |
| C.化学方程式系数a>c+d |
| D.达到平衡后,P1条件V逆反应速率大于P2条件下V正反应速率 |
您最近半年使用:0次
名校
解题方法
10 . 用硫酸酸化的草酸(H2C2O4,二元弱酸)溶液能将KMnO4溶液中的MnO 转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,请完成以下实验设计表。
表中a、b的值分别为:a=___________ 、b=___________
(2)该反应的离子方程式为___________ 。
(3)若t1<t2,则根据实验①和②得到的结论是___________ 。
(4)某小组同学按实验①进行实验,测得溶液褪色时间t1=2.5min,求该条件下的化学反应速率v(H2C2O4)=___________ ,其反应速率变化如图,其中x1~x2时间内速率变快的主要原因可能是:产物Mn2+是反应的催化剂、___________ 。

(5)请你设计实验④验证MnSO4对该反应起催化作用,完成下表中内容。
 转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,请完成以下实验设计表。
| 实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液/mL | 0.01mol/LKMnO4溶的体积/mL | 蒸馏水体积/mL | 待测数据(反应混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | a | b | t3 |
(2)该反应的离子方程式为
(3)若t1<t2,则根据实验①和②得到的结论是
(4)某小组同学按实验①进行实验,测得溶液褪色时间t1=2.5min,求该条件下的化学反应速率v(H2C2O4)=

(5)请你设计实验④验证MnSO4对该反应起催化作用,完成下表中内容。
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
| 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
您最近半年使用:0次

 溶液由
溶液由 稀释到
稀释到 ,测溶液pH
,测溶液pH 的水解程度增大
的水解程度增大 溶液2滴,试管2中加入
溶液2滴,试管2中加入
 时,双氧水分解反应的活化能较小
时,双氧水分解反应的活化能较小 的悬浊液中滴加
的悬浊液中滴加 溶液
溶液
 和NaClO溶液的pH
和NaClO溶液的pH 水解程度大于
水解程度大于


