2023高三·全国·专题练习
1 . 绿色能源是未来能源发展的方向,积极发展氢能,是实现“碳达峰、碳中和”的重要举措。回答下列问题:
(1)通过生物柴油副产物甘油制取H2正成为绿色能源的一个重要研究方向。生物甘油水蒸气重整制氢的主要反应如下(K1、K2分别为反应I、Ⅱ的化学平衡常数):
I.C3H8O3(g)⇌3CO(g)+4H2(g) ΔH1=+251kJ·mol-1 K1
Ⅱ.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2=-41kJ·mol-1 K2
重整总反应C3H8O3(g)+3H2O(g)⇌3CO2(g)+7H2(g)的ΔH3=_________ ,平衡常数K3=_________ 。(用含K1、K2的计算式表示)
(2)大量研究表明Pt12Ni、Sn12Ni、Cu12Ni三种双金属合金团簇均可用于催化DRM反应(CH4+CO2⇌2CO+2H2),在催化剂表面涉及多个基元反应,其中甲烷逐步脱氢过程的能量变化如图甲所示(吸附在催化剂表面上的物种用*标注,TS1、TS2、TS3、TS4分别表示过渡态1、过渡态2、过渡态3、过渡态4)。
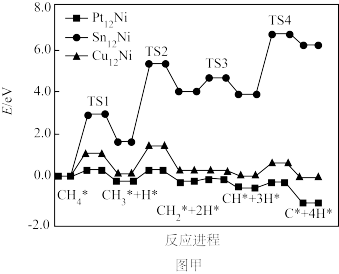
①Pt12Ni、Sn12Ni、Cu12Ni催化甲烷逐步脱氢过程的速率分别为v1、v2、v3,则脱氢过程的速率由小到大的关系为___________ 。
②甲烷逐步脱氢过程中,决定速率快慢的反应步骤是:___________ (用化学方程式表示)。
(3)甲烷干法重整制H2的过程为反应a:CH4+CO2⇌2CO+2H2,同时发生副反应b:CO2+H2⇌CO+H2O,T℃时,在恒压容器中,通入2molCH4和2molCO2发生上述反应,总压强为P0,平衡时甲烷的转化率为40%,H2O的分压为P,则反应a的压强平衡常数Kp=___________ (用含P和P0的计算式表示,已知分压=总压×物质的量分数)。
(4)甲烷裂解制氢的反应为CH4(g)=C(s)+2H2(g) ΔH=+75kJ·mol-1,Ni可作该反应的催化剂,CH4在催化剂孔道表面反应时,若孔道堵塞会导致催化剂失活。其他条件相同时,随时间增加,温度对Ni催化剂催化效果的影响如图乙所示。考虑综合因素,使用催化剂的最佳温度为___________ ;650℃条件下,1000s后,氢气的体积分数快速下降的原因是___________ 。

(1)通过生物柴油副产物甘油制取H2正成为绿色能源的一个重要研究方向。生物甘油水蒸气重整制氢的主要反应如下(K1、K2分别为反应I、Ⅱ的化学平衡常数):
I.C3H8O3(g)⇌3CO(g)+4H2(g) ΔH1=+251kJ·mol-1 K1
Ⅱ.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2=-41kJ·mol-1 K2
重整总反应C3H8O3(g)+3H2O(g)⇌3CO2(g)+7H2(g)的ΔH3=
(2)大量研究表明Pt12Ni、Sn12Ni、Cu12Ni三种双金属合金团簇均可用于催化DRM反应(CH4+CO2⇌2CO+2H2),在催化剂表面涉及多个基元反应,其中甲烷逐步脱氢过程的能量变化如图甲所示(吸附在催化剂表面上的物种用*标注,TS1、TS2、TS3、TS4分别表示过渡态1、过渡态2、过渡态3、过渡态4)。

①Pt12Ni、Sn12Ni、Cu12Ni催化甲烷逐步脱氢过程的速率分别为v1、v2、v3,则脱氢过程的速率由小到大的关系为
②甲烷逐步脱氢过程中,决定速率快慢的反应步骤是:
(3)甲烷干法重整制H2的过程为反应a:CH4+CO2⇌2CO+2H2,同时发生副反应b:CO2+H2⇌CO+H2O,T℃时,在恒压容器中,通入2molCH4和2molCO2发生上述反应,总压强为P0,平衡时甲烷的转化率为40%,H2O的分压为P,则反应a的压强平衡常数Kp=
(4)甲烷裂解制氢的反应为CH4(g)=C(s)+2H2(g) ΔH=+75kJ·mol-1,Ni可作该反应的催化剂,CH4在催化剂孔道表面反应时,若孔道堵塞会导致催化剂失活。其他条件相同时,随时间增加,温度对Ni催化剂催化效果的影响如图乙所示。考虑综合因素,使用催化剂的最佳温度为

您最近一年使用:0次
2023高三·全国·专题练习
2 . 甲苯(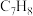 )和二甲苯(
)和二甲苯(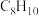 )是重要的化工原料。利用苯(
)是重要的化工原料。利用苯(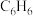 )和甲醇(
)和甲醇( )在催化剂作用下反应得到
)在催化剂作用下反应得到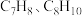 和副产物三甲苯(
和副产物三甲苯(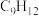 ),发生的主要反应如下:
),发生的主要反应如下:
Ⅰ.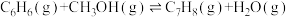
Ⅱ.
Ⅲ.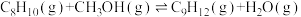
(1)500℃、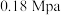 条件下,反应达到平衡时,结果如图所示。
条件下,反应达到平衡时,结果如图所示。

①由图分析,随着投料比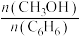 增加,
增加, 的平衡转化率
的平衡转化率___________ 。平衡时 的值
的值___________ (填“增大”、“减小”或“不变”)。
②投料比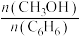 为1.0时,
为1.0时,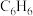 的平衡转化率为50%,产物中
的平衡转化率为50%,产物中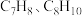 和
和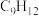 物质的量之比为6:3:1,
物质的量之比为6:3:1, 的平衡转化率为
的平衡转化率为___________ ,反应Ⅰ的平衡常数
___________ 。
(2)我国学者结合实验与计算机模拟结果,研究了反应Ⅰ在固体酸(HB)催化剂表面进行的反应历程如图所示,其中吸附在固体酸(HB)表面的物种用*标注。

①反应Ⅰ的
______ 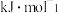 。
。
②吸附 的焓变
的焓变______ 吸附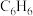 的焓变(填“>”或“<”)。
的焓变(填“>”或“<”)。
③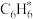 在催化剂表面转化为
在催化剂表面转化为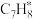 的反应方程式为
的反应方程式为______ 。
④在固体酸(HB)催化作用下,测得反应Ⅰ的速率方程为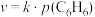 (
(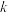 为速率常数)。在刚性容器中发生反应Ⅰ,关于反应Ⅰ的平衡常数(K)和反应速率(υ)的叙述正确的是
为速率常数)。在刚性容器中发生反应Ⅰ,关于反应Ⅰ的平衡常数(K)和反应速率(υ)的叙述正确的是______ (填标号)。
A.升高温度,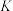 和
和 均增大 B.增大
均增大 B.增大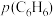 ,
,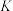 不变,
不变, 增大
增大
C.降低温度,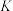 和
和 均增大 D.增大
均增大 D.增大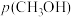 ,
,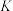 不变,
不变, 增大
增大
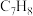 )和二甲苯(
)和二甲苯(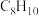 )是重要的化工原料。利用苯(
)是重要的化工原料。利用苯(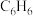 )和甲醇(
)和甲醇( )在催化剂作用下反应得到
)在催化剂作用下反应得到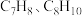 和副产物三甲苯(
和副产物三甲苯(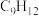 ),发生的主要反应如下:
),发生的主要反应如下:Ⅰ.
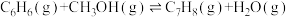
Ⅱ.

Ⅲ.
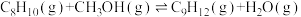
(1)500℃、
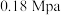 条件下,反应达到平衡时,结果如图所示。
条件下,反应达到平衡时,结果如图所示。
①由图分析,随着投料比
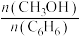 增加,
增加, 的平衡转化率
的平衡转化率 的值
的值②投料比
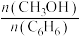 为1.0时,
为1.0时,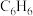 的平衡转化率为50%,产物中
的平衡转化率为50%,产物中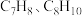 和
和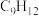 物质的量之比为6:3:1,
物质的量之比为6:3:1, 的平衡转化率为
的平衡转化率为
(2)我国学者结合实验与计算机模拟结果,研究了反应Ⅰ在固体酸(HB)催化剂表面进行的反应历程如图所示,其中吸附在固体酸(HB)表面的物种用*标注。

①反应Ⅰ的

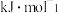 。
。②吸附
 的焓变
的焓变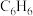 的焓变(填“>”或“<”)。
的焓变(填“>”或“<”)。③
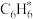 在催化剂表面转化为
在催化剂表面转化为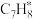 的反应方程式为
的反应方程式为④在固体酸(HB)催化作用下,测得反应Ⅰ的速率方程为
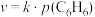 (
(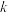 为速率常数)。在刚性容器中发生反应Ⅰ,关于反应Ⅰ的平衡常数(K)和反应速率(υ)的叙述正确的是
为速率常数)。在刚性容器中发生反应Ⅰ,关于反应Ⅰ的平衡常数(K)和反应速率(υ)的叙述正确的是A.升高温度,
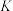 和
和 均增大 B.增大
均增大 B.增大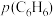 ,
,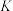 不变,
不变, 增大
增大C.降低温度,
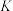 和
和 均增大 D.增大
均增大 D.增大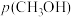 ,
,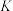 不变,
不变, 增大
增大
您最近一年使用:0次
2022高三·全国·专题练习
名校
解题方法
3 . 恒温恒容的密闭容器中,某催化剂表面发生氨的分解反应: ,测得不同起始浓度和催化剂表面积下氨的浓度随时间的变化
,测得不同起始浓度和催化剂表面积下氨的浓度随时间的变化
下列说法不正确的是
 ,测得不同起始浓度和催化剂表面积下氨的浓度随时间的变化
,测得不同起始浓度和催化剂表面积下氨的浓度随时间的变化| 编号 | 时间/min 表面积/cm  | 0 | 20 | 40 | 60 | 80 |
| ① | a | 2.40 | 2.00 | 1.60 | 1.20 | 0.80 |
| ② | a | 1.20 | 0.80 | 0.40 | x | |
| ③ | 2a | 2.40 | 1.60 | 0.80 | 0.40 | 0.40 |
A.实验①,0∼40min,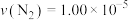 mol⋅L mol⋅L ∙min ∙min |
| B.相同条件下,增加氨气的浓度,反应速率增大 |
| C.相同条件下,增加催化剂的表面积,反应速率增大 |
D.实验②,60min时处于平衡状态, |
您最近一年使用:0次
2023-11-23更新
|
78次组卷
|
31卷引用:专题09 化学反应速率与化学平衡(讲)-2023年高考化学二轮复习讲练测(新高考专用)
(已下线)专题09 化学反应速率与化学平衡(讲)-2023年高考化学二轮复习讲练测(新高考专用)安徽省六安第一中学2022-2023学年高二上学期期末考试化学试题(已下线)第13练 化学反应速率与化学平衡的综合考查 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点21 化学反应速率(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题11 化学反应速率与化学平衡-2023年高考化学真题题源解密(全国通用)第二章 章末训练(已下线)考点2 化学平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)河南省周口恒大中学2023-2024学年高二上学期11月期中考试化学试题吉林省长春市第二实验中学2023-2024学年高二上学期10月月考化学试题上海市建平世纪中学2023-2024学年高二上学期阶段练习二 化学(等级)试题(已下线)考点21 化学反应速率-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第16练 化学反应的速率与限度-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第20讲 化学反应速率(练)-2023年高考化学一轮复习讲练测(全国通用)辽宁省朝阳市建平县实验中学2022-2023学年高二上学期第一次月考化学试题(已下线)第19讲 化学平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点21 化学反应速率-备战2023年高考化学考试易错题(已下线)易错点22 化学反应平衡和移动-备战2023年高考化学考试易错题天津市五校(杨村宝坻蓟州芦台静海一中)2022-2023学年高二上学期期中考试化学试题安徽省合肥一六八中学2022-2023学年高二上学期化学学科学情调研试题辽宁省营口市2022-2023学年高三上学期期末考试化学试题上海市奉贤区2022-2023学年高三上学期一模练习卷化学试题北京师范大学附属中学2022-2023学年高二上学期10月月考化学试题(已下线)题型10 反应微观机理分析 速率方程及其应用-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)黑龙江省双鸭山市第一中学2021-2022学年高一下学期期末考试化学试题黑龙江省鹤岗市第一中学2021-2022学年高一下学期期末考试化学试题浙江省浙里卷天下2022-2023学年高三8月开学测试化学试题江西省新余市第一中学2022-2023学年高二上学期开学考试化学试题黑龙江省佳木斯市第一中学2022-2023学年高三上学期第三次调研化学试题(已下线)2023年1月浙江省普通高校招生选考科目考试化学仿真模拟试卷A(已下线)化学预测卷(五)-预测卷(浙江专版)安徽省淮北市树人高级中学2023-2024学年高二下学期开学考试化学试题
名校
解题方法
4 . N2O是《联合国气候变化框架公约》所列六种温室气体之一。CO和N2O在Fe+作用下转化为N2和CO2,反应的能量变化及反应历程如图所示,两步基元反应为:① N2O+Fe +=N2+FeO+ K1,②CO+FeO+=CO2+Fe+ K2。下列说法不正确的是
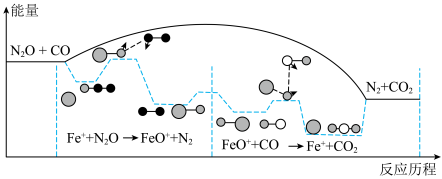

| A.该反应ΔH<0 |
| B.两步反应中,决定总反应速率的是反应① |
| C.升高温度,可提高 N2O 的平衡转化率 |
| D.Fe+增大了活化分子百分数,加快了化学反应速率,但不改变反应的ΔH |
您最近一年使用:0次
2023-07-24更新
|
820次组卷
|
5卷引用:河南省宜阳县第一高级中学2023-2024学年高二上学期9月开学考试化学试题
河南省宜阳县第一高级中学2023-2024学年高二上学期9月开学考试化学试题(已下线)考点1 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)浙江省绍兴区上虞区2022-2023学年高三下学期第二次适应性考试(二模)化学试题浙江省绍兴区上虞区2022-2023学年高三下学期第二次适应性考试(二模)化学试题(已下线)选择题11-14
2023·湖南·高考真题
5 .  是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某
是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某 (Ⅱ)催化剂(用
(Ⅱ)催化剂(用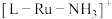 表示)能高效电催化氧化
表示)能高效电催化氧化 合成
合成 ,其反应机理如图所示。
,其反应机理如图所示。
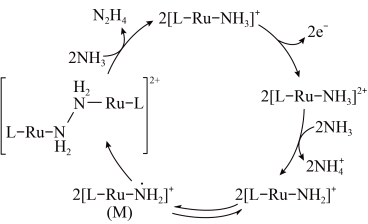
下列说法错误的是
 是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某
是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某 (Ⅱ)催化剂(用
(Ⅱ)催化剂(用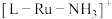 表示)能高效电催化氧化
表示)能高效电催化氧化 合成
合成 ,其反应机理如图所示。
,其反应机理如图所示。
下列说法错误的是
A. (Ⅱ)被氧化至 (Ⅱ)被氧化至 (Ⅲ)后,配体 (Ⅲ)后,配体 失去质子能力增强 失去质子能力增强 |
B.M中 的化合价为 的化合价为 |
| C.该过程有非极性键的形成 |
D.该过程的总反应式: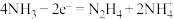 |
您最近一年使用:0次
2023-06-16更新
|
9366次组卷
|
17卷引用:专题10 物质的反应及转化
(已下线)专题10 物质的反应及转化(已下线)专题10 物质的反应及转化(已下线)专题10 物质的反应及转化(已下线)第3讲 氧化还原反应河北省石家庄市正定中学2022- 2023学年高二下学期期末考试化学试题(已下线)专题09 化学反应中的热效应与反应机理-2023年高考化学真题题源解密(全国通用)吉林省长春外国语学校2023-2024学年高三上学期开学考试化学试题(已下线)考点1 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)湖北省华中师范大学第一附属中学2023-2024学年高二上学期10月月考化学试题陕西省西安中学2023-2024学年高三(实验版)上学期12月练考理科综合试题2023年高考湖南卷化学真题(已下线)2023年湖南卷高考真题变式题(选择题11-14)浙江省名校协作体2023-2024学年高三上学期开学适应性考试化学试题(已下线)题型10 反应微观机理分析 速率方程及其应用-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)专题02 化学反应速率-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)江西省宜春市丰城市第九中学2023-2024学年高一上学期1月期末化学试题(已下线)专题05 化学反应与能量(2大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)
名校
6 . 在铜催化下,以末端炔烃为原料合成有机金属试剂的反应历程如下:
与四个互不相同原子或基团连接的碳原子叫手性碳原子,含手性碳原子的分子叫手性分子。下列叙述正确的是

与四个互不相同原子或基团连接的碳原子叫手性碳原子,含手性碳原子的分子叫手性分子。下列叙述正确的是
| A.合成“X”总反应的原子利用率小于100% |
| B.(L)Cu-Bpin是合成中间产物“X”的催化剂 |
| C.上述转化中断裂和形成了极性键和非极性键 |
| D.若R、Bpin都不含手性碳,则“Y”是手性分子 |
您最近一年使用:0次
2023-06-04更新
|
441次组卷
|
3卷引用:河南省TOP二十名校2023届高三下学期四月冲刺考试(二)理科综合化学试题
名校
解题方法
7 . 亚硝酰硫酸(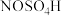 )在重氮化反应中可以代替亚硝酸钠。实验室用如图所示装置(部分夹持仪器略)制备少量亚硝酰硫酸,并测定产品纯度。
)在重氮化反应中可以代替亚硝酸钠。实验室用如图所示装置(部分夹持仪器略)制备少量亚硝酰硫酸,并测定产品纯度。
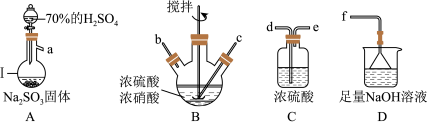
已知:i.亚硝酰硫酸遇水分解为硫酸、硝酸和NO,溶于浓硫酸而不分解;
 .实验室制备亚硝酰硫酸的原理为
.实验室制备亚硝酰硫酸的原理为 ,
,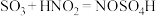 。
。
(1)仪器Ⅰ的名称为___________ ,按照气流从左到右的顺序,上述仪器的连接顺序为___________ (填仪器接口的字母,字母之间用“→”连接,部分仪器可以重复使用),C装置的作用为___________ 。
(2)反应需控制温度在25~40℃,采用的加热措施为___________ ,开始时反应缓慢,但某时刻反应速率明显加快,其原因可能是___________ 。
(3)测定亚硝酰硫酸的纯度:
步骤①:准确称取 产品,在特定条件下配制成
产品,在特定条件下配制成 溶液。
溶液。
步骤②:取 溶液于锥形瓶中,加入
溶液于锥形瓶中,加入 未知浓度
未知浓度 溶液(过量)和
溶液(过量)和 的
的 溶液,摇匀,发生反应
溶液,摇匀,发生反应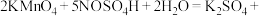
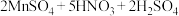
步骤③:向该溶液中滴加 标准溶液进行滴定,消耗
标准溶液进行滴定,消耗 溶液的体积为
溶液的体积为 。
。
步骤④:把亚硝酰硫酸溶液换为蒸馏水(空白实验),重复上述步骤,消耗 溶液的体积为
溶液的体积为 。
。
滴定终点时的现象为___________ ,亚硝酰硫酸的纯度为___________ (精确到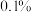 )。
)。
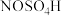 )在重氮化反应中可以代替亚硝酸钠。实验室用如图所示装置(部分夹持仪器略)制备少量亚硝酰硫酸,并测定产品纯度。
)在重氮化反应中可以代替亚硝酸钠。实验室用如图所示装置(部分夹持仪器略)制备少量亚硝酰硫酸,并测定产品纯度。
已知:i.亚硝酰硫酸遇水分解为硫酸、硝酸和NO,溶于浓硫酸而不分解;
 .实验室制备亚硝酰硫酸的原理为
.实验室制备亚硝酰硫酸的原理为 ,
,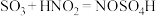 。
。(1)仪器Ⅰ的名称为
(2)反应需控制温度在25~40℃,采用的加热措施为
(3)测定亚硝酰硫酸的纯度:
步骤①:准确称取
 产品,在特定条件下配制成
产品,在特定条件下配制成 溶液。
溶液。步骤②:取
 溶液于锥形瓶中,加入
溶液于锥形瓶中,加入 未知浓度
未知浓度 溶液(过量)和
溶液(过量)和 的
的 溶液,摇匀,发生反应
溶液,摇匀,发生反应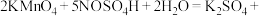
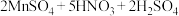
步骤③:向该溶液中滴加
 标准溶液进行滴定,消耗
标准溶液进行滴定,消耗 溶液的体积为
溶液的体积为 。
。步骤④:把亚硝酰硫酸溶液换为蒸馏水(空白实验),重复上述步骤,消耗
 溶液的体积为
溶液的体积为 。
。滴定终点时的现象为
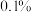 )。
)。
您最近一年使用:0次
2023-05-19更新
|
454次组卷
|
6卷引用:山西省忻州市2023届高三下学期二轮复习联考(三)理综化学试题
山西省忻州市2023届高三下学期二轮复习联考(三)理综化学试题河南省开封市2022-2023学年高三下学期5月月考理综化学试题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)实验探究题山东省聊城市百师联盟2023届高三下学期(二轮复习联考)模拟预测(三)化学试题江西省丰城中学、新建二中2022-2023学年高二下学期期末联考化学试题
2023·山东淄博·二模
解题方法
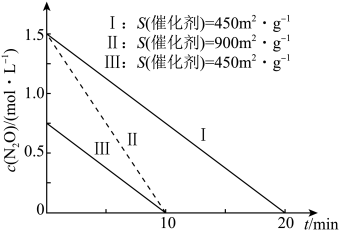
8 . 某温度下,在金表面发生反应: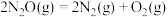 ,其速率方程式为
,其速率方程式为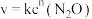 (k为速率常数)。反应过程中,
(k为速率常数)。反应过程中,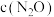 与S(催化剂)及时间关系如图所示。已知
与S(催化剂)及时间关系如图所示。已知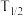 (半衰期)为反应物消耗一半所用的时间,下列叙述错误的是
(半衰期)为反应物消耗一半所用的时间,下列叙述错误的是
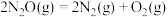 ,其速率方程式为
,其速率方程式为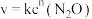 (k为速率常数)。反应过程中,
(k为速率常数)。反应过程中,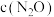 与S(催化剂)及时间关系如图所示。已知
与S(催化剂)及时间关系如图所示。已知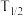 (半衰期)为反应物消耗一半所用的时间,下列叙述错误的是
(半衰期)为反应物消耗一半所用的时间,下列叙述错误的是
A. ,Ⅰ条件下 ,Ⅰ条件下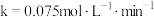 |
| B.其他条件相同,S(催化剂)越大,k越大 |
C.其他条件相同,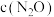 增大,反应速率不变 增大,反应速率不变 |
D.该温度下,当S(催化剂) , ,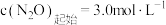 时, 时,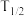 为 为 |
您最近一年使用:0次
2023·安徽马鞍山·二模
解题方法
9 . 我国力争2030年前实现碳达峰,2060 年前实现碳中和。CO2 的综合利用是实现碳中和的措施之一。
Ⅰ. CO2和CH4在催化剂表面可以合成CH3COOH,该反应的历程和相对能量的变化情况如下图所示(*指微粒吸附在催化剂表面,H*指H吸附在催化剂载体上的氧原子上,TS表示过渡态):
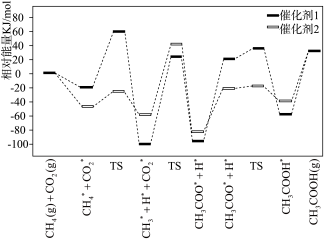
(1)决定该过程的总反应速率的基元反应方程式为___________ 。
(2)下列说法正确的有___________ 。
a.增大催化剂表面积可提高CO2在催化剂表面的吸附速率
b. CH3COOH* 比CH3COOH(g)能量高
c.催化效果更好的是催化剂2
d.使用高活性催化剂可降低反应焓变,加快反应速率
Ⅱ. CO2和 H2在一定条件下也可以合成甲醇,该过程存在副反应ii。
反应i: CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH1 = -49.3 kJ·mol-1
CH3OH(g) + H2O(g) ΔH1 = -49.3 kJ·mol-1
反应ii: CO2(g) + H2(g CO(g)+ H2O(g) ΔH2
CO(g)+ H2O(g) ΔH2
(3)有关物质能量变化如图所示,稳定单质的焓(H)为0,则ΔH2=___________ kJ·mol-1

(4)恒温恒容条件下,仅发生反应ii,反应达到平衡的标志是___________ 。
a. CO的分压不再发生变化
b.气体平均相对分子质量不再发生变化
c. 气体密度不再发生变化
d.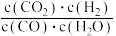 比值不再发生变化
比值不再发生变化
(5)在5.0MPa,将n(CO2) : n(H2)=5 : 16的混合气体在催化剂作用下进行反应。体系中气体平衡组成比例(CO和CH3OH在含碳产物中物质的量百分数)及CO2的转化率随温度的变化如图所示。
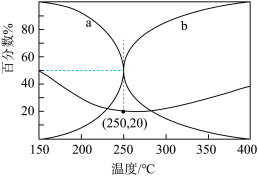
①表示平衡时CH3OH在含碳产物中物质的量百分数的曲线是___________ (填“a”或“b”)。
②CO2平衡转化率随温度的升高先减小后增大,增大的原因可能是___________ 。
③250℃时反应i: CO2(g)+3H2(g) CH3OH(g)+H2O(g)的 Kp=
CH3OH(g)+H2O(g)的 Kp=___________ (MPa)-2(用最简分数表示)。
Ⅰ. CO2和CH4在催化剂表面可以合成CH3COOH,该反应的历程和相对能量的变化情况如下图所示(*指微粒吸附在催化剂表面,H*指H吸附在催化剂载体上的氧原子上,TS表示过渡态):

(1)决定该过程的总反应速率的基元反应方程式为
(2)下列说法正确的有
a.增大催化剂表面积可提高CO2在催化剂表面的吸附速率
b. CH3COOH* 比CH3COOH(g)能量高
c.催化效果更好的是催化剂2
d.使用高活性催化剂可降低反应焓变,加快反应速率
Ⅱ. CO2和 H2在一定条件下也可以合成甲醇,该过程存在副反应ii。
反应i: CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) ΔH1 = -49.3 kJ·mol-1
CH3OH(g) + H2O(g) ΔH1 = -49.3 kJ·mol-1反应ii: CO2(g) + H2(g
 CO(g)+ H2O(g) ΔH2
CO(g)+ H2O(g) ΔH2(3)有关物质能量变化如图所示,稳定单质的焓(H)为0,则ΔH2=

(4)恒温恒容条件下,仅发生反应ii,反应达到平衡的标志是
a. CO的分压不再发生变化
b.气体平均相对分子质量不再发生变化
c. 气体密度不再发生变化
d.
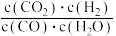 比值不再发生变化
比值不再发生变化(5)在5.0MPa,将n(CO2) : n(H2)=5 : 16的混合气体在催化剂作用下进行反应。体系中气体平衡组成比例(CO和CH3OH在含碳产物中物质的量百分数)及CO2的转化率随温度的变化如图所示。

①表示平衡时CH3OH在含碳产物中物质的量百分数的曲线是
②CO2平衡转化率随温度的升高先减小后增大,增大的原因可能是
③250℃时反应i: CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)的 Kp=
CH3OH(g)+H2O(g)的 Kp=
您最近一年使用:0次
2023·全国·模拟预测
解题方法
10 . 稀土Er单原子光催化剂能高效催化 的还原反应,其反应历程与相对能量如图所示(其中“*”表示稀土Er单原子光催化剂)。
的还原反应,其反应历程与相对能量如图所示(其中“*”表示稀土Er单原子光催化剂)。
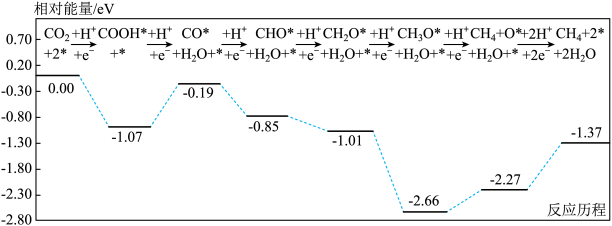
下列说法错误的是
 的还原反应,其反应历程与相对能量如图所示(其中“*”表示稀土Er单原子光催化剂)。
的还原反应,其反应历程与相对能量如图所示(其中“*”表示稀土Er单原子光催化剂)。
下列说法错误的是
| A.反应过程中所有步骤均发生了还原反应 |
B.决速步骤为 |
C.稀土Er原子若催化 ,需转移 ,需转移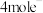 |
D.稀土Er原子提高了 的催化转化效率 的催化转化效率 |
您最近一年使用:0次



