1 . 三氧化二铬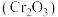 是重要的有机反应催化剂,一种利用铬酸钾
是重要的有机反应催化剂,一种利用铬酸钾 粗品制备
粗品制备 的流程示意图如下。
的流程示意图如下。
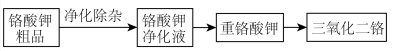
已知:Ⅰ. 粗品中含有
粗品中含有 、
、 等杂质
等杂质
Ⅱ.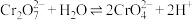

Ⅲ. 易溶于水,
易溶于水, 难溶于水
难溶于水
(1)净化除杂
向 粗品中加入
粗品中加入 溶液,生成
溶液,生成 沉淀以除去
沉淀以除去 、
、 。反应的离子方程式是
。反应的离子方程式是_______ 。
(2)制备
①向 净化液中通入过量的
净化液中通入过量的 可制得
可制得 。反应的化学方程式是
。反应的化学方程式是_______ 。
②电解 净化液也可制得
净化液也可制得 ,装置示意图如图。
,装置示意图如图。

ⅰ.阴极室中获得的产品有 和
和_______ 。
ⅱ.结合化学用语说明制备 的原理:
的原理:_______ 。
ⅲ.取 某
某 溶液稀释至
溶液稀释至 ,移取
,移取 稀释液于锥形瓶中,加入过量的
稀释液于锥形瓶中,加入过量的 溶液,滴加2~3滴酚酞溶液,用
溶液,滴加2~3滴酚酞溶液,用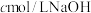 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的体积为
溶液的体积为 。则
。则 溶液的物质的量浓度为
溶液的物质的量浓度为_______  。
。
(3)制备
在热压反应釜中,将蔗糖 与
与 的混合溶液加热至120℃,可获得
的混合溶液加热至120℃,可获得 ,同时生成
,同时生成 、
、 。若生成
。若生成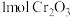 ,理论上消耗蔗糖的物质的量至少是
,理论上消耗蔗糖的物质的量至少是_______ mol。
(4)应用
 催化丙烷脱氢生成丙炔,过程中会发生副反应形成积炭。
催化丙烷脱氢生成丙炔,过程中会发生副反应形成积炭。
①该脱氢反应的两种可能的反应过程a、b如图所示。
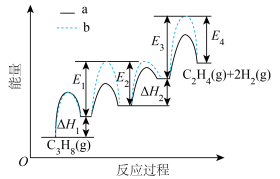
ⅰ.相同条件下,反应速率更快的是_______ (填“a”或“b”)。
ⅱ.该脱氢反应的焓变的计算式为_______ 。
②温度升高到一定程度时,相同时间内,丙炔的产量降低,原因是_______ (答1个)。
 是重要的有机反应催化剂,一种利用铬酸钾
是重要的有机反应催化剂,一种利用铬酸钾 粗品制备
粗品制备 的流程示意图如下。
的流程示意图如下。
已知:Ⅰ.
 粗品中含有
粗品中含有 、
、 等杂质
等杂质Ⅱ.
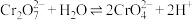

Ⅲ.
 易溶于水,
易溶于水, 难溶于水
难溶于水(1)净化除杂
向
 粗品中加入
粗品中加入 溶液,生成
溶液,生成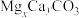 沉淀以除去
沉淀以除去 、
、 。反应的离子方程式是
。反应的离子方程式是(2)制备

①向
 净化液中通入过量的
净化液中通入过量的 可制得
可制得 。反应的化学方程式是
。反应的化学方程式是②电解
 净化液也可制得
净化液也可制得 ,装置示意图如图。
,装置示意图如图。
ⅰ.阴极室中获得的产品有
 和
和ⅱ.结合化学用语说明制备
 的原理:
的原理:ⅲ.取
 某
某 溶液稀释至
溶液稀释至 ,移取
,移取 稀释液于锥形瓶中,加入过量的
稀释液于锥形瓶中,加入过量的 溶液,滴加2~3滴酚酞溶液,用
溶液,滴加2~3滴酚酞溶液,用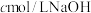 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的体积为
溶液的体积为 。则
。则 溶液的物质的量浓度为
溶液的物质的量浓度为 。
。(3)制备

在热压反应釜中,将蔗糖
 与
与 的混合溶液加热至120℃,可获得
的混合溶液加热至120℃,可获得 ,同时生成
,同时生成 、
、 。若生成
。若生成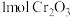 ,理论上消耗蔗糖的物质的量至少是
,理论上消耗蔗糖的物质的量至少是(4)应用

 催化丙烷脱氢生成丙炔,过程中会发生副反应形成积炭。
催化丙烷脱氢生成丙炔,过程中会发生副反应形成积炭。①该脱氢反应的两种可能的反应过程a、b如图所示。

ⅰ.相同条件下,反应速率更快的是
ⅱ.该脱氢反应的焓变的计算式为
②温度升高到一定程度时,相同时间内,丙炔的产量降低,原因是
您最近一年使用:0次
名校
2 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
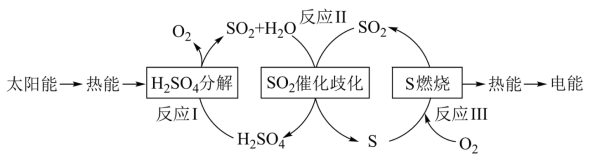
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
写出反应Ⅱ的化学方程式:___________ ,该步反应的ΔH2=___________ kJ·mol-1。
(2)对反应Ⅱ,在某一投料比时,一定压强 (p1)下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

H2SO4在平衡体系中物质的量分数随温度的升高而下降,原因是___________ 。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+____=____+____+2I-,__________
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
①B是A的对比实验,则a=___________ 。
②比较A、B、C,可得出的结论是___________ 。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:___________ 。

(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
写出反应Ⅱ的化学方程式:
(2)对反应Ⅱ,在某一投料比时,一定压强 (p1)下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

H2SO4在平衡体系中物质的量分数随温度的升高而下降,原因是
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+____=____+____+2I-,
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
| A | B | C | D | |
| 试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI与0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI与0.0002 mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
②比较A、B、C,可得出的结论是
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:
您最近一年使用:0次
名校
解题方法
3 . 用H2O2、KI 和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI 在该反应中的作用:H2O2 + I = H2O+ IO ;H2O2 + IO = H2O+ O2↑+ I 。总反应的化学方程式是________ 。
(2)资料 2:H2O2 分解反应过程中能量变化如图所示,其中①有 KI 加入,②无 KI 加入。下列 判断正确的是___________ (填字母)。

a.加入KI 后改变了反应的路径
b.加入KI 后改变了总反应的能量变化
c.H2O2 + I = H2O + IO 是放热反应
(3)实验中发现,H2O2与 KI 溶液混合后,产生大量气泡,溶液颜色变黄。再加入 CCl4,振荡、静置,气泡明显减少。
资料 3:I2 也可催化H2O2的分解反应。
① 加CCl4 并振荡、静置后还可观察到________ ,说明有 I2 生成。
② 气泡明显减少的原因可能是:ⅰ.H2O2 浓度降低;ⅱ.________ 。以下对照实验说明ⅰ不是主要原因:向H2O2溶液中加入 KI 溶液,待溶液变黄后,分成两等份于A、B 两试管中。A 试管加入 CCl4,B 试管不加CCl4,分别振荡、静置。观察到的现象是________ 。
(4)资料 4: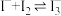 K= 640。
K= 640。
为了探究体系中含碘微粒的存在形式,进行实验:向 20 mL 一定浓度的H2O2溶液中加入10 mL 0.10 mol·L−1 KI 溶液,达平衡后,相关微粒浓度如下:
① a =___________ 。
② 该平衡体系中除了含有 和
和 外,一定还含有其他含碘微粒,理由是
外,一定还含有其他含碘微粒,理由是___________ 。
(1)资料1:KI 在该反应中的作用:H2O2 + I = H2O+ IO ;H2O2 + IO = H2O+ O2↑+ I 。总反应的化学方程式是
(2)资料 2:H2O2 分解反应过程中能量变化如图所示,其中①有 KI 加入,②无 KI 加入。下列 判断正确的是

a.加入KI 后改变了反应的路径
b.加入KI 后改变了总反应的能量变化
c.H2O2 + I = H2O + IO 是放热反应
(3)实验中发现,H2O2与 KI 溶液混合后,产生大量气泡,溶液颜色变黄。再加入 CCl4,振荡、静置,气泡明显减少。
资料 3:I2 也可催化H2O2的分解反应。
① 加CCl4 并振荡、静置后还可观察到
② 气泡明显减少的原因可能是:ⅰ.H2O2 浓度降低;ⅱ.
(4)资料 4:
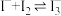 K= 640。
K= 640。为了探究体系中含碘微粒的存在形式,进行实验:向 20 mL 一定浓度的H2O2溶液中加入10 mL 0.10 mol·L−1 KI 溶液,达平衡后,相关微粒浓度如下:
| 微粒 |  |  |  |
| 浓度(mol·L−1) | 2.5×10−3 | a | 4.0×10−3 |
② 该平衡体系中除了含有
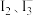 和
和 外,一定还含有其他含碘微粒,理由是
外,一定还含有其他含碘微粒,理由是
您最近一年使用:0次
2023·山东淄博·三模
4 . 室温下,通过下列实验探究 溶液的性质。
溶液的性质。
下列有关说法错误的是
 溶液的性质。
溶液的性质。| 实验 | 实验操作和现象 |
| Ⅰ | 用 计测定 计测定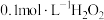 溶液的 溶液的 为6.2 为6.2 |
| Ⅱ | 取少量新制饱和氯水于试管中,向其中加入 溶液至过量,产生大量无色气泡…… 溶液至过量,产生大量无色气泡…… |
| Ⅲ | 向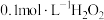 溶液中滴加少量 溶液中滴加少量 溶液,溶液迅速变黄,稍后产生气体;再加入几滴 溶液,溶液迅速变黄,稍后产生气体;再加入几滴 溶液,溶液变红,一段时间后,溶液颜色明显变浅 溶液,溶液变红,一段时间后,溶液颜色明显变浅 |
| Ⅳ | 向 溶液中滴加 溶液中滴加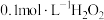 溶液,很快有大量气体逸出, 溶液,很快有大量气体逸出, 后,蓝色溶液变为红色浑浊 后,蓝色溶液变为红色浑浊 ,继续加入 ,继续加入 溶液,红色浑浊又变为蓝色溶液 溶液,红色浑浊又变为蓝色溶液 |
A.由实验Ⅰ可知,室温下 |
| B.实验Ⅱ中还可观察到溶液的颜色逐渐变浅,最后消失 |
C.实验Ⅲ中一段时间后,溶液颜色明显变浅,原因是过量的 有氧化作用 有氧化作用 |
D.实验Ⅲ、Ⅳ表明 溶液、 溶液、 溶液对 溶液对 溶液的分解均有一定的催化作用 溶液的分解均有一定的催化作用 |
您最近一年使用:0次
名校
解题方法
5 . 中国科学家首次用 改性铜基催化剂,将草酸二甲酯加氢制乙二醇的反应条件从高压降至常压。草酸二甲酯加氢的主要反应有:
改性铜基催化剂,将草酸二甲酯加氢制乙二醇的反应条件从高压降至常压。草酸二甲酯加氢的主要反应有:
③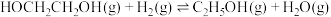
其他条件相同时,相同时间内温度对产物选择性的影响结果如图。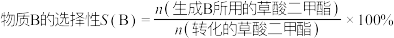
ii.450~500K,反应③的平衡常数远大于反应①和反应②的平衡常数
下列说法不正确 的是
 改性铜基催化剂,将草酸二甲酯加氢制乙二醇的反应条件从高压降至常压。草酸二甲酯加氢的主要反应有:
改性铜基催化剂,将草酸二甲酯加氢制乙二醇的反应条件从高压降至常压。草酸二甲酯加氢的主要反应有:①

③
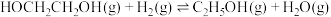
其他条件相同时,相同时间内温度对产物选择性的影响结果如图。

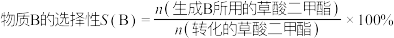
ii.450~500K,反应③的平衡常数远大于反应①和反应②的平衡常数
下列说法
| A.制乙二醇适宜的温度范围是470~480K |
| B.实验条件下反应③的活化的最高,升温更有利于反应③ |
| C.减压可提高乙二醇的平衡产率 |
D.铜基催化剂用 改性后反应速率增大,可以降低反应所需的压强 改性后反应速率增大,可以降低反应所需的压强 |
您最近一年使用:0次
2023-05-11更新
|
810次组卷
|
4卷引用:北京市西城区2023届高三二模化学试题
北京市西城区2023届高三二模化学试题(已下线)北京市第四中学2023-2024学年高三下学期开学摸底测验化学试题北京市清华大学附属中学朝阳学校2023-2024学年高三下学期开学考化学试题黑龙江省大庆市实验中学实验二部2023-2024学年高三下学期得分训练化学试题(五)
名校
6 . 碳酸二甲酯(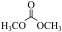 )是一种绿色化工原料。用于汽车、医疗器械等领域。以甲醇为原料生产碳酸二甲酯的反应过程如下。
)是一种绿色化工原料。用于汽车、医疗器械等领域。以甲醇为原料生产碳酸二甲酯的反应过程如下。
i.
ii.
(1)碳酸二甲酯分子中碳原子的杂化类型是___________ 。
(2)CuCl中,基态 的价电子排布式为
的价电子排布式为___________ ,CuCl在生产碳酸二甲酯的反应过程中所起的作用是___________ 。
(3)上述方法中,甲醇单位时间内的转化率较低。为分析原因,查阅如下资料。
i.甲醇单位时间内的转化率主要受 (+1价铜元素)浓度的影响。
(+1价铜元素)浓度的影响。
ii.CuCl在甲醇中溶解度较小,且其中的 易被氧化为难溶的CuO。
易被氧化为难溶的CuO。
iii.加入4-甲基咪唑(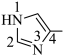 )可与
)可与 形成配合物, 可提高甲醇的转化率。4-甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。
形成配合物, 可提高甲醇的转化率。4-甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。
请结合信息回答以下问题。
①4-甲基咪唑中,1~4号原子___________ (填“在”或“不在”)同一平面上,___________ (填“1”或“3”)号N原子更容易与 形成配位键。
形成配位键。
②加入4-甲基咪唑后,甲醇转化率提高,可能的原因是___________ (填序号)。
a. 配合物中的-NH结构可增大其在甲醇中的溶解度
配合物中的-NH结构可增大其在甲醇中的溶解度
b.通过形成配合物,避免 被氧化为难溶的CuO
被氧化为难溶的CuO
c.形成的 配合物能增大反应的限度
配合物能增大反应的限度
(4)配位原子提供孤电子对的能力是影响配体与 之间配位键强度的一个重要因素。若用某结构相似的含O配体与
之间配位键强度的一个重要因素。若用某结构相似的含O配体与 配位,所得配合物的稳定性比含N配体低,可能的原因是
配位,所得配合物的稳定性比含N配体低,可能的原因是___________ 。
 )是一种绿色化工原料。用于汽车、医疗器械等领域。以甲醇为原料生产碳酸二甲酯的反应过程如下。
)是一种绿色化工原料。用于汽车、医疗器械等领域。以甲醇为原料生产碳酸二甲酯的反应过程如下。i.

ii.

(1)碳酸二甲酯分子中碳原子的杂化类型是
(2)CuCl中,基态
 的价电子排布式为
的价电子排布式为(3)上述方法中,甲醇单位时间内的转化率较低。为分析原因,查阅如下资料。
i.甲醇单位时间内的转化率主要受
 (+1价铜元素)浓度的影响。
(+1价铜元素)浓度的影响。ii.CuCl在甲醇中溶解度较小,且其中的
 易被氧化为难溶的CuO。
易被氧化为难溶的CuO。iii.加入4-甲基咪唑(
 )可与
)可与 形成配合物, 可提高甲醇的转化率。4-甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。
形成配合物, 可提高甲醇的转化率。4-甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。请结合信息回答以下问题。
①4-甲基咪唑中,1~4号原子
 形成配位键。
形成配位键。②加入4-甲基咪唑后,甲醇转化率提高,可能的原因是
a.
 配合物中的-NH结构可增大其在甲醇中的溶解度
配合物中的-NH结构可增大其在甲醇中的溶解度b.通过形成配合物,避免
 被氧化为难溶的CuO
被氧化为难溶的CuOc.形成的
 配合物能增大反应的限度
配合物能增大反应的限度(4)配位原子提供孤电子对的能力是影响配体与
 之间配位键强度的一个重要因素。若用某结构相似的含O配体与
之间配位键强度的一个重要因素。若用某结构相似的含O配体与 配位,所得配合物的稳定性比含N配体低,可能的原因是
配位,所得配合物的稳定性比含N配体低,可能的原因是
您最近一年使用:0次
名校
解题方法
7 . 将天然气(主要成分为 )中的
)中的 、
、 资源化转化在能源利用。环境保护等方面意义重大。
资源化转化在能源利用。环境保护等方面意义重大。
(1) 转化为CO、
转化为CO、 转化为S的反应如下:
转化为S的反应如下:
i.
 kJ/mol
kJ/mol
ii.
 kJ/mol
kJ/mol
iii. 、
、 转化生成CO、S等物质的热化学方程是
转化生成CO、S等物质的热化学方程是___________ 。
(2) 性质稳定,是一种“惰性”分子。对于反应iii,通过设计合适的催化剂可以降低反应的
性质稳定,是一种“惰性”分子。对于反应iii,通过设计合适的催化剂可以降低反应的___________ ,提高反应速率。
a.活化能 b. c.平衡常数
c.平衡常数
(3)我国科学家通过研制新型催化剂,设计协同转化装置实现反应,工作原理如图所示。
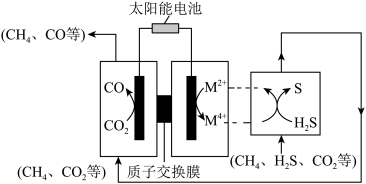
【方案1】若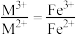
①结合化学用语说明生成S、CO的原理:___________ 。
【方案2】若
电流效率 的定义
的定义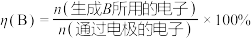
②测得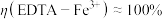 ,
,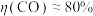 ,阴极放电的物质有
,阴极放电的物质有___________ ;
③为进一步确认 、
、 能协同转化,对CO的来源分析如下:
能协同转化,对CO的来源分析如下:
来源1: 通过电极反应产生CO;
通过电极反应产生CO;
来源2:电解质(含碳元素)等碳基材料发生降解,产生CO。
设计实验探究,证实来源2不成立。实验方案是___________ 。
结论:方案2明显优于方案1。该研究成果为天然气的净化、资源化转化提供了工业化解决思路。
 )中的
)中的 、
、 资源化转化在能源利用。环境保护等方面意义重大。
资源化转化在能源利用。环境保护等方面意义重大。(1)
 转化为CO、
转化为CO、 转化为S的反应如下:
转化为S的反应如下:i.

 kJ/mol
kJ/molii.

 kJ/mol
kJ/moliii.
 、
、 转化生成CO、S等物质的热化学方程是
转化生成CO、S等物质的热化学方程是(2)
 性质稳定,是一种“惰性”分子。对于反应iii,通过设计合适的催化剂可以降低反应的
性质稳定,是一种“惰性”分子。对于反应iii,通过设计合适的催化剂可以降低反应的a.活化能 b.
 c.平衡常数
c.平衡常数(3)我国科学家通过研制新型催化剂,设计协同转化装置实现反应,工作原理如图所示。

【方案1】若
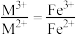
①结合化学用语说明生成S、CO的原理:
【方案2】若

电流效率
 的定义
的定义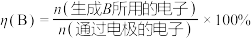
②测得
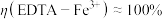 ,
,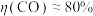 ,阴极放电的物质有
,阴极放电的物质有③为进一步确认
 、
、 能协同转化,对CO的来源分析如下:
能协同转化,对CO的来源分析如下:来源1:
 通过电极反应产生CO;
通过电极反应产生CO;来源2:电解质(含碳元素)等碳基材料发生降解,产生CO。
设计实验探究,证实来源2不成立。实验方案是
结论:方案2明显优于方案1。该研究成果为天然气的净化、资源化转化提供了工业化解决思路。
您最近一年使用:0次
名校
8 . “碳达峰·碳中和”是我国社会发展重大战略之一, 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应有:
是实现“双碳”经济的有效途径之一,相关的主要反应有:
Ⅰ.
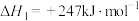 ,
,
Ⅱ.
 ,
,
(1)有利于提高 平衡转化率的条件是_______。
平衡转化率的条件是_______。
(2)反应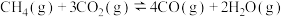 的
的
_______  。
。
(3)恒压,750℃时, 和
和 按物质的量之比
按物质的量之比 投料,反应经如下流程(主要产物已标出)可实现
投料,反应经如下流程(主要产物已标出)可实现 高效转化为
高效转化为 。
。

①假设各步均转化完全,下列说法正确的是_______ 。(填序号)
A.过程ⅰ和过程ⅱ中均发生了氧化还原反应
B.过程ⅱ中使用的催化剂为 和
和
C.过程ⅱ, 吸收
吸收 可促使
可促使 氧化
氧化 的平衡正移
的平衡正移
D.相比于反应Ⅰ,该流程的总反应还原 需要吸收的能量更多
需要吸收的能量更多
②过程ⅱ平衡后通入惰性气体 ,测得一段时间内
,测得一段时间内 物质的量上升,根据过程ⅲ,结合平衡移动原理,解释
物质的量上升,根据过程ⅲ,结合平衡移动原理,解释 物质的量上升的原因
物质的量上升的原因_______ 。
(4) 还原能力(R)可衡量
还原能力(R)可衡量 转化效率,
转化效率,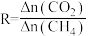 (同一时段内
(同一时段内 与
与 的物质的量变化量之比)。
的物质的量变化量之比)。
①常压下 和
和 按物质的量之比
按物质的量之比 投料,某一时段内
投料,某一时段内 和
和 的转化率随温度变化如图1,请在图2中画出400~1000℃之间R的变化趋势,并标明1000℃时R值。
的转化率随温度变化如图1,请在图2中画出400~1000℃之间R的变化趋势,并标明1000℃时R值。______

②催化剂X可改变R值,另一时段内 转化率、R值随温度变化如下表,下列说法不正确的是
转化率、R值随温度变化如下表,下列说法不正确的是_______ 。
A.催化剂X选择性地提高反应Ⅱ的速率
B.温度越低,含氢产物中 占比越高
占比越高
C.温度升高, 转化率增加,
转化率增加, 转化率降低,R值减小
转化率降低,R值减小
D.改变催化剂提高 转化率,R值不一定增大
转化率,R值不一定增大
 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应有:
是实现“双碳”经济的有效途径之一,相关的主要反应有:Ⅰ.

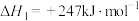 ,
,
Ⅱ.

 ,
,
(1)有利于提高
 平衡转化率的条件是_______。
平衡转化率的条件是_______。| A.低温低压 | B.低温高压 | C.高温低压 | D.高温高压 |
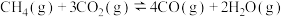 的
的
 。
。(3)恒压,750℃时,
 和
和 按物质的量之比
按物质的量之比 投料,反应经如下流程(主要产物已标出)可实现
投料,反应经如下流程(主要产物已标出)可实现 高效转化为
高效转化为 。
。
①假设各步均转化完全,下列说法正确的是
A.过程ⅰ和过程ⅱ中均发生了氧化还原反应
B.过程ⅱ中使用的催化剂为
 和
和
C.过程ⅱ,
 吸收
吸收 可促使
可促使 氧化
氧化 的平衡正移
的平衡正移D.相比于反应Ⅰ,该流程的总反应还原
 需要吸收的能量更多
需要吸收的能量更多②过程ⅱ平衡后通入惰性气体
 ,测得一段时间内
,测得一段时间内 物质的量上升,根据过程ⅲ,结合平衡移动原理,解释
物质的量上升,根据过程ⅲ,结合平衡移动原理,解释 物质的量上升的原因
物质的量上升的原因(4)
 还原能力(R)可衡量
还原能力(R)可衡量 转化效率,
转化效率,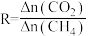 (同一时段内
(同一时段内 与
与 的物质的量变化量之比)。
的物质的量变化量之比)。①常压下
 和
和 按物质的量之比
按物质的量之比 投料,某一时段内
投料,某一时段内 和
和 的转化率随温度变化如图1,请在图2中画出400~1000℃之间R的变化趋势,并标明1000℃时R值。
的转化率随温度变化如图1,请在图2中画出400~1000℃之间R的变化趋势,并标明1000℃时R值。
②催化剂X可改变R值,另一时段内
 转化率、R值随温度变化如下表,下列说法不正确的是
转化率、R值随温度变化如下表,下列说法不正确的是| 温度/℃ | 480 | 500 | 520 | 550 |
 转化率/% 转化率/% | 11.5 | 20.2 | 34.8 | 46.9 |
| R | 2.6 | 2.4 | 2.1 | 1.8 |
B.温度越低,含氢产物中
 占比越高
占比越高C.温度升高,
 转化率增加,
转化率增加, 转化率降低,R值减小
转化率降低,R值减小D.改变催化剂提高
 转化率,R值不一定增大
转化率,R值不一定增大
您最近一年使用:0次
2023-02-17更新
|
269次组卷
|
2卷引用:北京市第二中学2022-2023学年高三下学期2月开学测试化学试题
名校
解题方法
9 . 乙二醇是一种重要的基本化工原料。煤制乙二醇的工艺流程如下:

(1)I中气化炉内的主要反应有:
i.
ii.
①写出CO2被C还原成CO的热化学反应方程式:_______ 。
②其他条件相同时,增大气化炉内水蒸气的分压P(混合气体中某气体的分压越大,表明其浓度越大),达到平衡时各组分的体积分数( )如下表所示。解释出现该变化趋势的可能原因是
)如下表所示。解释出现该变化趋势的可能原因是_______ 。
(2)II的总反应是4CO+4CH3OH+O2 2
2  +2H2O,该过程分两步进行。
+2H2O,该过程分两步进行。
第一步为CO与亚硝酸甲酯(CH3ONO)在Pd催化剂作用下发生反应:
第二步为常温常压下利用NO、CH3OH和O2进行的CH3ONO再生反应。
①第二步反应的化学方程式是_______ 。
②第一步反应的机理如下图所示,下列说法正确的是_______ (填字母序号)。
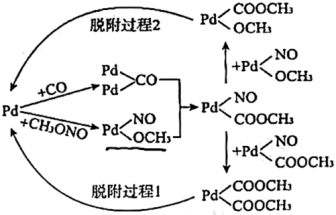
a. CH3ONO中氮氧双键在Pd表面断裂
b.脱附过程1生成了草酸二甲酯
c.脱附过程2生成了副产物碳酸二甲酯(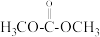 )
)
d.增大投料比[n(CO):n(CH3ONO)],可提高最终产物中草酸二甲酯的比率
③第一步反应时,若CO中混有少量H2,H2在Pd表面易形成PD-H中间体,结合第一步反应机理,推测因H2导致生成的副产物有_____ 、____ 。
(3)Ⅲ中,草酸二甲酯经过催化氢化可生成乙二醇和甲醇。理论上,该反应中n(草酸二甲酯):n (氢气)
___ 。

(1)I中气化炉内的主要反应有:
i.

ii.
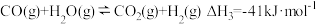
①写出CO2被C还原成CO的热化学反应方程式:
②其他条件相同时,增大气化炉内水蒸气的分压P(混合气体中某气体的分压越大,表明其浓度越大),达到平衡时各组分的体积分数(
 )如下表所示。解释出现该变化趋势的可能原因是
)如下表所示。解释出现该变化趋势的可能原因是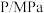 |  |  |  |
| 0.017 | 15.79 | 31.50 | 51.23 |
| 0.041 | 19.52 | 27.12 | 52.04 |
| 0.065 | 21.15 | 23.36 | 54.14 |
| 0.088 | 21.64 | 21.72 | 55.46 |
 2
2  +2H2O,该过程分两步进行。
+2H2O,该过程分两步进行。第一步为CO与亚硝酸甲酯(CH3ONO)在Pd催化剂作用下发生反应:

第二步为常温常压下利用NO、CH3OH和O2进行的CH3ONO再生反应。
①第二步反应的化学方程式是
②第一步反应的机理如下图所示,下列说法正确的是

a. CH3ONO中氮氧双键在Pd表面断裂
b.脱附过程1生成了草酸二甲酯
c.脱附过程2生成了副产物碳酸二甲酯(
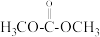 )
)d.增大投料比[n(CO):n(CH3ONO)],可提高最终产物中草酸二甲酯的比率
③第一步反应时,若CO中混有少量H2,H2在Pd表面易形成PD-H中间体,结合第一步反应机理,推测因H2导致生成的副产物有
(3)Ⅲ中,草酸二甲酯经过催化氢化可生成乙二醇和甲醇。理论上,该反应中n(草酸二甲酯):n (氢气)

您最近一年使用:0次
2021-04-10更新
|
718次组卷
|
4卷引用:北京一零一中学2023-2024学年高三上学期月考三化学试题
名校
10 . 某同学在室温下进行下图所示实验。(已知:H2C2O4为二元弱酸)

试管a、b、c中溶液褪色分别耗时690s、677s、600s。下列说法正确的是

试管a、b、c中溶液褪色分别耗时690s、677s、600s。下列说法正确的是
| A.反应的离子方程式为2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O |
| B.试管c反应至300 s时,溶液中剩余的c(KMnO4)=0.0025 mol/L |
| C.对比试管a、b,得到的结论是H2C2O4水溶液浓度增大,反应速率加快 |
| D.对比试管c、d,可验证H+浓度对反应速率的影响 |
您最近一年使用:0次
2020-05-09更新
|
835次组卷
|
5卷引用:北京市第八十中学2024届高三上学期10月月考化学试题
北京市第八十中学2024届高三上学期10月月考化学试题北京市海淀区2020届高三第一次模拟考试化学试题(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编 选择题:化学实验北京一零一中学2022-2023学年高二上学期统练二化学试题重庆市育才中学2022届高三二诊模拟考试(二)化学试题



