碳酸二甲酯(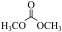 )是一种绿色化工原料。用于汽车、医疗器械等领域。以甲醇为原料生产碳酸二甲酯的反应过程如下。
)是一种绿色化工原料。用于汽车、医疗器械等领域。以甲醇为原料生产碳酸二甲酯的反应过程如下。
i.
ii.
(1)碳酸二甲酯分子中碳原子的杂化类型是___________ 。
(2)CuCl中,基态 的价电子排布式为
的价电子排布式为___________ ,CuCl在生产碳酸二甲酯的反应过程中所起的作用是___________ 。
(3)上述方法中,甲醇单位时间内的转化率较低。为分析原因,查阅如下资料。
i.甲醇单位时间内的转化率主要受 (+1价铜元素)浓度的影响。
(+1价铜元素)浓度的影响。
ii.CuCl在甲醇中溶解度较小,且其中的 易被氧化为难溶的CuO。
易被氧化为难溶的CuO。
iii.加入4-甲基咪唑(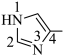 )可与
)可与 形成配合物, 可提高甲醇的转化率。4-甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。
形成配合物, 可提高甲醇的转化率。4-甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。
请结合信息回答以下问题。
①4-甲基咪唑中,1~4号原子___________ (填“在”或“不在”)同一平面上,___________ (填“1”或“3”)号N原子更容易与 形成配位键。
形成配位键。
②加入4-甲基咪唑后,甲醇转化率提高,可能的原因是___________ (填序号)。
a. 配合物中的-NH结构可增大其在甲醇中的溶解度
配合物中的-NH结构可增大其在甲醇中的溶解度
b.通过形成配合物,避免 被氧化为难溶的CuO
被氧化为难溶的CuO
c.形成的 配合物能增大反应的限度
配合物能增大反应的限度
(4)配位原子提供孤电子对的能力是影响配体与 之间配位键强度的一个重要因素。若用某结构相似的含O配体与
之间配位键强度的一个重要因素。若用某结构相似的含O配体与 配位,所得配合物的稳定性比含N配体低,可能的原因是
配位,所得配合物的稳定性比含N配体低,可能的原因是___________ 。
 )是一种绿色化工原料。用于汽车、医疗器械等领域。以甲醇为原料生产碳酸二甲酯的反应过程如下。
)是一种绿色化工原料。用于汽车、医疗器械等领域。以甲醇为原料生产碳酸二甲酯的反应过程如下。i.

ii.

(1)碳酸二甲酯分子中碳原子的杂化类型是
(2)CuCl中,基态
 的价电子排布式为
的价电子排布式为(3)上述方法中,甲醇单位时间内的转化率较低。为分析原因,查阅如下资料。
i.甲醇单位时间内的转化率主要受
 (+1价铜元素)浓度的影响。
(+1价铜元素)浓度的影响。ii.CuCl在甲醇中溶解度较小,且其中的
 易被氧化为难溶的CuO。
易被氧化为难溶的CuO。iii.加入4-甲基咪唑(
 )可与
)可与 形成配合物, 可提高甲醇的转化率。4-甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。
形成配合物, 可提高甲醇的转化率。4-甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。请结合信息回答以下问题。
①4-甲基咪唑中,1~4号原子
 形成配位键。
形成配位键。②加入4-甲基咪唑后,甲醇转化率提高,可能的原因是
a.
 配合物中的-NH结构可增大其在甲醇中的溶解度
配合物中的-NH结构可增大其在甲醇中的溶解度b.通过形成配合物,避免
 被氧化为难溶的CuO
被氧化为难溶的CuOc.形成的
 配合物能增大反应的限度
配合物能增大反应的限度(4)配位原子提供孤电子对的能力是影响配体与
 之间配位键强度的一个重要因素。若用某结构相似的含O配体与
之间配位键强度的一个重要因素。若用某结构相似的含O配体与 配位,所得配合物的稳定性比含N配体低,可能的原因是
配位,所得配合物的稳定性比含N配体低,可能的原因是
更新时间:2023-03-28 21:11:06
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】我国力争于2030年前完成碳达峰。2060年前实现碳中和,含碳化合物的合成与转化具有重要的研究价值和现实意义。
Ⅰ. 甲烷化反应是碳循环利用的重要路径之一。
甲烷化反应是碳循环利用的重要路径之一。
 甲烷化主反应:
甲烷化主反应: 。
。
副反应:a.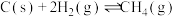 ;
;
b.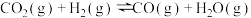 ;
;
c. 。
。
(1)副反应b所生成的CO也能发生甲烷化反应,则化学方程式为___________ 。
(2)催化剂的选择是 甲烷化技术的核心。在两种不同催化剂条件下,反应时间相同测得
甲烷化技术的核心。在两种不同催化剂条件下,反应时间相同测得 转化率和生成
转化率和生成 选择性随温度变化的影响如下图所示。
选择性随温度变化的影响如下图所示。
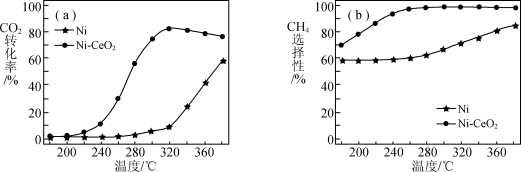
提示:甲烷的选择性是指转化为甲烷的 在全部
在全部 反应物中所占的比例。
反应物中所占的比例。
高于320℃后,以 为催化剂
为催化剂 转化率略有下降,而以Ni为催化剂
转化率略有下降,而以Ni为催化剂 转化率仍在上升,其原因是
转化率仍在上升,其原因是___________ 。
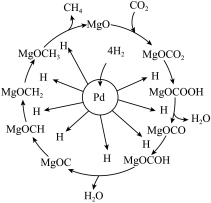
(3)二氧化碳甲烷化反应在某催化剂催化下的反应机理如图所示。下列叙述不正确的是________。
Ⅱ.甲醚( )是重要的化工原料,可用CO和
)是重要的化工原料,可用CO和 制得,热化学方程式为
制得,热化学方程式为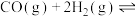

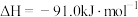 ;
;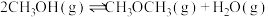
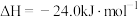 。
。
生产甲醚过程中存在副反应: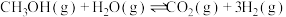
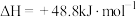 。将反应物混合气按进料比
。将反应物混合气按进料比 通入反应装置,选择合适的催化剂。在不同温度和压强下,测得甲醚的选择性分别为如图1、图2所示。
通入反应装置,选择合适的催化剂。在不同温度和压强下,测得甲醚的选择性分别为如图1、图2所示。
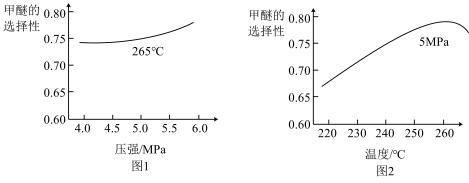
(4)图1中,温度一定,压强增大,甲醚选择性增大的原因是___________ 。
(5)图2中,温度高于265℃后,甲醚选择性降低的原因是___________ 。
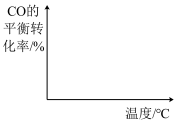
(6)向容积可变的密闭容器中充入mmol CO和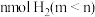 在恒温恒压条件下发生反应:
在恒温恒压条件下发生反应: ,在图中画出CO的平衡转化率随温度、压强(
,在图中画出CO的平衡转化率随温度、压强(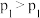 )的变化图。
)的变化图。___________
Ⅰ.
 甲烷化反应是碳循环利用的重要路径之一。
甲烷化反应是碳循环利用的重要路径之一。 甲烷化主反应:
甲烷化主反应: 。
。副反应:a.
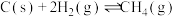 ;
;b.
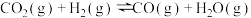 ;
;c.
 。
。(1)副反应b所生成的CO也能发生甲烷化反应,则化学方程式为
(2)催化剂的选择是
 甲烷化技术的核心。在两种不同催化剂条件下,反应时间相同测得
甲烷化技术的核心。在两种不同催化剂条件下,反应时间相同测得 转化率和生成
转化率和生成 选择性随温度变化的影响如下图所示。
选择性随温度变化的影响如下图所示。
提示:甲烷的选择性是指转化为甲烷的
 在全部
在全部 反应物中所占的比例。
反应物中所占的比例。高于320℃后,以
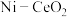 为催化剂
为催化剂 转化率略有下降,而以Ni为催化剂
转化率略有下降,而以Ni为催化剂 转化率仍在上升,其原因是
转化率仍在上升,其原因是(3)二氧化碳甲烷化反应在某催化剂催化下的反应机理如图所示。下列叙述不正确的是________。

| A.氢气在Pd表面被吸附解离成氢原子 | B.MgO是反应的中间体 |
| C.图中碳元素的价态有多种 | D.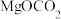 浊液加热生成 浊液加热生成 |
Ⅱ.甲醚(
 )是重要的化工原料,可用CO和
)是重要的化工原料,可用CO和 制得,热化学方程式为
制得,热化学方程式为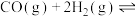

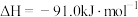 ;
;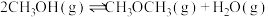
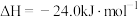 。
。生产甲醚过程中存在副反应:
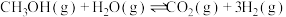
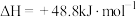 。将反应物混合气按进料比
。将反应物混合气按进料比 通入反应装置,选择合适的催化剂。在不同温度和压强下,测得甲醚的选择性分别为如图1、图2所示。
通入反应装置,选择合适的催化剂。在不同温度和压强下,测得甲醚的选择性分别为如图1、图2所示。
(4)图1中,温度一定,压强增大,甲醚选择性增大的原因是
(5)图2中,温度高于265℃后,甲醚选择性降低的原因是
(6)向容积可变的密闭容器中充入mmol CO和
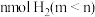 在恒温恒压条件下发生反应:
在恒温恒压条件下发生反应: ,在图中画出CO的平衡转化率随温度、压强(
,在图中画出CO的平衡转化率随温度、压强(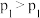 )的变化图。
)的变化图。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】工业上,以 为原料,通过不同反应生产更高价值的
为原料,通过不同反应生产更高价值的 。
。
I. 直接分解生产
直接分解生产 :
:
反应①:
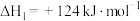
反应②: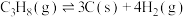

请回答:
(1)恒温下,往恒容(10L)反应釜中通入4mol (g)(仅考虑发生上述反应)。某时刻
(g)(仅考虑发生上述反应)。某时刻 转化率为20%,
转化率为20%, 选择性为40%,则该时刻反应①的浓度商
选择性为40%,则该时刻反应①的浓度商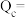
_______ 。
(2)下列说法正确的是_______。
(3)研究表明,在固体催化剂N存在下,反应①分三步进行,生成 步骤的活化能远大于生成
步骤的活化能远大于生成 步骤的活化能,且开始一段时间内
步骤的活化能,且开始一段时间内 与
与 的生成速率几乎相同(不考虑反应②)。画出步骤2和步骤3生成产物的反应过程能量示意图
的生成速率几乎相同(不考虑反应②)。画出步骤2和步骤3生成产物的反应过程能量示意图_______ 。

II. 辅助
辅助 生产
生产 :
:
反应③:
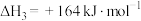
恒温恒压下, 和
和 按物质的量之比1:1以一定流速通入装有某复合催化剂的反应器中,反应过程如图所示:
按物质的量之比1:1以一定流速通入装有某复合催化剂的反应器中,反应过程如图所示:

(4)关于反应过程,下列说法正确的是_______。
(5)对该反应器催化剂表面上CO的生成速率和 的消耗速率进行测定,所得实验结果如图2,请结合具体反应说明CO的生成速率和
的消耗速率进行测定,所得实验结果如图2,请结合具体反应说明CO的生成速率和 的消耗速率不相等的可能原因
的消耗速率不相等的可能原因_______ 。

 为原料,通过不同反应生产更高价值的
为原料,通过不同反应生产更高价值的 。
。I.
 直接分解生产
直接分解生产 :
:反应①:

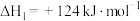
反应②:
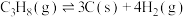

请回答:
(1)恒温下,往恒容(10L)反应釜中通入4mol
 (g)(仅考虑发生上述反应)。某时刻
(g)(仅考虑发生上述反应)。某时刻 转化率为20%,
转化率为20%, 选择性为40%,则该时刻反应①的浓度商
选择性为40%,则该时刻反应①的浓度商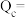
(2)下列说法正确的是_______。
| A.反应①能自发进行的条件是低温 |
| B.温度升高,反应②的平衡常数增大 |
| C.压强增大,活化分子百分数增多,导致反应①速率加快 |
| D.可通过C(s)的物质的量不再变化判断反应②达到平衡状态 |
 步骤的活化能远大于生成
步骤的活化能远大于生成 步骤的活化能,且开始一段时间内
步骤的活化能,且开始一段时间内 与
与 的生成速率几乎相同(不考虑反应②)。画出步骤2和步骤3生成产物的反应过程能量示意图
的生成速率几乎相同(不考虑反应②)。画出步骤2和步骤3生成产物的反应过程能量示意图
II.
 辅助
辅助 生产
生产 :
:反应③:

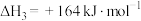
恒温恒压下,
 和
和 按物质的量之比1:1以一定流速通入装有某复合催化剂的反应器中,反应过程如图所示:
按物质的量之比1:1以一定流速通入装有某复合催化剂的反应器中,反应过程如图所示:
(4)关于反应过程,下列说法正确的是_______。
A.M可循环利用, 不可循环利用 不可循环利用 |
| B.过程1作用力a是氢键,过程2涉及极性键的形成和断裂 |
| C.温度升高,过程1和过程2的反应速率均加快,总反应速率一定加快 |
D.其他条件不变,更换不同催化剂,同样生产1mol  (g)所需能量不一定相同 (g)所需能量不一定相同 |
 的消耗速率进行测定,所得实验结果如图2,请结合具体反应说明CO的生成速率和
的消耗速率进行测定,所得实验结果如图2,请结合具体反应说明CO的生成速率和 的消耗速率不相等的可能原因
的消耗速率不相等的可能原因
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】苯乙烯是一种很重要的有机化学原料,用途十分广泛。在以水蒸气做稀释剂、存在催化剂的条件下,乙苯催化脱氢可生成苯乙烯。可能发生如下两个反应;
主反应: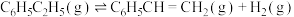
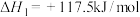 ;
;
副反应: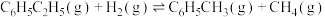
 。
。
回答下列问题:
(1)已知,在 、
、 条件下,
条件下,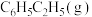 、
、 、
、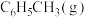 、
、 的燃烧热分别为
的燃烧热分别为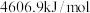 、
、 、
、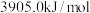 、
、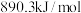 。则
。则
_______  。
。
(2)在某温度、pkPa的条件下,向反应器中充入 气态乙苯发生主反应:
气态乙苯发生主反应: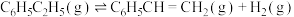 ,其平衡转化率为50%,若向该反应器中充入
,其平衡转化率为50%,若向该反应器中充入 水蒸气作为稀释气(计算时忽略副反应),可将平衡转化率提高至
水蒸气作为稀释气(计算时忽略副反应),可将平衡转化率提高至_______ 。
(3)在不同的温度条件下,以水烃比 投料,在膜反应器中发生乙苯催化脱氢反应
投料,在膜反应器中发生乙苯催化脱氢反应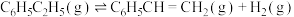 。膜反应器可以通过多孔膜移去
。膜反应器可以通过多孔膜移去 ,提高乙苯的平衡转化率,工作原理如图所示:
,提高乙苯的平衡转化率,工作原理如图所示: 移出率
移出率
 ×100%。
×100%。
①忽略副反应,维持体系总压强p恒定,在温度T时,已知乙苯的平衡转化率为 ,
, 的移出率为b,则在该温度下主反应的平衡常数
的移出率为b,则在该温度下主反应的平衡常数
_______ (用含 、b、p的代数式表示)。
、b、p的代数式表示)。
②乙苯的平衡转化率增长百分数与 的移出率在不同温度条件下的关系如表所示:
的移出率在不同温度条件下的关系如表所示:
高温下副反应程度极小,试说明当温度高于950℃时,乙苯的平衡转化率随 的移出率的变化改变程度不大的原因:
的移出率的变化改变程度不大的原因:_______ 。
③下列说法正确的是_______ (填选项字母)。
A.生成 的总物质的量与苯乙烯相等
的总物质的量与苯乙烯相等
B.因为 被分离至隔离区,故反应器中不发生副反应
被分离至隔离区,故反应器中不发生副反应
C.在恒容的膜反应器中,其他条件不变,增大水烃比,可提高乙苯的转化率
D.当 的分压不再发生变化时,说明主副反应均达到平衡状态
的分压不再发生变化时,说明主副反应均达到平衡状态
(4)有研究者发现,在 气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图所示:
气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图所示:_______ 。
②根据反应历程分析,催化剂表面酸碱性对乙苯脱氢反应影响较大,如果催化剂表面碱性太强,会降低乙苯的转化率,碱性太强使乙苯转化率降低的原因是_______ (写一点即可)。
③从资源综合利用角度分析, 氧化乙苯脱氢制苯乙烯的优点是
氧化乙苯脱氢制苯乙烯的优点是_______ 。
主反应:
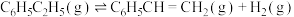
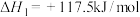 ;
;副反应:
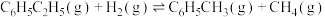
 。
。回答下列问题:
(1)已知,在
 、
、 条件下,
条件下,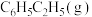 、
、 、
、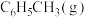 、
、 的燃烧热分别为
的燃烧热分别为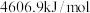 、
、 、
、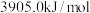 、
、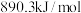 。则
。则
 。
。(2)在某温度、pkPa的条件下,向反应器中充入
 气态乙苯发生主反应:
气态乙苯发生主反应: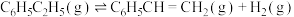 ,其平衡转化率为50%,若向该反应器中充入
,其平衡转化率为50%,若向该反应器中充入 水蒸气作为稀释气(计算时忽略副反应),可将平衡转化率提高至
水蒸气作为稀释气(计算时忽略副反应),可将平衡转化率提高至(3)在不同的温度条件下,以水烃比
 投料,在膜反应器中发生乙苯催化脱氢反应
投料,在膜反应器中发生乙苯催化脱氢反应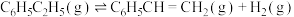 。膜反应器可以通过多孔膜移去
。膜反应器可以通过多孔膜移去 ,提高乙苯的平衡转化率,工作原理如图所示:
,提高乙苯的平衡转化率,工作原理如图所示: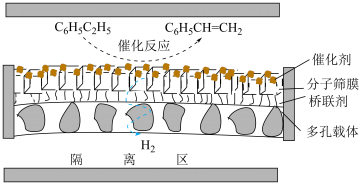
 移出率
移出率
 ×100%。
×100%。①忽略副反应,维持体系总压强p恒定,在温度T时,已知乙苯的平衡转化率为
 ,
, 的移出率为b,则在该温度下主反应的平衡常数
的移出率为b,则在该温度下主反应的平衡常数
 、b、p的代数式表示)。
、b、p的代数式表示)。②乙苯的平衡转化率增长百分数与
 的移出率在不同温度条件下的关系如表所示:
的移出率在不同温度条件下的关系如表所示:| 温度/℃ 增长百分数/%  移出率/% 移出率/% | 700 | 950 | 1000 |
| 60 | 8.43 | 4.38 | 2.77 |
| 80 | 16.8 | 6.1 | 3.8 |
| 90 | 27 | 7.1 | 4.39 |
 的移出率的变化改变程度不大的原因:
的移出率的变化改变程度不大的原因:③下列说法正确的是
A.生成
 的总物质的量与苯乙烯相等
的总物质的量与苯乙烯相等B.因为
 被分离至隔离区,故反应器中不发生副反应
被分离至隔离区,故反应器中不发生副反应C.在恒容的膜反应器中,其他条件不变,增大水烃比,可提高乙苯的转化率
D.当
 的分压不再发生变化时,说明主副反应均达到平衡状态
的分压不再发生变化时,说明主副反应均达到平衡状态(4)有研究者发现,在
 气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图所示:
气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图所示: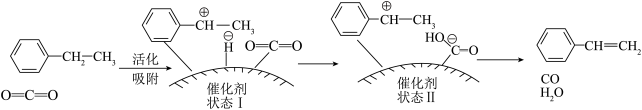
②根据反应历程分析,催化剂表面酸碱性对乙苯脱氢反应影响较大,如果催化剂表面碱性太强,会降低乙苯的转化率,碱性太强使乙苯转化率降低的原因是
③从资源综合利用角度分析,
 氧化乙苯脱氢制苯乙烯的优点是
氧化乙苯脱氢制苯乙烯的优点是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】在100℃时,将0.40 mol二氧化氮气体充入一个1 L抽空的密闭容器中,发生反应:2NO2 N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
(1)在上述条件下,从反应开始至20 s时,用NO2表示的平均反应速率为_____________ 。
(2)该反应的平衡常数K的数值为___________ (精确到0.1)。
(3)若在相同条件下最初向该容器中充入N2O4,要达到上述平衡状态,N2O4的起始浓度是______ mol·L−1。
(4)上述(3)达到平衡后N2O4的转化率为_______ ,混合气体的平均摩尔质量为____________ 。
(5)达到平衡后,如果升高温度,气体颜色会变深,则升高温度后,反应2NO2 N2O4的平衡常数将
N2O4的平衡常数将________ (填“增大”“减小”或“不变”)。
(6)达到平衡后,如果向该密闭容器中再充入0.32 mol He,并把容器体积扩大为4 L,则平衡将_____ (填“向左移动”“向右移动”或“不移动”)。
 N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始至20 s时,用NO2表示的平均反应速率为
(2)该反应的平衡常数K的数值为
(3)若在相同条件下最初向该容器中充入N2O4,要达到上述平衡状态,N2O4的起始浓度是
(4)上述(3)达到平衡后N2O4的转化率为
(5)达到平衡后,如果升高温度,气体颜色会变深,则升高温度后,反应2NO2
 N2O4的平衡常数将
N2O4的平衡常数将(6)达到平衡后,如果向该密闭容器中再充入0.32 mol He,并把容器体积扩大为4 L,则平衡将
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】丙烯是重要的化工原料,其用量仅次于乙烯,研究丙烯的制取工艺具有重要意义。丙烷催化脱氢制取丙烯的过程中涉及的主要反应有:
Ⅰ.

Ⅱ.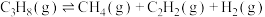
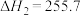 kJ·moL⁻¹
kJ·moL⁻¹
Ⅲ.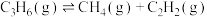
 kJ·moL⁻¹
kJ·moL⁻¹
已知:①温度高于600℃时,C-C键比C-H键更容易断裂;
②平衡状态下:
丙烯选择性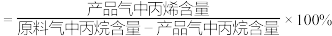
丙烯收率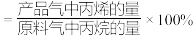
回答下列问题:
(1)下图中能正确表示反应Ⅰ的化学平衡常数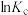 与温度T关系的是
与温度T关系的是_______ (填序号)。
a.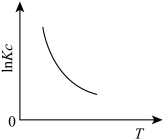 b.
b. 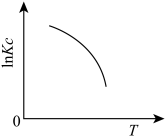 c.
c.  d.
d. 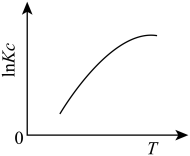
(2)在100kPa的恒压条件下,将1 mol 加入密闭容器中,在催化条件下发生上述反应,实验测得温度对平衡状态下丙烯的选择性和收率的影响如图所示。
加入密闭容器中,在催化条件下发生上述反应,实验测得温度对平衡状态下丙烯的选择性和收率的影响如图所示。
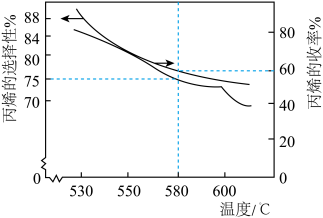
①温度高于600℃时丙烯的选择性降低幅度增大的原因是_______ 。
②580℃,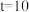 min时,反应体系达到平衡,丙烷的平衡转化率为
min时,反应体系达到平衡,丙烷的平衡转化率为_______ ,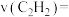
_______ kPa·min⁻¹。反应Ⅰ的压强平衡常数
_______ kPa(用平衡分压代替平衡浓度,平衡分压=总压×体积分数)。
(3)工业上在保持100kPa的恒压条件下,通常在原料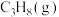 中掺混一定量惰性气体,掺混一定量惰性气体的原理是
中掺混一定量惰性气体,掺混一定量惰性气体的原理是_______ 。
Ⅰ.


Ⅱ.
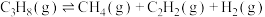
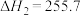 kJ·moL⁻¹
kJ·moL⁻¹Ⅲ.
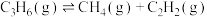
 kJ·moL⁻¹
kJ·moL⁻¹已知:①温度高于600℃时,C-C键比C-H键更容易断裂;
②平衡状态下:
丙烯选择性
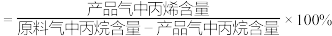
丙烯收率
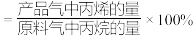
回答下列问题:
(1)下图中能正确表示反应Ⅰ的化学平衡常数
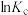 与温度T关系的是
与温度T关系的是a.
 b.
b.  c.
c.  d.
d. 
(2)在100kPa的恒压条件下,将1 mol
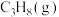 加入密闭容器中,在催化条件下发生上述反应,实验测得温度对平衡状态下丙烯的选择性和收率的影响如图所示。
加入密闭容器中,在催化条件下发生上述反应,实验测得温度对平衡状态下丙烯的选择性和收率的影响如图所示。
①温度高于600℃时丙烯的选择性降低幅度增大的原因是
②580℃,
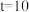 min时,反应体系达到平衡,丙烷的平衡转化率为
min时,反应体系达到平衡,丙烷的平衡转化率为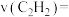

(3)工业上在保持100kPa的恒压条件下,通常在原料
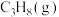 中掺混一定量惰性气体,掺混一定量惰性气体的原理是
中掺混一定量惰性气体,掺混一定量惰性气体的原理是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】天然气的主要成分为 ,一般还含有
,一般还含有 等烃类,是重要的燃料和化工原料。回答下列问题:
等烃类,是重要的燃料和化工原料。回答下列问题:
(1)乙烷在一定条件可发生如下反应: 2L密闭容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为
2L密闭容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为 。反应的平衡常数
。反应的平衡常数
___________ (用物质的量分数代替平衡浓度计算)。
(2)已知反应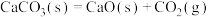
 ,
,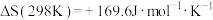 ,则该反应能自发进行的最低温度为
,则该反应能自发进行的最低温度为___________ K(假设反应的焓变与熵变不随温度变化而变化,结果保留整数)。
(3)恒温条件下,在体积可变的密闭容器中发生反应 ,达到平衡时,测得CO、
,达到平衡时,测得CO、 、
、 分别为1mol、1mol、1mol,容器的体积为3L。再往容器中通入3mol CO,此时平衡将
分别为1mol、1mol、1mol,容器的体积为3L。再往容器中通入3mol CO,此时平衡将___________ 移动(填“向右”、“向左”或“不”)。
(4)工业合成氨中制取氢气的原理如下:
Ⅰ:
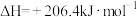
Ⅱ:
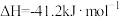
①对于反应Ⅰ,一定可以提高平衡体系中 百分含量,又能加快反应速率的是
百分含量,又能加快反应速率的是___________ (填字母)。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②下列措施可以提高 转化率的是
转化率的是___________ (填字母)。
a.适当升高温度
b.将 从反应体系中分离出来
从反应体系中分离出来
c.保持体积不变充入He,使体系总压强增大
d.按原比例再充入 和
和
(5)乙烯 是重要的化工原料,乙炔
是重要的化工原料,乙炔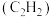 选择性加氢合成乙烯是科学家当前关注的热点。70℃时,反应
选择性加氢合成乙烯是科学家当前关注的热点。70℃时,反应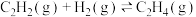
 在刚性容器中达到平衡。
在刚性容器中达到平衡。
①测得在某催化剂上生成乙烯速率方程为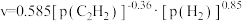 ,
, 一定时,若
一定时,若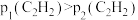 ,则
,则
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②在催化剂作用下,110℃时按体积比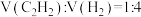 充入刚性容器中,发生反应
充入刚性容器中,发生反应 、
、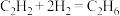 。若乙炔完全反应时,乙烯的体积分数为20%,则
。若乙炔完全反应时,乙烯的体积分数为20%,则 的转化率为
的转化率为___________ , 的选择性为
的选择性为___________ ,( 的选择性=
的选择性=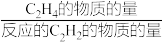 ×100%)
×100%)
 ,一般还含有
,一般还含有 等烃类,是重要的燃料和化工原料。回答下列问题:
等烃类,是重要的燃料和化工原料。回答下列问题:(1)乙烷在一定条件可发生如下反应:
 2L密闭容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为
2L密闭容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为 。反应的平衡常数
。反应的平衡常数
(2)已知反应
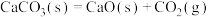
 ,
,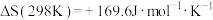 ,则该反应能自发进行的最低温度为
,则该反应能自发进行的最低温度为(3)恒温条件下,在体积可变的密闭容器中发生反应
 ,达到平衡时,测得CO、
,达到平衡时,测得CO、 、
、 分别为1mol、1mol、1mol,容器的体积为3L。再往容器中通入3mol CO,此时平衡将
分别为1mol、1mol、1mol,容器的体积为3L。再往容器中通入3mol CO,此时平衡将(4)工业合成氨中制取氢气的原理如下:
Ⅰ:

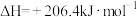
Ⅱ:

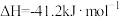
①对于反应Ⅰ,一定可以提高平衡体系中
 百分含量,又能加快反应速率的是
百分含量,又能加快反应速率的是a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②下列措施可以提高
 转化率的是
转化率的是a.适当升高温度
b.将
 从反应体系中分离出来
从反应体系中分离出来c.保持体积不变充入He,使体系总压强增大
d.按原比例再充入
 和
和
(5)乙烯
 是重要的化工原料,乙炔
是重要的化工原料,乙炔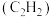 选择性加氢合成乙烯是科学家当前关注的热点。70℃时,反应
选择性加氢合成乙烯是科学家当前关注的热点。70℃时,反应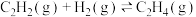
 在刚性容器中达到平衡。
在刚性容器中达到平衡。①测得在某催化剂上生成乙烯速率方程为
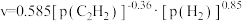 ,
, 一定时,若
一定时,若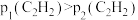 ,则
,则
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②在催化剂作用下,110℃时按体积比
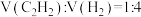 充入刚性容器中,发生反应
充入刚性容器中,发生反应 、
、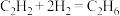 。若乙炔完全反应时,乙烯的体积分数为20%,则
。若乙炔完全反应时,乙烯的体积分数为20%,则 的转化率为
的转化率为 的选择性为
的选择性为 的选择性=
的选择性=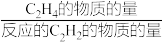 ×100%)
×100%)
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】氢能被视为21世纪最具发展潜力的清洁能源,开发高效储氢材料是氢能利用的重要研究方向。
(1)H3BNH3是一种潜在的储氢材料,其中N原子的价电子轨道表达式为____ 。
(2)制备H3BNH3的化学原料为(HB=NH)3,为六元环状物质,与其互为等电子体的有机物分子式为__ ,CH4、H2O、CO2的键角由大到小的顺序为____ ,B、C、N、O的第一电离能由大到小的顺序为_ 。
(3)C16S8是新型环烯类储氢材料,研究证明其分子呈平面结构(如图所示)。

①C16S8分子中C原子和S原子的杂化轨道类型分别为____ 。
②测得C16S8中碳硫键的键长介于C─S和C=S之间,其原因可能是______ 。
(4)某种铜银合金晶体具有储氢功能,它是面心立方最密堆积结构,Cu原子位于面心,Ag原子位于顶点,H原子可进入由Cu原子和Ag原子构成的四面体空隙中。若将Cu、Ag原子等同看待,该晶体储氢后的晶胞结构与CaF2(如图)相似,该晶体储氢后的化学式为_____ 。

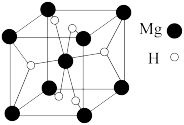
(5)MgH2是金属氢化物储氢材料,其晶胞如图所示,该晶体的密度为 ρ g/cm3,则该晶胞的体积为_____ 。(用含ρ、NA的代数式表示即可)
(1)H3BNH3是一种潜在的储氢材料,其中N原子的价电子轨道表达式为
(2)制备H3BNH3的化学原料为(HB=NH)3,为六元环状物质,与其互为等电子体的有机物分子式为
(3)C16S8是新型环烯类储氢材料,研究证明其分子呈平面结构(如图所示)。

①C16S8分子中C原子和S原子的杂化轨道类型分别为
②测得C16S8中碳硫键的键长介于C─S和C=S之间,其原因可能是
(4)某种铜银合金晶体具有储氢功能,它是面心立方最密堆积结构,Cu原子位于面心,Ag原子位于顶点,H原子可进入由Cu原子和Ag原子构成的四面体空隙中。若将Cu、Ag原子等同看待,该晶体储氢后的晶胞结构与CaF2(如图)相似,该晶体储氢后的化学式为

(5)MgH2是金属氢化物储氢材料,其晶胞如图所示,该晶体的密度为 ρ g/cm3,则该晶胞的体积为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】黄铜矿是工业炼铜的原料,含有的主要元素是硫、铁、铜。请回答下列问题。
(1)Fe2+的电子排布式是____________________________ 。
(2)液态SO2可发生自偶电离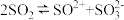 ,SO2属于
,SO2属于_____________ (选填“极性分子”或“非极性分子”), 的空间构型是
的空间构型是___________________ 。
(3)范德华力可分为色散力、诱导力和取向力三类,其中取向力只存在于极性分子和极性分子之间,则H2S的水溶液中存在的取向力有_______ 种。
(4)乙硫醇(C2H5SH)是一种重要的合成中间体,分子中硫原子的杂化形式是____________ 。乙硫醇的沸点比乙醇的沸点低,原因是___________ 。
(5)黄铜矿主要成分X的晶胞结构及晶胞参数如图所示,X的化学式是______________ ,其密度为_____________ g/cm3(阿伏加 德罗常数的值用NA表示)。

(1)Fe2+的电子排布式是
(2)液态SO2可发生自偶电离
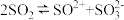 ,SO2属于
,SO2属于 的空间构型是
的空间构型是(3)范德华力可分为色散力、诱导力和取向力三类,其中取向力只存在于极性分子和极性分子之间,则H2S的水溶液中存在的取向力有
(4)乙硫醇(C2H5SH)是一种重要的合成中间体,分子中硫原子的杂化形式是
(5)黄铜矿主要成分X的晶胞结构及晶胞参数如图所示,X的化学式是

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】我国某科研工作者制备了一种高性能的钾离子电池负极材料(Bi-MOF),如图所示。回答下列问题:

(1)铋的原子序数为83,则基态铋原子的外围电子排布图为_______ ,能量最高的电子所占据的原子轨道的电子云轮廓图为_______ 形。
(2)Bi(NO3)3·5H2O中H2O的VSEPR模型为_______ 形; 的立体构型为
的立体构型为_______ 形,H2O的键角_______ (填“>”、“<”或“=”) 的键角。
的键角。
(3)C、N、O的第一电离能由小到大的顺序为_______ ;BTC中C原子的杂化类型有_______ 。
(4)该电池负极材料充电时,会形成钾铋合金(化学式为K3Bi),其晶胞结构如图,晶胞参数为anm、bnm、cnm,以晶胞参数为单位长度建立原子分数坐标,表示晶胞中的原子位置,若1号原子的坐标为(0,0, ),3号原子的坐标为(1,0,
),3号原子的坐标为(1,0, )。
)。

①2号原子的坐标为_______ 。
②设NA为阿伏加德罗常数的值,该晶体的密度为_______ g·cm-3。

(1)铋的原子序数为83,则基态铋原子的外围电子排布图为
(2)Bi(NO3)3·5H2O中H2O的VSEPR模型为
 的立体构型为
的立体构型为 的键角。
的键角。(3)C、N、O的第一电离能由小到大的顺序为
(4)该电池负极材料充电时,会形成钾铋合金(化学式为K3Bi),其晶胞结构如图,晶胞参数为anm、bnm、cnm,以晶胞参数为单位长度建立原子分数坐标,表示晶胞中的原子位置,若1号原子的坐标为(0,0,
 ),3号原子的坐标为(1,0,
),3号原子的坐标为(1,0, )。
)。
①2号原子的坐标为
②设NA为阿伏加德罗常数的值,该晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产、生活中有着广泛的应用。
(1)基态Co原子的价电子排布式为________ ,Co2+核外3d能级上有________ 对成对电子。
(2)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是________ 。1 mol配离子中所含σ键的数目为____________ ,配位体N3-中心原子的杂化类型为____________ 。
(3)Co2+在水溶液中以[Co(H2O)6]2+存在。向含Co2+的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+,其原因是__________________________ 。
(4)某蓝色晶体中,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的某恰当位置上。据此可知该晶体的化学式为________ ,立方体中Fe2+间连接起来形成的空间构型是________ 。
(5)NiO的晶胞结构如图甲所示,其中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为________ 。
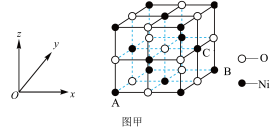
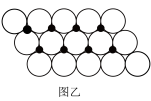
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-为密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为_____ g(用含a、NA的代数式表示)。
(1)基态Co原子的价电子排布式为
(2)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是
(3)Co2+在水溶液中以[Co(H2O)6]2+存在。向含Co2+的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+,其原因是
(4)某蓝色晶体中,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的某恰当位置上。据此可知该晶体的化学式为
(5)NiO的晶胞结构如图甲所示,其中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为

(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-为密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
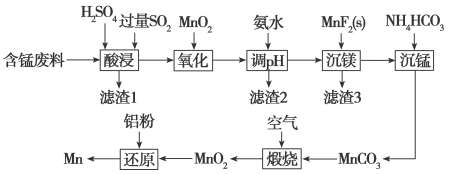
【推荐2】金属锰的用途非常广泛,涉及人类生产生活的方方面面,用含锰废料(主要成分为MnO2,含有少量Al2O3、Fe2O3、MgO、SiO2等)制备锰的流程如下:
已知:Ⅰ.25 ℃时几种难溶物的溶度积常数见下表:
Ⅱ.当溶液中某离子浓度≤10-5mol·L-1时,认为该离子沉淀完全。
回答下列问题:
(1)基态Mn原子的核外电子排布式为___________ ,Mn2+能形成配离子为八面体的配合物MnCl2·nNH3,在该配合物的配离子中,Mn2+位于八面体的中心。若含1 mol该配合物的溶液与足量AgNO3溶液作用可生成1 mol AgCl沉淀,则该配离子化学式为___________ 。比较Fe和Mn的第三电离能,I3(Fe)___________ I3(Mn)(填“大于”或“小于”),原因是___________
(2)“滤渣1”的主要成分为___________ (填化学式)。
(3)写出“酸浸”过程中Fe2O3和SO2反应的化学方程式___________ 。
(4)“氧化”过程中,被MnO2氧化的物质有___________ (写化学式)。
(5)若“调pH”后所得溶液中c(Mn2+)=0.2 mol·L-1,则调pH的范围是4.7≤pH<___________ (保留两位有效数字)。
(6)分别写出“沉镁”和“沉锰”的离子方程式___________ ,___________ 。
(7)生成的MnCO3沉淀需经充分洗涤,检验沉淀是否洗净的方法是___________ 。

已知:Ⅰ.25 ℃时几种难溶物的溶度积常数见下表:
| 难溶物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 | Mn(OH)2 | MnF2 | MgF2 |
| 溶度积(Ksp) | 2.8×10-39 | 1×10-33 | 5.6×10-12 | 2.0×10-13 | 5.3×10-3 | 5.2×10-11 |
回答下列问题:
(1)基态Mn原子的核外电子排布式为
(2)“滤渣1”的主要成分为
(3)写出“酸浸”过程中Fe2O3和SO2反应的化学方程式
(4)“氧化”过程中,被MnO2氧化的物质有
(5)若“调pH”后所得溶液中c(Mn2+)=0.2 mol·L-1,则调pH的范围是4.7≤pH<
(6)分别写出“沉镁”和“沉锰”的离子方程式
(7)生成的MnCO3沉淀需经充分洗涤,检验沉淀是否洗净的方法是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】探究配制不同金属离子—氨配体溶液的差异性,实验操作及现象如下:
资料:①Co(OH)2为浅青色沉淀
②[Co(NH3)6]2+溶液为红色,在活性炭催化下转化为橙黄色的[Co(NH3)6]3+溶液
(1)实验i-a中生成蓝色沉淀的离子方程式为___________ 。
(2)研究认为实验i-a中蓝色沉淀中还有Cu2(OH)2SO4成分,其可以溶于稀酸。检验蓝色沉淀中不止含Cu(OH)2的实验操作为:将蓝色沉淀过滤,充分洗涤后,___________ 。(填后续操作和现象)
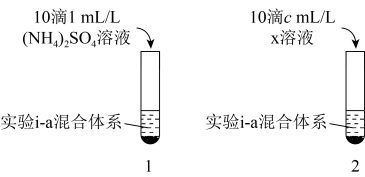
(3)对比实验i-a和实验i-c中再加入过量氨水前的现象,推测NH4+对[Cu(NH3)4]2+生成有一定促进作用。设计如图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测,则x的化学式是___________ ,c=___________ 。___________ 。
(5)针对实验ii未能成功配制[Co(NH3)6]2+溶液,结合以上分析,提出改进方案:
①在实验ii-a的基础上继续加入___________ ,即可成功配制。
②验证配制成功的操作及实验现象是:___________ ;反应的离子方程式为:___________ 。
| 实验序号 | 操作 | 现象 | |
| 实验i:[Cu(NH3)4]2+的配制 | 实验i-a | 在试管内混合CuSO4溶液和NaOH溶液,再加入过量的2mol/LNH3·H2O | 产生蓝色沉淀,加入NH3·H2O后沉淀少部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 |
| 实验i-b | 在试管内混合CuSO4溶液和NaOH溶液,再加入过量的6mol/LNH3·H2O | 产生蓝色沉淀,加入NH3·H2O后沉淀大部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 | |
| 实验i-c | 在试管内混合CuSO4溶液和NH3·H2O溶液,再加入过量的2mol/LNH3·H2O | 产生蓝色沉淀,加入NH3·H2O后沉淀完全溶解,得到澄清的深蓝色溶液。 | |
| 实验ii:[Co(NH3)6]2+的配制 | 实验ii-a | 在试管内混合CoCl2溶液和过量6mol/LNH3·H2O | 得到浅青色沉淀,沉淀未见明显溶解。 |
| 实验ii-b | 在试管内混合CoCl2溶液和过量14mol/LNH3·H2O | 得到浅青色沉淀,沉淀未见明显溶解。 | |
②[Co(NH3)6]2+溶液为红色,在活性炭催化下转化为橙黄色的[Co(NH3)6]3+溶液
(1)实验i-a中生成蓝色沉淀的离子方程式为
(2)研究认为实验i-a中蓝色沉淀中还有Cu2(OH)2SO4成分,其可以溶于稀酸。检验蓝色沉淀中不止含Cu(OH)2的实验操作为:将蓝色沉淀过滤,充分洗涤后,
(3)对比实验i-a和实验i-c中再加入过量氨水前的现象,推测NH4+对[Cu(NH3)4]2+生成有一定促进作用。设计如图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测,则x的化学式是
(5)针对实验ii未能成功配制[Co(NH3)6]2+溶液,结合以上分析,提出改进方案:
①在实验ii-a的基础上继续加入
②验证配制成功的操作及实验现象是:
您最近一年使用:0次



