解题方法
1 . 实验小组探究Cu和 溶液的反应原理。
溶液的反应原理。
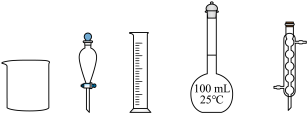
(1)配制溶液
用 标准试剂配制
标准试剂配制 溶液,下列仪器中无需使用的有
溶液,下列仪器中无需使用的有_______ (填名称)。
(2)测定 溶液的pH
溶液的pH
用_______ (填仪器名称)测得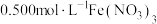 溶液的pH为1.10。
溶液的pH为1.10。
(3)提出假设
假设ⅰ:_______ ,反应的离子方程式为:
假设ⅱ: 将Cu氧化,反应的离子方程式为:
将Cu氧化,反应的离子方程式为:
(4)实验探究
实验Ⅰ:向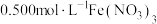 溶液中加入过量铜粉并充分振荡,溶液变成深棕色,无气泡产生。实验小组取少量上层清液于另一洁净试管中,往其中滴加
溶液中加入过量铜粉并充分振荡,溶液变成深棕色,无气泡产生。实验小组取少量上层清液于另一洁净试管中,往其中滴加_______ (填化学式)溶液,观察到_______ 的实验现象,证明了反应中有 生成。
生成。
实验Ⅱ:向pH=1.10的_______ (填化学式)溶液中加入过量铜粉并充分振荡,无明显现象。
探究结论:综合“实验Ⅰ”和“实验Ⅱ”可知,假设_______ (填“ⅰ”或“ⅱ”)成立。
(5)查阅资料知,铜粉与 溶液可能涉及的反应有;
溶液可能涉及的反应有;
反应①: ;
; ;速率很慢。
;速率很慢。
反应②: ;
;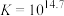 ,速率较快。
,速率较快。
反应③: ;
;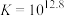 ;速率很快。
;速率很快。
反应④: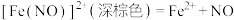
(a)对反应①来说, 起到的作用为
起到的作用为_______ ;为验证这一作用,设计的实验方案为_______ 。
(b)“实验Ⅰ”反应中无论Cu过量多少,始终都能检测到 的存在,原因是
的存在,原因是_______ 。
 溶液的反应原理。
溶液的反应原理。(1)配制溶液
用
 标准试剂配制
标准试剂配制 溶液,下列仪器中无需使用的有
溶液,下列仪器中无需使用的有
(2)测定
 溶液的pH
溶液的pH用
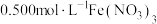 溶液的pH为1.10。
溶液的pH为1.10。(3)提出假设
假设ⅰ:

假设ⅱ:
 将Cu氧化,反应的离子方程式为:
将Cu氧化,反应的离子方程式为:
(4)实验探究
实验Ⅰ:向
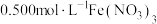 溶液中加入过量铜粉并充分振荡,溶液变成深棕色,无气泡产生。实验小组取少量上层清液于另一洁净试管中,往其中滴加
溶液中加入过量铜粉并充分振荡,溶液变成深棕色,无气泡产生。实验小组取少量上层清液于另一洁净试管中,往其中滴加 生成。
生成。实验Ⅱ:向pH=1.10的
探究结论:综合“实验Ⅰ”和“实验Ⅱ”可知,假设
(5)查阅资料知,铜粉与
 溶液可能涉及的反应有;
溶液可能涉及的反应有;反应①:
 ;
;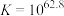 ;速率很慢。
;速率很慢。反应②:
 ;
;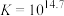 ,速率较快。
,速率较快。反应③:
 ;
;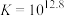 ;速率很快。
;速率很快。反应④:
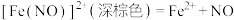
(a)对反应①来说,
 起到的作用为
起到的作用为(b)“实验Ⅰ”反应中无论Cu过量多少,始终都能检测到
 的存在,原因是
的存在,原因是
您最近一年使用:0次
2 . 2021年中国政府工作报告中提出碳中和目标:在2030年前达到最高值,2060年前达到碳中和。因此对二氧化碳的综合利用显得尤为重要。
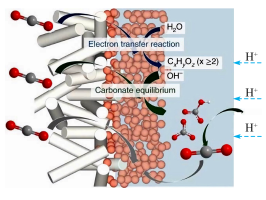

(1)通过电解的方式可实现对二氧化碳的综合利用。2022年7月香港中文大学王莹教授研发新型电解槽实现二氧化碳回收转化效率达到60%以上。转化示意图如图所示,请写出其电极反应方程式:_____ 。
(2)在席夫碱(含“—RC=N—”有机物)修饰的纳米金催化剂上,CO2直接催化加氢成甲酸。其反应历程如图所示,其中吸附在催化剂表面上的物质用*标注。该历程中起决速步骤的化学方程式是_____ 。
(3)通过使用不同新型催化剂,实现二氧化碳加氢合成转化为二甲醚(CH3OCH3)也有广泛的应用。
反应1:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.01KJ/mol
CH3OH(g)+H2O(g) △H=-49.01KJ/mol
反应2:2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-24.52KJ/mol
CH3OCH3(g)+H2O(g) △H=-24.52KJ/mol
反应3:CO2(g)+H2(g) CO(g)+H2O(g) △H=+41.17KJ/mol
CO(g)+H2O(g) △H=+41.17KJ/mol
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H=
CH3OCH3(g)+3H2O(g) △H=_____ KJ/mol
起始压强为4.0MPa、恒压条件下,通入氢气和二氧化碳的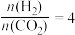 的情况下,不同温度下CO2的平衡转化率和产物的选择性(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)如图所示:
的情况下,不同温度下CO2的平衡转化率和产物的选择性(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)如图所示:
当温度超过290℃,CO2的平衡转化率随温度升高而增大的原因是_____ 。在图中,在200℃时,若经过0.2s该平衡体系即达到平衡。计算CO2分压的平均变化速率为_____ MPa/s;此时对于反应1的Kp=_____ (MPa)-2(计算的表达式)。



(1)通过电解的方式可实现对二氧化碳的综合利用。2022年7月香港中文大学王莹教授研发新型电解槽实现二氧化碳回收转化效率达到60%以上。转化示意图如图所示,请写出其电极反应方程式:
(2)在席夫碱(含“—RC=N—”有机物)修饰的纳米金催化剂上,CO2直接催化加氢成甲酸。其反应历程如图所示,其中吸附在催化剂表面上的物质用*标注。该历程中起决速步骤的化学方程式是
(3)通过使用不同新型催化剂,实现二氧化碳加氢合成转化为二甲醚(CH3OCH3)也有广泛的应用。
反应1:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-49.01KJ/mol
CH3OH(g)+H2O(g) △H=-49.01KJ/mol反应2:2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H=-24.52KJ/mol
CH3OCH3(g)+H2O(g) △H=-24.52KJ/mol反应3:CO2(g)+H2(g)
 CO(g)+H2O(g) △H=+41.17KJ/mol
CO(g)+H2O(g) △H=+41.17KJ/mol2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) △H=
CH3OCH3(g)+3H2O(g) △H=起始压强为4.0MPa、恒压条件下,通入氢气和二氧化碳的
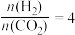 的情况下,不同温度下CO2的平衡转化率和产物的选择性(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)如图所示:
的情况下,不同温度下CO2的平衡转化率和产物的选择性(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)如图所示:当温度超过290℃,CO2的平衡转化率随温度升高而增大的原因是

您最近一年使用:0次
名校
3 .  循环在氢能的贮存/释放、燃料电池等方面具有重要应用。
循环在氢能的贮存/释放、燃料电池等方面具有重要应用。
(1) 催化加氢。在密闭容器中,向含有催化剂的
催化加氢。在密闭容器中,向含有催化剂的 溶液(
溶液( 与KOH溶液反应制得)中通入
与KOH溶液反应制得)中通入 生成
生成 。其他条件不变,
。其他条件不变, 转化为
转化为 的转化率随温度的变化如图所示。反应温度在。40℃~80℃范围内,
的转化率随温度的变化如图所示。反应温度在。40℃~80℃范围内, 催化加氢的转化率迅速上升,其原因可能是
催化加氢的转化率迅速上升,其原因可能是___________ 。

(2)HCOOH燃料电池。研究HCOOH燃料电池性能的装置如图所示,两电极区间用允许 、
、 通过的半透膜隔开。
通过的半透膜隔开。
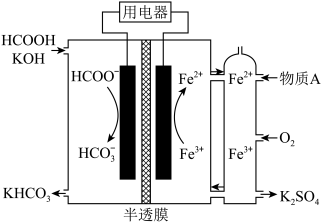
①电池负极电极反应式为___________ :过程中需补充的物质A为___________ (填化学式)。
②每得到1 mol ,理论消耗标准状况下
,理论消耗标准状况下 的体积为
的体积为___________ L。
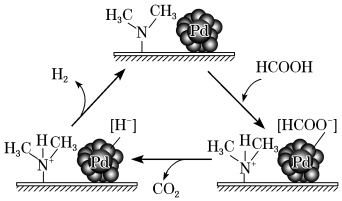
(3)HCOOH催化释氢。在催化剂作用下,HCOOH分解生成 和
和 可能的反应机理如图所示。根据机理,HCOOD催化释氢反应除生成
可能的反应机理如图所示。根据机理,HCOOD催化释氢反应除生成 外,还生成
外,还生成___________ (填化学式)。
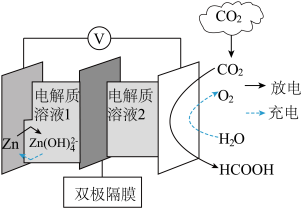
(4)科学家近年发明了一种新型 水介质电池。电池示意图如图,电极为金属锌和选择性催化材料,放电时,温室气体
水介质电池。电池示意图如图,电极为金属锌和选择性催化材料,放电时,温室气体 被转化为储氢物质甲酸等。为解决环境和能源问题提供了一种新途径。
被转化为储氢物质甲酸等。为解决环境和能源问题提供了一种新途径。
①放电时,负极溶液pH___________ 。(填“减小”“增大”或“不变”)
②充电时,电池总反应为___________ 。
 循环在氢能的贮存/释放、燃料电池等方面具有重要应用。
循环在氢能的贮存/释放、燃料电池等方面具有重要应用。(1)
 催化加氢。在密闭容器中,向含有催化剂的
催化加氢。在密闭容器中,向含有催化剂的 溶液(
溶液( 与KOH溶液反应制得)中通入
与KOH溶液反应制得)中通入 生成
生成 。其他条件不变,
。其他条件不变, 转化为
转化为 的转化率随温度的变化如图所示。反应温度在。40℃~80℃范围内,
的转化率随温度的变化如图所示。反应温度在。40℃~80℃范围内, 催化加氢的转化率迅速上升,其原因可能是
催化加氢的转化率迅速上升,其原因可能是
(2)HCOOH燃料电池。研究HCOOH燃料电池性能的装置如图所示,两电极区间用允许
 、
、 通过的半透膜隔开。
通过的半透膜隔开。
①电池负极电极反应式为
②每得到1 mol
 ,理论消耗标准状况下
,理论消耗标准状况下 的体积为
的体积为(3)HCOOH催化释氢。在催化剂作用下,HCOOH分解生成
 和
和 可能的反应机理如图所示。根据机理,HCOOD催化释氢反应除生成
可能的反应机理如图所示。根据机理,HCOOD催化释氢反应除生成 外,还生成
外,还生成
(4)科学家近年发明了一种新型
 水介质电池。电池示意图如图,电极为金属锌和选择性催化材料,放电时,温室气体
水介质电池。电池示意图如图,电极为金属锌和选择性催化材料,放电时,温室气体 被转化为储氢物质甲酸等。为解决环境和能源问题提供了一种新途径。
被转化为储氢物质甲酸等。为解决环境和能源问题提供了一种新途径。①放电时,负极溶液pH
②充电时,电池总反应为

您最近一年使用:0次
解题方法
4 . 一种多功能金属性 催化剂,实现了空气中
催化剂,实现了空气中 的直接捕获和光−热协同催化转化,其机理如图所示,下列说法正确的是
的直接捕获和光−热协同催化转化,其机理如图所示,下列说法正确的是

 催化剂,实现了空气中
催化剂,实现了空气中 的直接捕获和光−热协同催化转化,其机理如图所示,下列说法正确的是
的直接捕获和光−热协同催化转化,其机理如图所示,下列说法正确的是
A. 纳米颗粒表面 纳米颗粒表面 活化为氢原子 活化为氢原子 | B.该过程涉及碳氧双键的断裂与形成 |
C.该过程中的还原产物只有 | D.步骤③中 在 在 表面与 表面与 作用 作用 |
您最近一年使用:0次
2023-12-02更新
|
293次组卷
|
2卷引用:广东省2024届普通高中毕业班高三上学期第二次调研考试化学试题
解题方法
5 . 我国稀土资源丰富,其中二氧化铈( )是一种重要的稀土氧化物,具有吸收强紫外光线的能力,可以用于光催化降解有机污染物,利用氟碳铈矿(主要成分为
)是一种重要的稀土氧化物,具有吸收强紫外光线的能力,可以用于光催化降解有机污染物,利用氟碳铈矿(主要成分为 )制备
)制备 的工艺流程如下:
的工艺流程如下:
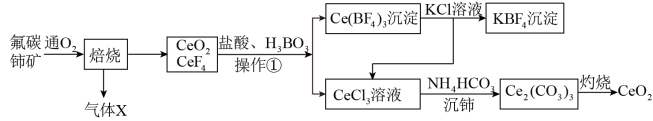
(1) 其中
其中 元素的化合价为
元素的化合价为_______ 。
(2)“焙烧”过程中可以加快反应速率,提高焙烧效率的方法有_______ (写出一种即可)。实验室进行矿石焙烧操作时一般在_______ 进行(填实验仪器名称)。
(3)写出“沉铈”过程中的离子反应方程式_______ 。若“沉铈”中, 恰好沉淀完全[
恰好沉淀完全[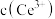 为
为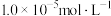 ,此时溶液的
,此时溶液的 为5,则溶液中
为5,则溶液中
_______  (保留2位有效数字)。
(保留2位有效数字)。
已知常温下:
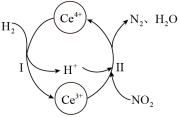
(4) 溶液可以吸收大气中的污染物
溶液可以吸收大气中的污染物 ,减少空气污染,其转化过程如图所示(以
,减少空气污染,其转化过程如图所示(以 为例)。该反应中的催化剂为
为例)。该反应中的催化剂为_______ (写离子符号)
 )是一种重要的稀土氧化物,具有吸收强紫外光线的能力,可以用于光催化降解有机污染物,利用氟碳铈矿(主要成分为
)是一种重要的稀土氧化物,具有吸收强紫外光线的能力,可以用于光催化降解有机污染物,利用氟碳铈矿(主要成分为 )制备
)制备 的工艺流程如下:
的工艺流程如下:
(1)
 其中
其中 元素的化合价为
元素的化合价为(2)“焙烧”过程中可以加快反应速率,提高焙烧效率的方法有
(3)写出“沉铈”过程中的离子反应方程式
 恰好沉淀完全[
恰好沉淀完全[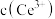 为
为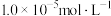 ,此时溶液的
,此时溶液的 为5,则溶液中
为5,则溶液中
 (保留2位有效数字)。
(保留2位有效数字)。已知常温下:
 | 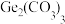 |
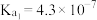 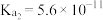 |  |
 溶液可以吸收大气中的污染物
溶液可以吸收大气中的污染物 ,减少空气污染,其转化过程如图所示(以
,减少空气污染,其转化过程如图所示(以 为例)。该反应中的催化剂为
为例)。该反应中的催化剂为
您最近一年使用:0次
名校
解题方法
6 . 2022年诺贝尔化学奖授予在“点击化学和生物正交化学”领域做出贡献的三位科学家。点击化学经典反应之一是:一价铜 催化的叠氮化物-端炔烃环加成反应,反应机理示意如下。
催化的叠氮化物-端炔烃环加成反应,反应机理示意如下。
 催化的叠氮化物-端炔烃环加成反应,反应机理示意如下。
催化的叠氮化物-端炔烃环加成反应,反应机理示意如下。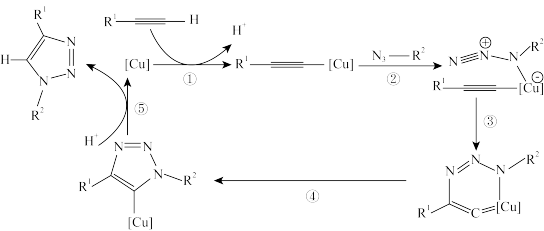
A.第一电离能: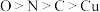 |
| B.反应③过程中,涉及到极性键和非极性键的断裂和形成 |
C.总反应为: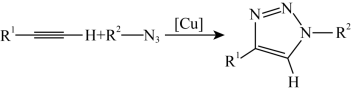 |
D.一价铜 催化剂能有效降低总反应的焓变 催化剂能有效降低总反应的焓变 |
您最近一年使用:0次
2023-05-03更新
|
687次组卷
|
3卷引用:广东省四校2022-2023学年高三下学期“收心考”联考化学试题
名校
解题方法
7 . 一种含P催化剂催化甲烷中的碳氢键活化的反应机理如图所示。下列有关说法不正确的是
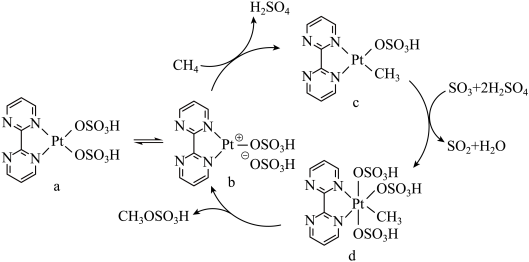

| A.催化循环中Pt的配位数有3种 | B.a中Pt的化合价为+2价 |
| C.c→d发生的是氧化还原反应 | D.SO2与SO3的VSEPR模型名称不同 |
您最近一年使用:0次
2023-03-31更新
|
1434次组卷
|
5卷引用:2023年广东省普通高中学业水平选择考模拟测试(一)化学试题
2023年广东省普通高中学业水平选择考模拟测试(一)化学试题(已下线)专题08 化学反应中的能量变化(已下线)专题09 氧化还原反应江西省宜春市上高中学2022-2023学年高二下学期5月期中化学试题(已下线)题型06 反应热的判断及计算-2024年高考化学答题技巧与模板构建
8 . 三元催化剂能同时实现汽车尾气中的CO、 、
、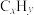 三种成分的净化,其催化剂表面物质转化的关系如图1所示。化合物X可借助红外光谱(如图2所示)确定。
三种成分的净化,其催化剂表面物质转化的关系如图1所示。化合物X可借助红外光谱(如图2所示)确定。

下列叙述错误的是
 、
、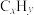 三种成分的净化,其催化剂表面物质转化的关系如图1所示。化合物X可借助红外光谱(如图2所示)确定。
三种成分的净化,其催化剂表面物质转化的关系如图1所示。化合物X可借助红外光谱(如图2所示)确定。
下列叙述错误的是
| A.加装三元催化设备可减少对大气的污染 |
| B.三元催化剂可改变汽车尾气中CO的燃烧热 |
| C.该机理涉及的反应均为氧化还原反应 |
D.化合物X可能是 |
您最近一年使用:0次
名校
解题方法
9 . 汽车尾气(用N2O表示)是空气污染源之一,回答下列问题:
(1)用CO还原N2O的能量变化如图甲所示,则该反应的热化学方程式为_______ 。

在相同温度和压强下,1molN2O和1molCO经过相同反应时间(t秒)测得如下实验数据:
实验Ⅰ中,使用催化剂1时,N2O的平均反应速率为_______  ;在相同温度时,催化剂2催化下N2O的转化率更高的原因是
;在相同温度时,催化剂2催化下N2O的转化率更高的原因是_______ 。
(2)在容积均为1L的密闭容器A(起始500℃,恒温)、B(起始500℃,绝热)两个容器中分别加入0.1molN2O、0.4molCO和相同催化剂。实验测得A、B容器中N2O的转化率随时间的变化关系如图乙所示。

①B容器中N2O的转化率随时间的变化关系是图乙中的_______ 曲线。
②要缩短b曲线对应容器达到平衡的时间,但不改变N2O的平衡转化率,在催化剂一定的情况下可采取的措施是_______ (答出1点即可)。
③500℃该反应的化学平衡常数K=_______ (用分数表示)。
④实验测定该反应的反应速率v正=k正·c(N2O)·c(CO),v逆=k逆·c(N2)·c(CO2),k正、k逆分别是正、逆反应速率常数,c为物质的量浓度。计算M处的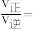
_______ (保留两位小数)。
(1)用CO还原N2O的能量变化如图甲所示,则该反应的热化学方程式为

在相同温度和压强下,1molN2O和1molCO经过相同反应时间(t秒)测得如下实验数据:
| 实验 | 温度/℃ | 催化剂 | N2O转化率/% |
| 实验Ⅰ | 400 | 催化剂1 | 9.5 |
| 400 | 催化剂2 | 10.6 | |
| 实验Ⅱ | 500 | 催化剂1 | 12.3 |
| 500 | 催化剂2 | 13.5 |
 ;在相同温度时,催化剂2催化下N2O的转化率更高的原因是
;在相同温度时,催化剂2催化下N2O的转化率更高的原因是(2)在容积均为1L的密闭容器A(起始500℃,恒温)、B(起始500℃,绝热)两个容器中分别加入0.1molN2O、0.4molCO和相同催化剂。实验测得A、B容器中N2O的转化率随时间的变化关系如图乙所示。

①B容器中N2O的转化率随时间的变化关系是图乙中的
②要缩短b曲线对应容器达到平衡的时间,但不改变N2O的平衡转化率,在催化剂一定的情况下可采取的措施是
③500℃该反应的化学平衡常数K=
④实验测定该反应的反应速率v正=k正·c(N2O)·c(CO),v逆=k逆·c(N2)·c(CO2),k正、k逆分别是正、逆反应速率常数,c为物质的量浓度。计算M处的
您最近一年使用:0次
2021·江西南昌·模拟预测
名校
10 . 三甲胺N(CH3)3是重要的化工原料。我国科学家实现了在铜催化剂条件下将N,N-二甲基甲酰胺[(CH3)2NCHO,简称DMF]转化为三甲胺[N(CH3)3]。计算机模拟单个DMF分子在铜催化剂表面的反应历程如图所示(*表示物质吸附在铜催化剂上),下列说法正确的是
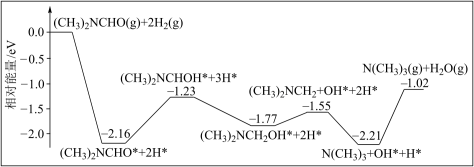

A.该历程中决速步骤为 |
| B.该历程中的最大能垒(活化能)为2.16eV |
| C.升高温度可以加快反应速率,并提高DMF的平衡转化率 |
| D.若1molDMF完全转化为三甲胺,则会释放出1.02eV·NA的能量 |
您最近一年使用:0次
2021-09-06更新
|
2679次组卷
|
17卷引用:2023年广东卷高考真题变式题(选择题11-16)
(已下线)2023年广东卷高考真题变式题(选择题11-16)广东省广州市第五中学2021-2022学年高三上学期11月测试化学试题浙江省宁波市北仑中学2023-2024学年高二上学期期中考试化学试题(已下线)选择题11-16江西省南昌市2022届高三摸底考试化学试题山东省烟台市莱州第一中学2021-2022学年高二上学期10月月考化学试题河南省洛阳市豫西名校2021-2022学年高二上学期第一次联考化学试题福建省三明市教研联盟校2021-2022学年高二上学期期中联考化学试题湖南省天壹名校联盟.宁乡市2021-2022学年高三11月调研考试化学试题浙江省杭州学军中学2021-2022学年高三上学期12月适应性考试化学试题(已下线)提升卷01-【新高考新题型】2022年高考化学选择题标准化练习20卷(山东专用)河南省商城县观庙高级中学2021-2022学年高三上学期12月月考化学试题湖南省长沙市宁乡市2021-2022学年高三11月调研考试化学试题安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题辽宁省实验中学2021-2022学年高一下学期期中阶段测试化学试题江西省景德镇一中2021-2022学年高一下学期期中质量检测(17)班化学试题安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题



