绿色能源是未来能源发展的方向,积极发展氢能,是实现“碳达峰、碳中和”的重要举措。回答下列问题:
(1)通过生物柴油副产物甘油制取H2正成为绿色能源的一个重要研究方向。生物甘油水蒸气重整制氢的主要反应如下(K1、K2分别为反应I、Ⅱ的化学平衡常数):
I.C3H8O3(g)⇌3CO(g)+4H2(g) ΔH1=+251kJ·mol-1 K1
Ⅱ.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2=-41kJ·mol-1 K2
重整总反应C3H8O3(g)+3H2O(g)⇌3CO2(g)+7H2(g)的ΔH3=_________ ,平衡常数K3=_________ 。(用含K1、K2的计算式表示)
(2)大量研究表明Pt12Ni、Sn12Ni、Cu12Ni三种双金属合金团簇均可用于催化DRM反应(CH4+CO2⇌2CO+2H2),在催化剂表面涉及多个基元反应,其中甲烷逐步脱氢过程的能量变化如图甲所示(吸附在催化剂表面上的物种用*标注,TS1、TS2、TS3、TS4分别表示过渡态1、过渡态2、过渡态3、过渡态4)。
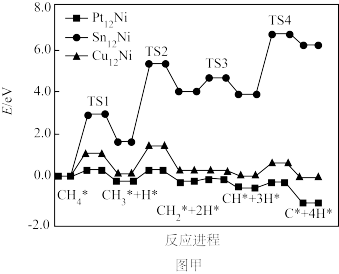
①Pt12Ni、Sn12Ni、Cu12Ni催化甲烷逐步脱氢过程的速率分别为v1、v2、v3,则脱氢过程的速率由小到大的关系为___________ 。
②甲烷逐步脱氢过程中,决定速率快慢的反应步骤是:___________ (用化学方程式表示)。
(3)甲烷干法重整制H2的过程为反应a:CH4+CO2⇌2CO+2H2,同时发生副反应b:CO2+H2⇌CO+H2O,T℃时,在恒压容器中,通入2molCH4和2molCO2发生上述反应,总压强为P0,平衡时甲烷的转化率为40%,H2O的分压为P,则反应a的压强平衡常数Kp=___________ (用含P和P0的计算式表示,已知分压=总压×物质的量分数)。
(4)甲烷裂解制氢的反应为CH4(g)=C(s)+2H2(g) ΔH=+75kJ·mol-1,Ni可作该反应的催化剂,CH4在催化剂孔道表面反应时,若孔道堵塞会导致催化剂失活。其他条件相同时,随时间增加,温度对Ni催化剂催化效果的影响如图乙所示。考虑综合因素,使用催化剂的最佳温度为___________ ;650℃条件下,1000s后,氢气的体积分数快速下降的原因是___________ 。

(1)通过生物柴油副产物甘油制取H2正成为绿色能源的一个重要研究方向。生物甘油水蒸气重整制氢的主要反应如下(K1、K2分别为反应I、Ⅱ的化学平衡常数):
I.C3H8O3(g)⇌3CO(g)+4H2(g) ΔH1=+251kJ·mol-1 K1
Ⅱ.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2=-41kJ·mol-1 K2
重整总反应C3H8O3(g)+3H2O(g)⇌3CO2(g)+7H2(g)的ΔH3=
(2)大量研究表明Pt12Ni、Sn12Ni、Cu12Ni三种双金属合金团簇均可用于催化DRM反应(CH4+CO2⇌2CO+2H2),在催化剂表面涉及多个基元反应,其中甲烷逐步脱氢过程的能量变化如图甲所示(吸附在催化剂表面上的物种用*标注,TS1、TS2、TS3、TS4分别表示过渡态1、过渡态2、过渡态3、过渡态4)。

①Pt12Ni、Sn12Ni、Cu12Ni催化甲烷逐步脱氢过程的速率分别为v1、v2、v3,则脱氢过程的速率由小到大的关系为
②甲烷逐步脱氢过程中,决定速率快慢的反应步骤是:
(3)甲烷干法重整制H2的过程为反应a:CH4+CO2⇌2CO+2H2,同时发生副反应b:CO2+H2⇌CO+H2O,T℃时,在恒压容器中,通入2molCH4和2molCO2发生上述反应,总压强为P0,平衡时甲烷的转化率为40%,H2O的分压为P,则反应a的压强平衡常数Kp=
(4)甲烷裂解制氢的反应为CH4(g)=C(s)+2H2(g) ΔH=+75kJ·mol-1,Ni可作该反应的催化剂,CH4在催化剂孔道表面反应时,若孔道堵塞会导致催化剂失活。其他条件相同时,随时间增加,温度对Ni催化剂催化效果的影响如图乙所示。考虑综合因素,使用催化剂的最佳温度为

2023高三·全国·专题练习 查看更多[1]
(已下线)化学平衡常数及其计算
更新时间:2023-12-22 11:21:18
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】甲酸在有机化工中有广泛的用途,工业上可有多种途径来制备甲酸。回答下列问题:
(1)利用光催化制甲酸原理如图所示。
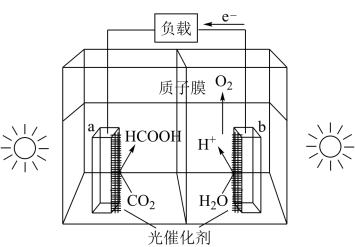
该装置能量转化方式为___ 。
(2)另一种以Ru化合物为催化剂,用H2和CO2制取甲酸的反应机理如下:
第一步:Ru(OH)2+2H2⇌RuH2+2H2O 快速平衡
第二步:RuH2+2CO2→Ru(OOCH)2慢反应(近似认为不影响第一步反应的平衡)
第三步:Ru(OOCH)2+2H2O→2HCOOH+Ru(OH)2快反应
下列表述正确的是___ (填序号)。
A.平衡时v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有Ru(OOCH)2
C.第二步反应中RuH2与CO2的碰撞仅部分有效
D.第三步反应的活化能较低
(3)CO2加氢也可制备甲酸(HCOOH)。
①工业上利用甲酸的能量关系转换图如图:
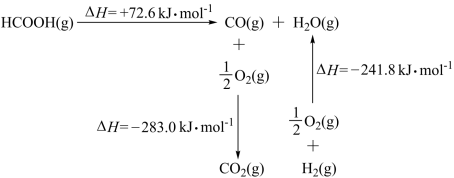
反应CO2(g)+H2(g) ⇌ HCOOH(g)的焓变△H=___ kJ·mol-1。
②温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g) ⇌ HCOOH(g) K=2
实验测得:v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=___ (以k正表示)。
③当温度改变为T2℃时,k正=1.9k逆,则T2℃时平衡压强___ T1℃时平衡压强(填“>”“<”或“=”),理由是___ 。
(4)甲酸是唯一能和烯烃发生加成反应的羧酸,目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。
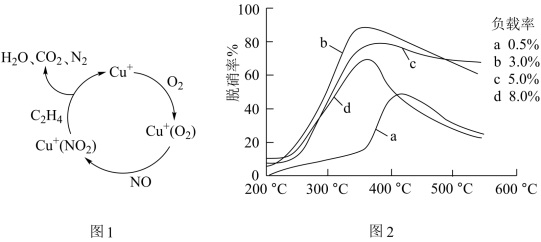
①写出该脱硝原理总反应的化学方程式:___ 。
②为达到最佳脱硝效果,应采取的条件是___ 。
(5)T℃,甲酸与醋酸钠溶液反应:HCOOH+CH3COO- ⇌HCOO-+CH3COOH,该反应的平衡常数为12.5,则该温度下醋酸的电离常数Ka(CH3COOH)=___ (T℃时甲酸的电离常数为2×10-4)。
(1)利用光催化制甲酸原理如图所示。

该装置能量转化方式为
(2)另一种以Ru化合物为催化剂,用H2和CO2制取甲酸的反应机理如下:
第一步:Ru(OH)2+2H2⇌RuH2+2H2O 快速平衡
第二步:RuH2+2CO2→Ru(OOCH)2慢反应(近似认为不影响第一步反应的平衡)
第三步:Ru(OOCH)2+2H2O→2HCOOH+Ru(OH)2快反应
下列表述正确的是
A.平衡时v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有Ru(OOCH)2
C.第二步反应中RuH2与CO2的碰撞仅部分有效
D.第三步反应的活化能较低
(3)CO2加氢也可制备甲酸(HCOOH)。
①工业上利用甲酸的能量关系转换图如图:

反应CO2(g)+H2(g) ⇌ HCOOH(g)的焓变△H=
②温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g) ⇌ HCOOH(g) K=2
实验测得:v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=
③当温度改变为T2℃时,k正=1.9k逆,则T2℃时平衡压强
(4)甲酸是唯一能和烯烃发生加成反应的羧酸,目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。

①写出该脱硝原理总反应的化学方程式:
②为达到最佳脱硝效果,应采取的条件是
(5)T℃,甲酸与醋酸钠溶液反应:HCOOH+CH3COO- ⇌HCOO-+CH3COOH,该反应的平衡常数为12.5,则该温度下醋酸的电离常数Ka(CH3COOH)=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】氢气是一种重要的工业原料和清洁能源,可用作合成氨、合成甲醇、合成盐酸的原料,冶金用还原剂等。
(1)已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.2 kJ·mol−1。
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247.4 kJ·mol−1
则反应CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=_______ kJ·mol−1。
(2)工业合成氨的反应原理为N2(g)+3H2(g) 2NH3(g) ΔH=−92.4 kJ·mol−1。
2NH3(g) ΔH=−92.4 kJ·mol−1。
①该反应中的H2制取成本较高,工业生产中往往追求H2的转化率。增大H2的平衡转化率的措施有_______ (填字母代号)。
a.增大压强
b.升高温度
c.增大N2浓度
d.及时移走生成物NH3
e.使用高效催化剂
②升高温度,该可逆反应的平衡常数K__________ (填“增大”“不变”或“减小”)。
③某温度下,把10 mol N2与28 mol H2置于容积为10 L的恒容密闭容器内,10 min时反应达到平衡状态,测得平均速率v(NH3)=0.12 mol·L−1·min−1,H2的平衡转化率为_______ (保留三位有效数字),则该温度下反应的平衡常数K=_______ 。
(3)下图所示装置工作时均与H2有关。
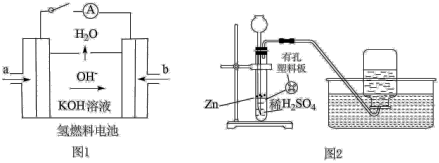
①图l所示装置,通入H2的管口是______ (填字母),正极反应式为___________________ 。
②图2是实验室制备H2的实验装置,在漏斗中加入1 mL CuSO4溶液,可观察到气泡生成速率明显加快,原因是_____________________ ,若反应装置中硫酸过量,则加入CuSO4溶液后,生成的氢气量__________ (填“增大”“不变”或“减小”)。
(1)已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.2 kJ·mol−1。
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247.4 kJ·mol−1
则反应CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=
(2)工业合成氨的反应原理为N2(g)+3H2(g)
 2NH3(g) ΔH=−92.4 kJ·mol−1。
2NH3(g) ΔH=−92.4 kJ·mol−1。①该反应中的H2制取成本较高,工业生产中往往追求H2的转化率。增大H2的平衡转化率的措施有
a.增大压强
b.升高温度
c.增大N2浓度
d.及时移走生成物NH3
e.使用高效催化剂
②升高温度,该可逆反应的平衡常数K
③某温度下,把10 mol N2与28 mol H2置于容积为10 L的恒容密闭容器内,10 min时反应达到平衡状态,测得平均速率v(NH3)=0.12 mol·L−1·min−1,H2的平衡转化率为
(3)下图所示装置工作时均与H2有关。

①图l所示装置,通入H2的管口是
②图2是实验室制备H2的实验装置,在漏斗中加入1 mL CuSO4溶液,可观察到气泡生成速率明显加快,原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】氢能是一种重要能源,氢气的制备与储存是研究热点。
Ⅰ.一种电热化学循环制氢的方法如图所示。熔融电解质成分为 。
。

(1)500℃时, 能与熔融电解质发生反应:
能与熔融电解质发生反应: +CO2↑,“电化学还原”步骤中,阴极的电极反应式为
+CO2↑,“电化学还原”步骤中,阴极的电极反应式为___________ 。
Ⅱ.储氢的研究包括材料吸氢和脱氢的过程。 和
和 都是氢容量(单位质量储氢材料储存
都是氢容量(单位质量储氢材料储存 的质量)较大的储氢材料。
的质量)较大的储氢材料。
(2) 、
、 及两者混合制成的复合储氢材料脱氢反应的热化学方程式如下:
及两者混合制成的复合储氢材料脱氢反应的热化学方程式如下:



① 的原因是
的原因是___________ 。
②储氢材料脱氢的能量变化如图所示。三种材料中脱氢焓[ (脱氢)]最小的是
(脱氢)]最小的是___________ (填“ ”、“
”、“ ”或“复合储氢材料”)。
”或“复合储氢材料”)。

(3)Ti元素有+2、+3、+4等多种价态。向 中添加适量Ti元素后可以加快其释放
中添加适量Ti元素后可以加快其释放 的速率,其机理示意图如图所示。
的速率,其机理示意图如图所示。

①图中 表示的微粒是
表示的微粒是___________ (用微粒符号表示)。
② 释放
释放 速率加快的机理可描述为:
速率加快的机理可描述为:___________ 、 、
、___________ (用方程式表示反应机理)。
Ⅰ.一种电热化学循环制氢的方法如图所示。熔融电解质成分为
 。
。
(1)500℃时,
 能与熔融电解质发生反应:
能与熔融电解质发生反应: +CO2↑,“电化学还原”步骤中,阴极的电极反应式为
+CO2↑,“电化学还原”步骤中,阴极的电极反应式为Ⅱ.储氢的研究包括材料吸氢和脱氢的过程。
 和
和 都是氢容量(单位质量储氢材料储存
都是氢容量(单位质量储氢材料储存 的质量)较大的储氢材料。
的质量)较大的储氢材料。(2)
 、
、 及两者混合制成的复合储氢材料脱氢反应的热化学方程式如下:
及两者混合制成的复合储氢材料脱氢反应的热化学方程式如下:


①
 的原因是
的原因是②储氢材料脱氢的能量变化如图所示。三种材料中脱氢焓[
 (脱氢)]最小的是
(脱氢)]最小的是 ”、“
”、“ ”或“复合储氢材料”)。
”或“复合储氢材料”)。
(3)Ti元素有+2、+3、+4等多种价态。向
 中添加适量Ti元素后可以加快其释放
中添加适量Ti元素后可以加快其释放 的速率,其机理示意图如图所示。
的速率,其机理示意图如图所示。
①图中
 表示的微粒是
表示的微粒是②
 释放
释放 速率加快的机理可描述为:
速率加快的机理可描述为: 、
、
您最近一年使用:0次
【推荐1】甲醛释氢对氢能源和含甲醛污水处理有重要意义。
(1)HCHO电催化释氢
催化电解含较低浓度的HCHO、NaOH混合溶液,可获得 与HCOONa(如图所示),其中电极b表面覆盖一种Mo与P形成的化合物(晶胞结构如图所示)作催化剂。
与HCOONa(如图所示),其中电极b表面覆盖一种Mo与P形成的化合物(晶胞结构如图所示)作催化剂。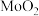 与
与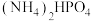 混合物与
混合物与 高温灼烧制得(反应中N元素化合价不变),该反应的化学方程式为
高温灼烧制得(反应中N元素化合价不变),该反应的化学方程式为_________________ 。
②电解时,电极b上同时产生 与
与 的物质的量之比为1∶2,则电极b上的电极反应式为
的物质的量之比为1∶2,则电极b上的电极反应式为_____________ 。
③电解过程中每产生1 mol ,通过阴离子交换膜的
,通过阴离子交换膜的 为
为______ mol。
(2)HCHO水化释氢
45℃时,碱性条件下Ag作催化剂可将甲醛转化为 ,反应的机理如图所示。
,反应的机理如图所示。 表面以防止纳米Ag团聚。其他条件不变,反应相同时间,NaOH浓度对氢气产生快慢的影响如图所示。
表面以防止纳米Ag团聚。其他条件不变,反应相同时间,NaOH浓度对氢气产生快慢的影响如图所示。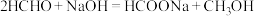 。
。
①若将甲醛中的氢用D原子标记为DCDO,得到的氢气产物为_______ (填化学式)。
②NaOH浓度低于1 mol⋅L 时,NaOH浓度增大产生氢气会加快的原因是
时,NaOH浓度增大产生氢气会加快的原因是__________ 。
③若NaOH浓度过大, 的产生迅速减慢的原因可能是
的产生迅速减慢的原因可能是__________________ 。
(3)甲烷与水在催化剂作用下可产生氢气与碳氧化物,与甲烷水化法制氢气相比,甲醛制氢的优点有______________ 。
(1)HCHO电催化释氢
催化电解含较低浓度的HCHO、NaOH混合溶液,可获得
 与HCOONa(如图所示),其中电极b表面覆盖一种Mo与P形成的化合物(晶胞结构如图所示)作催化剂。
与HCOONa(如图所示),其中电极b表面覆盖一种Mo与P形成的化合物(晶胞结构如图所示)作催化剂。
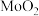 与
与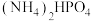 混合物与
混合物与 高温灼烧制得(反应中N元素化合价不变),该反应的化学方程式为
高温灼烧制得(反应中N元素化合价不变),该反应的化学方程式为②电解时,电极b上同时产生
 与
与 的物质的量之比为1∶2,则电极b上的电极反应式为
的物质的量之比为1∶2,则电极b上的电极反应式为③电解过程中每产生1 mol
 ,通过阴离子交换膜的
,通过阴离子交换膜的 为
为(2)HCHO水化释氢
45℃时,碱性条件下Ag作催化剂可将甲醛转化为
 ,反应的机理如图所示。
,反应的机理如图所示。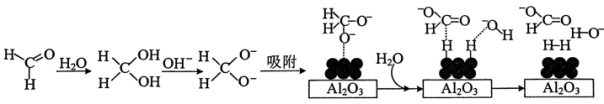
 表面以防止纳米Ag团聚。其他条件不变,反应相同时间,NaOH浓度对氢气产生快慢的影响如图所示。
表面以防止纳米Ag团聚。其他条件不变,反应相同时间,NaOH浓度对氢气产生快慢的影响如图所示。
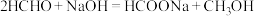 。
。①若将甲醛中的氢用D原子标记为DCDO,得到的氢气产物为
②NaOH浓度低于1 mol⋅L
 时,NaOH浓度增大产生氢气会加快的原因是
时,NaOH浓度增大产生氢气会加快的原因是③若NaOH浓度过大,
 的产生迅速减慢的原因可能是
的产生迅速减慢的原因可能是(3)甲烷与水在催化剂作用下可产生氢气与碳氧化物,与甲烷水化法制氢气相比,甲醛制氢的优点有
您最近一年使用:0次
【推荐2】锂电池有广阔的应用前景。用“循环电沉积”法处理某种锂电池,可使其中的Li电极表面生成只允许 通过的
通过的 和C保护层,工作原理如图1,具体操作如下。
和C保护层,工作原理如图1,具体操作如下。
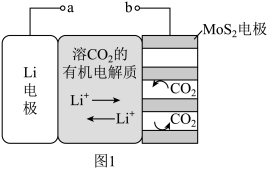
i.将表面洁净的Li电极和 电极浸在溶有
电极浸在溶有 的有机电解质溶液中。
的有机电解质溶液中。
ii.0-5min,a端连接电源正极,b端连接电源负极,电解, 电极上生成
电极上生成 和C。
和C。
iii.5-10min,a端连接电源负极,b端连接电源正极,电解, 电极上消耗
电极上消耗 和C,Li电极上生成
和C,Li电极上生成 和C,步骤ⅱ和步骤iii为1个电沉积循环。
和C,步骤ⅱ和步骤iii为1个电沉积循环。
iv.重复步骤ⅱ和步骤ⅲ的操作,继续完成9个电沉积循环。
(1)步骤ii内电路中的 由
由_______ 向_______ 迁移(填“Li电极”或“ 电极”)。
电极”)。
(2)已知下列反应的热化学方程式。
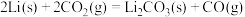


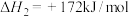
步骤ⅱ电解总反应的热化学方程式为_______ 。
(3)步骤ⅲ中,Li电极的电极反应式为_______ 。
(4) 和C只有在
和C只有在 的催化作用下才能发生步骤ⅲ的电极反应,反应历程中的能量变化如下图。下列说法正确的是
的催化作用下才能发生步骤ⅲ的电极反应,反应历程中的能量变化如下图。下列说法正确的是_______ (填字母序号)。
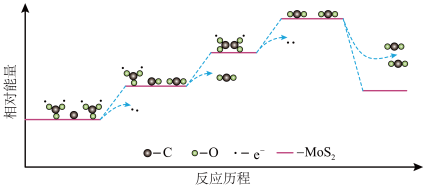
a.反应历程中存在碳氧键的断裂和形成
b.反应历程中涉及电子转移的变化均释放能量
c. 催化剂通过降低电极反应的活化能使反应速率加快
催化剂通过降低电极反应的活化能使反应速率加快
 通过的
通过的 和C保护层,工作原理如图1,具体操作如下。
和C保护层,工作原理如图1,具体操作如下。
i.将表面洁净的Li电极和
 电极浸在溶有
电极浸在溶有 的有机电解质溶液中。
的有机电解质溶液中。ii.0-5min,a端连接电源正极,b端连接电源负极,电解,
 电极上生成
电极上生成 和C。
和C。iii.5-10min,a端连接电源负极,b端连接电源正极,电解,
 电极上消耗
电极上消耗 和C,Li电极上生成
和C,Li电极上生成 和C,步骤ⅱ和步骤iii为1个电沉积循环。
和C,步骤ⅱ和步骤iii为1个电沉积循环。iv.重复步骤ⅱ和步骤ⅲ的操作,继续完成9个电沉积循环。
(1)步骤ii内电路中的
 由
由 电极”)。
电极”)。(2)已知下列反应的热化学方程式。
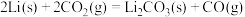


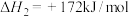
步骤ⅱ电解总反应的热化学方程式为
(3)步骤ⅲ中,Li电极的电极反应式为
(4)
 和C只有在
和C只有在 的催化作用下才能发生步骤ⅲ的电极反应,反应历程中的能量变化如下图。下列说法正确的是
的催化作用下才能发生步骤ⅲ的电极反应,反应历程中的能量变化如下图。下列说法正确的是
a.反应历程中存在碳氧键的断裂和形成
b.反应历程中涉及电子转移的变化均释放能量
c.
 催化剂通过降低电极反应的活化能使反应速率加快
催化剂通过降低电极反应的活化能使反应速率加快
您最近一年使用:0次
【推荐3】我国对世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和,而研发CO2的碳捕捉和碳利用技术则是关键。
(1)大气中的CO2主要来自于煤、石油及其他含碳化合物的燃烧,CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
①CH4(g) C(s)+2H2(g) ΔH1=akJ•mol-1
C(s)+2H2(g) ΔH1=akJ•mol-1
②CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=bkJ•mol-1
CO(g)+H2O(g) ΔH2=bkJ•mol-1
③2CO(g) CO2(g)+C(s) ΔH3=ckJ•mol-1
CO2(g)+C(s) ΔH3=ckJ•mol-1
反应CH4(g)+CO2(g) 2CO(g)+2H2(g)的ΔH=
2CO(g)+2H2(g)的ΔH=____ kJ•mol-1。
(2)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。如图1所示,电解装置中分别以多晶Cu和Pt为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后KHCO3浓度基本保持不变,温度控制在10℃左右。生成C2H4的电极反应式为_____ 。

(3)CO2的电化学催化还原具有条件温和、对环境友好的优点。Cu对CO2的电还原有一定的催化作用。在0.1mol•L-1CuSO4/H2SO4溶液中,改变沉积时间,进行恒电位沉积制备纳米Cu电极。图2是根据不同沉积时间制备的纳米Cu电极的循环伏安曲线作出的CO2的还原峰电流(峰电流越大,表明纳米Cu电极催化效果越好)与沉积时间的关系图,沉积时间超过50s,进一步延长沉积时间,纳米Cu电极催化效果减弱的原因是____ 。

(4)常温下,以NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。用1LNa2CO3溶液将2.33gBaSO4固体全都转化为BaCO3,再过滤,所用的Na2CO3溶液的物质的量浓度至少为____ mol•L-1。
[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10;忽略溶液体积变化]
(5)章根强课题组通过温和的自光刻技术制备出富含氧空位的Co(CO3)0.5(OH)•0.11H2O纳米线(用CoⅡ表示),测试结果表明,该CoⅡ在可见光下具有优异的光催化CO2还原活性。分析表明,该CO2还原催化机理为典型的CoⅡ/CoI反应路径(如图3)。首先,光敏剂([Ru(bpy)3]2+)通过可见光照射被激发到激发态([Ru(bpy)3]2+*),随后([Ru(bpy)3]2+*)被TEOA淬灭得到([Ru(bpy)3]+)还原物种,该还原物种将向CoⅡ供激发电子将CoⅡ还原为CoI,_____ 。(结合图示,描述CO2还原为CO的过程)

(1)大气中的CO2主要来自于煤、石油及其他含碳化合物的燃烧,CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
①CH4(g)
 C(s)+2H2(g) ΔH1=akJ•mol-1
C(s)+2H2(g) ΔH1=akJ•mol-1②CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=bkJ•mol-1
CO(g)+H2O(g) ΔH2=bkJ•mol-1③2CO(g)
 CO2(g)+C(s) ΔH3=ckJ•mol-1
CO2(g)+C(s) ΔH3=ckJ•mol-1反应CH4(g)+CO2(g)
 2CO(g)+2H2(g)的ΔH=
2CO(g)+2H2(g)的ΔH=(2)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。如图1所示,电解装置中分别以多晶Cu和Pt为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后KHCO3浓度基本保持不变,温度控制在10℃左右。生成C2H4的电极反应式为

(3)CO2的电化学催化还原具有条件温和、对环境友好的优点。Cu对CO2的电还原有一定的催化作用。在0.1mol•L-1CuSO4/H2SO4溶液中,改变沉积时间,进行恒电位沉积制备纳米Cu电极。图2是根据不同沉积时间制备的纳米Cu电极的循环伏安曲线作出的CO2的还原峰电流(峰电流越大,表明纳米Cu电极催化效果越好)与沉积时间的关系图,沉积时间超过50s,进一步延长沉积时间,纳米Cu电极催化效果减弱的原因是

(4)常温下,以NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。用1LNa2CO3溶液将2.33gBaSO4固体全都转化为BaCO3,再过滤,所用的Na2CO3溶液的物质的量浓度至少为
[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10;忽略溶液体积变化]
(5)章根强课题组通过温和的自光刻技术制备出富含氧空位的Co(CO3)0.5(OH)•0.11H2O纳米线(用CoⅡ表示),测试结果表明,该CoⅡ在可见光下具有优异的光催化CO2还原活性。分析表明,该CO2还原催化机理为典型的CoⅡ/CoI反应路径(如图3)。首先,光敏剂([Ru(bpy)3]2+)通过可见光照射被激发到激发态([Ru(bpy)3]2+*),随后([Ru(bpy)3]2+*)被TEOA淬灭得到([Ru(bpy)3]+)还原物种,该还原物种将向CoⅡ供激发电子将CoⅡ还原为CoI,

您最近一年使用:0次
【推荐1】天然气、石油钻探过程会释放出 、
、 等气体。
等气体。
Ⅰ.某种将 和
和 共活化的工艺涉及反应如下:
共活化的工艺涉及反应如下:
①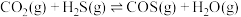

②

③
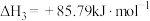
④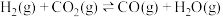
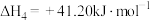
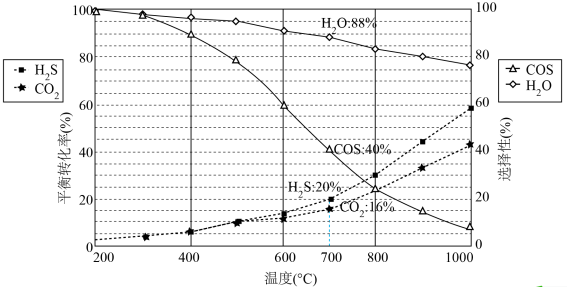
恒压密闭容器中,反应物的平衡转化率、部分生成物的选择性与温度关系如图所示。
已知:ⅰ. 和
和 的初始物质的量相等;
的初始物质的量相等;
ⅱ.COS的选择性 ,
, 的选择性
的选择性 ;
;
ⅲ.产率=转化率×选择性。
(1)
_______ 。
(2)温度高于 时,
时, 的转化率大于
的转化率大于 ,原因是
,原因是_______ 。
(3) 达到平衡时,反应体系中
达到平衡时,反应体系中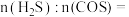
_______ 。
(4)催化剂 对反应②具有高选择性,通过理论计算得到反应的主要路径如下图。
对反应②具有高选择性,通过理论计算得到反应的主要路径如下图。请在答题纸对应区域绘出 过渡态 的示意图
的示意图_______ 。 协同转化装置,实现对天然气中
协同转化装置,实现对天然气中 和
和 的高效去除,其中电极分别为
的高效去除,其中电极分别为 石墨烯(石墨烯包裹的
石墨烯(石墨烯包裹的 )和石墨烯。过程如图所示:
)和石墨烯。过程如图所示:_______ 。
(6)阳极区发生反应为:
①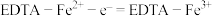 ;
;
②_______ 。
(7)工作时, 石墨烯电极区的
石墨烯电极区的 基本保持不变,原因是
基本保持不变,原因是_______ 。
 、
、 等气体。
等气体。Ⅰ.某种将
 和
和 共活化的工艺涉及反应如下:
共活化的工艺涉及反应如下:①
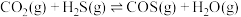

②


③

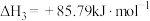
④
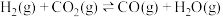
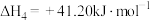
恒压密闭容器中,反应物的平衡转化率、部分生成物的选择性与温度关系如图所示。
已知:ⅰ.
 和
和 的初始物质的量相等;
的初始物质的量相等;ⅱ.COS的选择性
 ,
, 的选择性
的选择性 ;
;ⅲ.产率=转化率×选择性。
(1)

(2)温度高于
 时,
时, 的转化率大于
的转化率大于 ,原因是
,原因是(3)
 达到平衡时,反应体系中
达到平衡时,反应体系中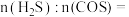
(4)催化剂
 对反应②具有高选择性,通过理论计算得到反应的主要路径如下图。
对反应②具有高选择性,通过理论计算得到反应的主要路径如下图。 的示意图
的示意图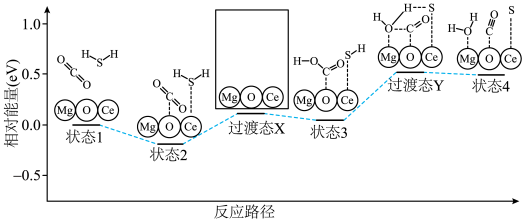
 协同转化装置,实现对天然气中
协同转化装置,实现对天然气中 和
和 的高效去除,其中电极分别为
的高效去除,其中电极分别为 石墨烯(石墨烯包裹的
石墨烯(石墨烯包裹的 )和石墨烯。过程如图所示:
)和石墨烯。过程如图所示: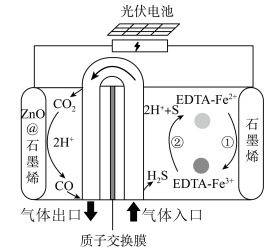
(6)阳极区发生反应为:
①
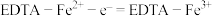 ;
;②
(7)工作时,
 石墨烯电极区的
石墨烯电极区的 基本保持不变,原因是
基本保持不变,原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】回答下列问题
(1)已知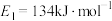 、
、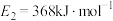 ,请参考题中图表,按要求填空:
,请参考题中图表,按要求填空:
①图甲是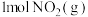 和
和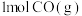 反应生成
反应生成 和
和 过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率加快,
过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率加快, 的变化是
的变化是_______ (填“增大”“减小”或“不变”,下同), 的变化是
的变化是_______ 。请写出 和CO反应的热化学方程式:
和CO反应的热化学方程式:_______ 。
②下表所示是部分化学键的键能参数。
已知
 ,
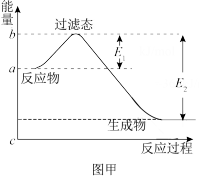
, 及
及 的结构如图乙所示。表中x=
的结构如图乙所示。表中x=_______  。(用含a、b、c、d的代数式表示)
。(用含a、b、c、d的代数式表示)
(2)工业上,常采用氧化还原方法处理尾气中的CO、NO。反应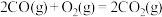 的催化剂。下图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(
的催化剂。下图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土( 型、
型、 型)催化时,CO的转化率与温度的关系。
型)催化时,CO的转化率与温度的关系。
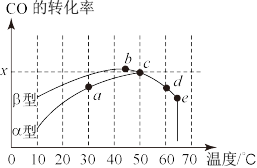
①在a、b、c、d四点中,未达到平衡状态的是_______ 。
②已知c点时容器中 浓度为
浓度为 ,则50℃时,在
,则50℃时,在 型沥青混凝土中,CO转化反应的平衡常数K=
型沥青混凝土中,CO转化反应的平衡常数K=_______ (用含x的代数式表示)。
③下列关于上图的说法正确的是_______ (填字母)。
A.CO转化反应的平衡常数:
B.在均未达到平衡状态时,同温下 型沥青混凝土中CO转化速率比
型沥青混凝土中CO转化速率比 型要大
型要大
C.b点时CO与 分子之间发生有效碰撞的几率在整个实验过程中最高
分子之间发生有效碰撞的几率在整个实验过程中最高
D.e点转化率出现突变的原因可能是温度升高后催化剂失去活性
(1)已知
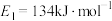 、
、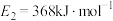 ,请参考题中图表,按要求填空:
,请参考题中图表,按要求填空:①图甲是
 和
和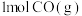 反应生成
反应生成 和
和 过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率加快,
过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率加快, 的变化是
的变化是 的变化是
的变化是 和CO反应的热化学方程式:
和CO反应的热化学方程式:
②下表所示是部分化学键的键能参数。
| 化学键 | P-P | P-O | O=O | P=O |
键能 | a | b | c | x |
已知

 ,
, 及
及 的结构如图乙所示。表中x=
的结构如图乙所示。表中x= 。(用含a、b、c、d的代数式表示)
。(用含a、b、c、d的代数式表示)
(2)工业上,常采用氧化还原方法处理尾气中的CO、NO。反应
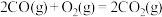 的催化剂。下图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(
的催化剂。下图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土( 型、
型、 型)催化时,CO的转化率与温度的关系。
型)催化时,CO的转化率与温度的关系。
①在a、b、c、d四点中,未达到平衡状态的是
②已知c点时容器中
 浓度为
浓度为 ,则50℃时,在
,则50℃时,在 型沥青混凝土中,CO转化反应的平衡常数K=
型沥青混凝土中,CO转化反应的平衡常数K=③下列关于上图的说法正确的是
A.CO转化反应的平衡常数:

B.在均未达到平衡状态时,同温下
 型沥青混凝土中CO转化速率比
型沥青混凝土中CO转化速率比 型要大
型要大C.b点时CO与
 分子之间发生有效碰撞的几率在整个实验过程中最高
分子之间发生有效碰撞的几率在整个实验过程中最高D.e点转化率出现突变的原因可能是温度升高后催化剂失去活性
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】氢气是一种理想的绿色能源。利用生物发酵得到的乙醇制取氢气具有良好的应用前景。乙醇水蒸气重整制氢的部分反应过程如下图所示:

已知:反应I和反应Ⅱ的平衡常数随温度变化的曲线如图所示。

(1)已知反应I中,1molCH3CH2OH(g)参与反应后的热量变化是256kJ,则反应I的热化学方程式是_______ 。
(2)反应Ⅱ在进气比[n(CO):n(H2O)]不同时,测得相应的CO的平衡转化率如图所示(各点对应的反应温度可能相同,也可能不同)。

①图中D、E两点对应的反应温度分别为TD和TE。判断:TD_______ TE(填“<”“=”或“>”)。
②试判断A、E和G三点对应的反应温度是否相同,并说明你的判断依据:_______ 。
③当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是_______ 。

已知:反应I和反应Ⅱ的平衡常数随温度变化的曲线如图所示。

(1)已知反应I中,1molCH3CH2OH(g)参与反应后的热量变化是256kJ,则反应I的热化学方程式是
(2)反应Ⅱ在进气比[n(CO):n(H2O)]不同时,测得相应的CO的平衡转化率如图所示(各点对应的反应温度可能相同,也可能不同)。

①图中D、E两点对应的反应温度分别为TD和TE。判断:TD
②试判断A、E和G三点对应的反应温度是否相同,并说明你的判断依据:
③当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:
(1)根据如图数据计算反应 的
的
_______ kJ/mol

(2)合成氨气的氢气可由天然气制备。
①其反应如下
 =+206kJ/mol,该反应自发的条件是
=+206kJ/mol,该反应自发的条件是_______________ (填“低温自发”“高温自发”或“任意温度自发”);
②为提高 的平衡转化率,可采用的措施是
的平衡转化率,可采用的措施是_______________ (填序号);
A.使用合适的催化剂 B.采用较高的温度 C.采用较高的压强 D.延长反应时间
③ 某温度下,在1L密闭容器中充入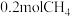 和
和 进行反应,达到平衡时再往容器内充入
进行反应,达到平衡时再往容器内充入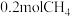 和
和 , 则该反应CH4转化率
, 则该反应CH4转化率_________ (填“变大”“变小”或“不变”)。
(3)催化剂的选择是合成氨的核心技术之一,使用催化剂1或催化剂2合成氨,产氨速率与温度的关系如图甲。


①由图判断,相同温度下,活化能Ea1_____________ Ea2(填“>”“<”或 “=”,下同)。
②在一定条件下,向某反应容器中投入 5mol N2和15mol H2,在不同温度下反应,平衡体系中氨的质量分数随压强变化曲线如图乙所示,温度 、
、  、
、  中,最大的是
中,最大的是____ ,  点
点  的转化率为
的转化率为____ 。
③1939年捷姆金和佩热夫推出氨合成反应在接近平衡时净速率方程式为 ,
, 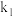 、
、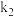 分别为正反应和逆反应的速率常数,
分别为正反应和逆反应的速率常数,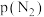 、
、 、
、 代表各组分的分压(分压
代表各组分的分压(分压  总压×物质的量分数);
总压×物质的量分数); 为常数,工业上以铁为催化剂时,
为常数,工业上以铁为催化剂时,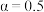 。由
。由 点数据计算
点数据计算 
_________ (MPa)-2。
(4)以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染等特点。工作原理如图所示:

写出该电池的负极电极反应方程式________________________________________ 。
(1)根据如图数据计算反应
 的
的

(2)合成氨气的氢气可由天然气制备。
①其反应如下

 =+206kJ/mol,该反应自发的条件是
=+206kJ/mol,该反应自发的条件是②为提高
 的平衡转化率,可采用的措施是
的平衡转化率,可采用的措施是A.使用合适的催化剂 B.采用较高的温度 C.采用较高的压强 D.延长反应时间
③ 某温度下,在1L密闭容器中充入
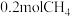 和
和 进行反应,达到平衡时再往容器内充入
进行反应,达到平衡时再往容器内充入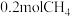 和
和 , 则该反应CH4转化率
, 则该反应CH4转化率(3)催化剂的选择是合成氨的核心技术之一,使用催化剂1或催化剂2合成氨,产氨速率与温度的关系如图甲。


①由图判断,相同温度下,活化能Ea1
②在一定条件下,向某反应容器中投入 5mol N2和15mol H2,在不同温度下反应,平衡体系中氨的质量分数随压强变化曲线如图乙所示,温度
 、
、  、
、  中,最大的是
中,最大的是 点
点  的转化率为
的转化率为③1939年捷姆金和佩热夫推出氨合成反应在接近平衡时净速率方程式为
 ,
, 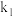 、
、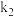 分别为正反应和逆反应的速率常数,
分别为正反应和逆反应的速率常数,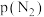 、
、 、
、 代表各组分的分压(分压
代表各组分的分压(分压  总压×物质的量分数);
总压×物质的量分数); 为常数,工业上以铁为催化剂时,
为常数,工业上以铁为催化剂时,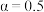 。由
。由 点数据计算
点数据计算 
(4)以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染等特点。工作原理如图所示:

写出该电池的负极电极反应方程式
您最近一年使用:0次
【推荐2】某小组实验验证“Ag++Fe2+ Fe3++Ag↓”为可逆反应并测定其平衡常数。
Fe3++Ag↓”为可逆反应并测定其平衡常数。
(1)实验验证
实验I:将0.0100 mol/L Ag2SO4溶液与0.0400 mol/L FeSO4溶液(pH=1)等体积混合,产生灰黑色沉淀,溶液呈黄色。
实验II:向少量Ag粉中加入0.0100 mol/L Fe2(SO4)3溶液(pH=1),固体完全溶解。
①取I中沉淀,加入浓硝酸,证实沉淀为Ag。现象是_______ 。
②II中溶液选用Fe2(SO4)3,不选用Fe(NO3)3的原因是_______ 。
综合上述实验,证实“Ag++Fe2+ Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。
③小组同学采用电化学装置从平衡移动角度进行验证。补全电化学装置示意图,写出操作及现象_______ 。
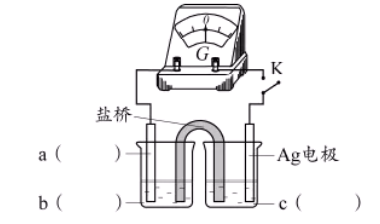
(2)测定平衡常数
实验Ⅲ:一定温度下,待实验Ⅰ中反应达到平衡状态时,取v mL上层清液,用c1 mol/L KSCN标准溶液滴定Ag+,至出现稳定的浅红色时消耗KSCN标准溶液v1 mL。
资料:Ag++SCN- AgSCN↓(白色) K=1012
AgSCN↓(白色) K=1012
Fe3++SCN- FeSCN2+(红色) K=102.3
FeSCN2+(红色) K=102.3
①滴定过程中Fe3+的作用是_______ 。
②测得平衡常数K=_______ 。
(3)思考问题
①取实验I的浊液测定c(Ag+),会使所测K值_______ (填“偏高”“偏低”或“不受影响”)。
②不用实验II中清液测定K的原因是_______ 。
 Fe3++Ag↓”为可逆反应并测定其平衡常数。
Fe3++Ag↓”为可逆反应并测定其平衡常数。(1)实验验证
实验I:将0.0100 mol/L Ag2SO4溶液与0.0400 mol/L FeSO4溶液(pH=1)等体积混合,产生灰黑色沉淀,溶液呈黄色。
实验II:向少量Ag粉中加入0.0100 mol/L Fe2(SO4)3溶液(pH=1),固体完全溶解。
①取I中沉淀,加入浓硝酸,证实沉淀为Ag。现象是
②II中溶液选用Fe2(SO4)3,不选用Fe(NO3)3的原因是
综合上述实验,证实“Ag++Fe2+
 Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。③小组同学采用电化学装置从平衡移动角度进行验证。补全电化学装置示意图,写出操作及现象

(2)测定平衡常数
实验Ⅲ:一定温度下,待实验Ⅰ中反应达到平衡状态时,取v mL上层清液,用c1 mol/L KSCN标准溶液滴定Ag+,至出现稳定的浅红色时消耗KSCN标准溶液v1 mL。
资料:Ag++SCN-
 AgSCN↓(白色) K=1012
AgSCN↓(白色) K=1012Fe3++SCN-
 FeSCN2+(红色) K=102.3
FeSCN2+(红色) K=102.3①滴定过程中Fe3+的作用是
②测得平衡常数K=
(3)思考问题
①取实验I的浊液测定c(Ag+),会使所测K值
②不用实验II中清液测定K的原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】甲醇是一种优质燃料,在工业上常用CO和H2合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
已知:①CO(g)+1/2O2(g)=CO2(g) H1
H1
②H2(g)+1/2O2(g)=H2O(g) ΔH2
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH3
回答下列问题:
(1)CO(g)+2H2(g) CH3OH(g)的平衡常数K表达式
CH3OH(g)的平衡常数K表达式___________ ,该反应的反应热ΔH4=__________ (用ΔH1、ΔH2、ΔH3)。
(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生CO(g)+2H2(g) CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是___________ (填选项字母,单选)。
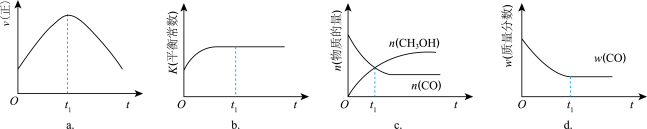
(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8,则5 min内用H2表示的反应速率为v(H2)=___________ ,T1℃时,CO(g)+2H2(g) CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=___________ 。
(4)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式:___________ 。该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,这种电化学保护方法叫做___________ 。
(5)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:___________ 。
 CH3OH(g)。
CH3OH(g)。已知:①CO(g)+1/2O2(g)=CO2(g)
 H1
H1 ②H2(g)+1/2O2(g)=H2O(g) ΔH2
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH3
回答下列问题:
(1)CO(g)+2H2(g)
 CH3OH(g)的平衡常数K表达式
CH3OH(g)的平衡常数K表达式(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生CO(g)+2H2(g)
 CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是
(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8,则5 min内用H2表示的反应速率为v(H2)=
 CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=(4)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式:
(5)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:
您最近一年使用:0次



