1 . 一定条件下, 可催化
可催化 在水中发生反应,过程分为两步
在水中发生反应,过程分为两步
i.
ⅱ.
某小组设计以下实验探究上述反应速率的影响因素(如图),
已知:(1)试管①中是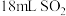 的稀溶液;②③④中是
的稀溶液;②③④中是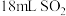 的饱和溶液
的饱和溶液
(2)四组实验中溶液出现混浊所用时间:①>②>③>④

下列说法错误的是
 可催化
可催化 在水中发生反应,过程分为两步
在水中发生反应,过程分为两步i.

ⅱ.

某小组设计以下实验探究上述反应速率的影响因素(如图),
已知:(1)试管①中是
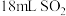 的稀溶液;②③④中是
的稀溶液;②③④中是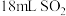 的饱和溶液
的饱和溶液(2)四组实验中溶液出现混浊所用时间:①>②>③>④

下列说法错误的是
A.通过实验①②可探究 的浓度对反应速率的影响 的浓度对反应速率的影响 |
B.实验①③可证明酸性条件下 的催化效果更好 的催化效果更好 |
C.实验④开始加入 ,发生反应ⅱ生成 ,发生反应ⅱ生成 和 和 ,加快了反应速率 ,加快了反应速率 |
D.总反应为: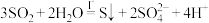 |
您最近一年使用:0次
解题方法
2 . 对于 的分解反应,
的分解反应, 、
、 均有一定的催化作用。为比较
均有一定的催化作用。为比较 和
和 对
对 分解的催化效果,某化学研究小组同学分别设计了如图甲、乙所示的实验。下列说法错误的是
分解的催化效果,某化学研究小组同学分别设计了如图甲、乙所示的实验。下列说法错误的是

 的分解反应,
的分解反应, 、
、 均有一定的催化作用。为比较
均有一定的催化作用。为比较 和
和 对
对 分解的催化效果,某化学研究小组同学分别设计了如图甲、乙所示的实验。下列说法错误的是
分解的催化效果,某化学研究小组同学分别设计了如图甲、乙所示的实验。下列说法错误的是
| A.图甲可通过观察气泡产生快慢来比较反应速率的大小 |
| B.用图乙装置测定反应速率,可测定反应产生的气体体积及反应时间 |
| C.为检查图乙所示装置的气密性,可关闭a处旋塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 |
D.图甲所示实验中,若左边试管里反应的速率大于右边,则证明 对 对 分解的催化效果比 分解的催化效果比 好 好 |
您最近一年使用:0次
解题方法
3 . 能量以多种不同的形式存在,并能相互转化。
I.化学反应伴随能量变化。
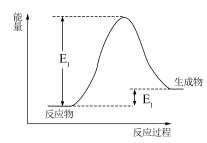
(1)NH4HCO3和CH3COOH反应过程的能量变化如图所示,___________ 代表反应活化能(填“E1”或“E2”)。
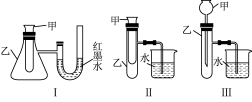
(2)某实验小组设计了三套实验装置(如图),不能用来证明“NH4HCO3和CH3COOH反应能量变化情况”的是___________ (填序号)。
(3)NH4HCO3和CH3COOH反应的离子方程式为___________ 。
II.合成氨反应为放热反应,在化工生产中具有重要意义。
(4)N2和H2在催化剂表面合成気的微观历程如图所示,用 、
、 、
、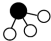 分别表示N2、H2、NH3。下列说法不正确的是___________。(填字母)
分别表示N2、H2、NH3。下列说法不正确的是___________。(填字母)
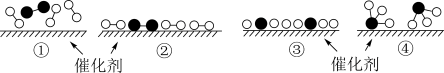
III.电池的发明是储能和供能技术的巨大进步,如图所示的原电池装置,插入电解质溶液前Cu和Fe电极质量相等。
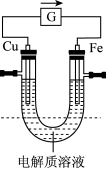
(5)电解质溶液为FeCl3时,图中箭头的方向表示___________ (填“电子”或“电流”)的流向,铁片上的电极反应式为___________ 。
(6)电解质溶液更换为X时,电极质量变化曲线如图所示。
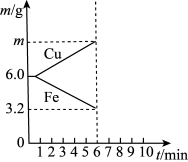
①X可以是___________ (填字母)。
A.稀硫酸 B.CuSO4溶液 C.稀盐酸 D.FeSO4溶液
②6 min时Cu电极的质量a为___________ g。
I.化学反应伴随能量变化。
(1)NH4HCO3和CH3COOH反应过程的能量变化如图所示,

(2)某实验小组设计了三套实验装置(如图),不能用来证明“NH4HCO3和CH3COOH反应能量变化情况”的是

(3)NH4HCO3和CH3COOH反应的离子方程式为
II.合成氨反应为放热反应,在化工生产中具有重要意义。
(4)N2和H2在催化剂表面合成気的微观历程如图所示,用
 、
、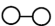 、
、 分别表示N2、H2、NH3。下列说法不正确的是___________。(填字母)
分别表示N2、H2、NH3。下列说法不正确的是___________。(填字母)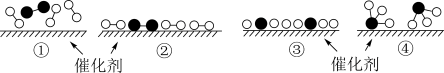
| A.反应过程存在非极性共价键的断裂和形成 |
| B.催化剂仅起到吸附N2和H2的作用,对化学反应速率没有影响 |
| C.②→③过程吸热 |
| D.反应物断键吸收的总能量小于生成物成键释放的总能量 |
III.电池的发明是储能和供能技术的巨大进步,如图所示的原电池装置,插入电解质溶液前Cu和Fe电极质量相等。

(5)电解质溶液为FeCl3时,图中箭头的方向表示
(6)电解质溶液更换为X时,电极质量变化曲线如图所示。

①X可以是
A.稀硫酸 B.CuSO4溶液 C.稀盐酸 D.FeSO4溶液
②6 min时Cu电极的质量a为
您最近一年使用:0次
名校
4 . 某学习小组利用5H2C2O4+2KMnO4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O来探究“外界条件对化学反应速率的影响”。实验时,先分别量取KMnO4酸性溶液、H2C2O4(一种弱酸)溶液,然后倒入大试管中迅速振荡,通过测定褪色所需时间来判断反应的快慢。
(1)下列因素能加快该反应速率的是___________。
(2)为了观察到紫色褪去,如果H2C2O4与KMnO4溶液的体积相同,则它们初始物质的量浓度需要满足的关系为:c(H2C2O4):c(KMnO4)___________ 。
(3)甲同学设计了如下实验
①探究温度对化学反应速率影响的组合实验编号是___________ 。
②已知b实验生成CO2体积随时间的变化曲线如图,请在图中画出a实验生成CO2体积随时间的变化曲线。___________

③实验b测得混合后溶液褪色的时间为30s,忽略混合前后体积的微小变化,则这段时间平均反应速率v(H2C2O4)=___________ (保留3位有效数字)。
(4)在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快。
①乙同学据此提出以下假设:
假设1:___________ 。
假设2:生成Mn2+对反应有催化作用
假设3:生成CO2对反应有催化作用
假设4:反应生成的K+或 该反应有催化作用
该反应有催化作用
丙同学认为假设4不合理,其理由是___________ 。
②丁同学用如下实验证明假设2成立:在A和B二试管中分别加入4mL0.2mol·L-1草酸溶液,再在A试管中加入lmL0.1mol·L-1MnSO4溶液、B试管中加入___________ mL蒸馏水,然后在两支试管中同时分别加入1mL0.1mol·L-1KMnO4酸性溶液。预期的实验现象是___________ 。在B试管中加入蒸馏水的目的是___________ 。同学们认为不宜用MnCl2溶液代替MnSO4溶液对该反应进行催化探究,其原因是(用离子方程式表示)___________ 。
(1)下列因素能加快该反应速率的是___________。
| A.加入少量K2SO4固体 | B.加入少量NaCl固体 |
| C.增大压强 | D.加入少量Na2C2O4固体 |
(2)为了观察到紫色褪去,如果H2C2O4与KMnO4溶液的体积相同,则它们初始物质的量浓度需要满足的关系为:c(H2C2O4):c(KMnO4)
(3)甲同学设计了如下实验
| 实验 编号 | H2C2O4溶液 | KMnO4溶液 | 温度/℃ | 褪色时间/s | ||
| 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | |||
| a | 0.10 | 2.0 | 0.010 | 4.0 | 25 | t1 |
| b | 0.20 | 2.0 | 0.010 | 4.0 | 25 | t2 |
| c | 0.20 | 2.0 | 0.010 | 4.0 | 50 | t3 |
②已知b实验生成CO2体积随时间的变化曲线如图,请在图中画出a实验生成CO2体积随时间的变化曲线。

③实验b测得混合后溶液褪色的时间为30s,忽略混合前后体积的微小变化,则这段时间平均反应速率v(H2C2O4)=
(4)在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快。
①乙同学据此提出以下假设:
假设1:
假设2:生成Mn2+对反应有催化作用
假设3:生成CO2对反应有催化作用
假设4:反应生成的K+或
 该反应有催化作用
该反应有催化作用丙同学认为假设4不合理,其理由是
②丁同学用如下实验证明假设2成立:在A和B二试管中分别加入4mL0.2mol·L-1草酸溶液,再在A试管中加入lmL0.1mol·L-1MnSO4溶液、B试管中加入
您最近一年使用:0次
名校
解题方法
5 . 下列设计的实验方案能达到相应实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 探究化学反应的限度 | 取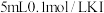 溶液,滴加 溶液,滴加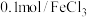 溶液 溶液 滴,充分反应,可根据溶液中既含 滴,充分反应,可根据溶液中既含 又含 又含 的实验事实判断该反应是可逆反应 的实验事实判断该反应是可逆反应 |
| B | 比较Mg与Al的金属活动性 | 常温下,将Mg、Al与NaOH溶液组成原电池 |
| C | 探究不同催化剂对同一反应速率的影响 | 相同条件下,向两支盛有等体积等浓度 溶液的试管中分别加入少量 溶液的试管中分别加入少量 粉末和5滴 粉末和5滴 的 的 溶液 溶液 |
| D | 证明在相同温度下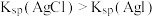 | 向盛有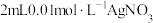 溶液的试管中滴加2滴 溶液的试管中滴加2滴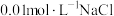 溶液,有白色沉淀生成,再向其中滴加2滴 溶液,有白色沉淀生成,再向其中滴加2滴 溶液,产生黄色沉淀 溶液,产生黄色沉淀 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
6 . 完成下列问题
(1)实验一:已知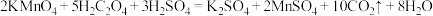 。在酸性高锰酸钾溶液与草酸(
。在酸性高锰酸钾溶液与草酸( )溶液反应时,发现开始一段时间,反应速度较快,溶液褪色不明显,但不久突然褪色,反应速度明显加快。
)溶液反应时,发现开始一段时间,反应速度较快,溶液褪色不明显,但不久突然褪色,反应速度明显加快。
①针对上述实验现象,小组同学认为 与
与 反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你认为还可能是
反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你认为还可能是___________ 的影响。
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,还需要的试剂最合理的是___________ (填字母)。
A.硫酸钾 B.硫酸锰 C.二氧化锰 D.水
(2)实验二:探究 和
和 混合时生成
混合时生成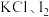 和
和 的反应存在一定的限度。
的反应存在一定的限度。
Ⅰ.向 溶液中滴加
溶液中滴加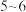 滴
滴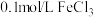 溶液,充分反应后,将所得溶液分成甲、乙两等份;
溶液,充分反应后,将所得溶液分成甲、乙两等份;
Ⅱ.向甲中滴加 ,充分振荡;
,充分振荡;
Ⅲ.向乙中滴加试剂X。
请回答下列问题:
①步骤Ⅲ中,试剂X是___________ ;
②步骤Ⅱ和Ⅲ中的实验现象说明 和
和 混合时生成
混合时生成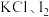 和
和 的反应存在一定的限度,该实验现象是
的反应存在一定的限度,该实验现象是___________ 。
(1)实验一:已知
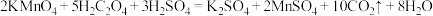 。在酸性高锰酸钾溶液与草酸(
。在酸性高锰酸钾溶液与草酸( )溶液反应时,发现开始一段时间,反应速度较快,溶液褪色不明显,但不久突然褪色,反应速度明显加快。
)溶液反应时,发现开始一段时间,反应速度较快,溶液褪色不明显,但不久突然褪色,反应速度明显加快。①针对上述实验现象,小组同学认为
 与
与 反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你认为还可能是
反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你认为还可能是②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,还需要的试剂最合理的是
A.硫酸钾 B.硫酸锰 C.二氧化锰 D.水
(2)实验二:探究
 和
和 混合时生成
混合时生成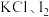 和
和 的反应存在一定的限度。
的反应存在一定的限度。Ⅰ.向
 溶液中滴加
溶液中滴加 滴
滴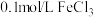 溶液,充分反应后,将所得溶液分成甲、乙两等份;
溶液,充分反应后,将所得溶液分成甲、乙两等份;Ⅱ.向甲中滴加
 ,充分振荡;
,充分振荡;Ⅲ.向乙中滴加试剂X。
请回答下列问题:
①步骤Ⅲ中,试剂X是
②步骤Ⅱ和Ⅲ中的实验现象说明
 和
和 混合时生成
混合时生成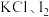 和
和 的反应存在一定的限度,该实验现象是
的反应存在一定的限度,该实验现象是
您最近一年使用:0次
名校
7 . 下列实验方案设计、现象和结论都正确的是
| 选项 | 目的 | 方案设计和现象 | 结论 |
| A | 证明 是弱电解质 是弱电解质 | 用pH计分别测量醋酸溶液和盐酸的pH,醋酸溶液的pH大 |  是弱电解质 是弱电解质 |
| B | 探究压强对化学平衡的影响 | 先将注射器充满 气体,然后将活塞往里推,注射器内气体颜色加深 气体,然后将活塞往里推,注射器内气体颜色加深 | 加压,平衡向生成 气体的方向移动 气体的方向移动 |
| C | 探究浓度对化学平衡的影响 | 向 (黄色)溶液中缓慢滴加硫酸,溶液由黄色变为橙色 (黄色)溶液中缓慢滴加硫酸,溶液由黄色变为橙色 | 增大 浓度,平衡向生成 浓度,平衡向生成 (橙色)方向移动 (橙色)方向移动 |
| D | 比较 、 、 催化分解 催化分解 的效率 的效率 | 向两份等浓度、等体积且等温的过氧化氢溶液中分别加入2滴等浓度的 溶液和 溶液和 溶液,前者产生气泡较快 溶液,前者产生气泡较快 | 催化效率: |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
8 . 某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下,回答下列问题:
(1)通过实验A、B,可探究___________ 的改变对反应速率的影响,其中
___________ ,T1=___________ ;通过实验___________ (填序号)可探究出温度变化对化学反应速率的影响。
(2)利用实验B中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=___________ 。(保留2位有效数字)
(3)写出该反应的离子方程式___________ 。
(4)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应较慢,溶液变色不明显;但不久突然褪色,反应明显加快。某同学认为是反应放热导致溶液温度升高所致,重做B组实验,测定反应过程中不同时间溶液的温度,结果如表:
①结合实验目的与表中数据,你得出的结论是___________ 。
②从影响化学反应速率的因素看,你认为还可能是___________ 的影响。若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是___________ (填字母)。
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰
| 实验序号 | 实验温度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
| KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
| V/mL | c/mol/L | V/mL | c/mol/L | V/mL | |||
| A | 293 | 20 | 0.2 | 40 | 1 | 0 | t1 |
| B | T1 | 20 | 0.2 | 30 | 1 | V1 | 8 |
| C | 313 | 20 | 0.2 | V2 | 1 | 0 | t2 |

(2)利用实验B中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=
(3)写出该反应的离子方程式
(4)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应较慢,溶液变色不明显;但不久突然褪色,反应明显加快。某同学认为是反应放热导致溶液温度升高所致,重做B组实验,测定反应过程中不同时间溶液的温度,结果如表:
| 时间/s | 0 | 2 | 4 | 6 | 8 | 10 |
| 温度/℃ | 20 | 21 | 21 | 21.5 | 22 | 22 |
②从影响化学反应速率的因素看,你认为还可能是
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰
您最近一年使用:0次
2023-10-30更新
|
243次组卷
|
2卷引用:四川省内江市第二中学2023-2024学年高二上学期第一次月考化学试题
名校
解题方法
9 . 某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4溶液转化为MnSO4,该反应的离子方程式为___________ 。
(2)t1<8,T1=___________ ,V1=___________ ,通过实验①、②,由此实验可以得出的结论是;___________ ;
(3)有同学做实验时发现,酸性高锰酸钾溶液与草酸溶液反应开始时,溶液褪色慢,但过了一段时间后溶液褪色明显加快。针对上述实验现象,该同学提出以下的猜想。
猜想a:酸性高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快。
猜想b:___________ 。
若用实验证明你的猜想。除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是___________ 。
A.硫酸钾 B.硫酸锰 C.二氧化锰 D.水
| 实验序号 | 试验温度K | 有关物质 | 溶液颜色褪至无色所需时间s | ||||
| 酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
 |  |  |  |  | |||
| ① | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
| ② | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
| ③ | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(2)t1<8,T1=
(3)有同学做实验时发现,酸性高锰酸钾溶液与草酸溶液反应开始时,溶液褪色慢,但过了一段时间后溶液褪色明显加快。针对上述实验现象,该同学提出以下的猜想。
猜想a:酸性高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快。
猜想b:
若用实验证明你的猜想。除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是
A.硫酸钾 B.硫酸锰 C.二氧化锰 D.水
您最近一年使用:0次
名校
解题方法
10 . 实验一:已知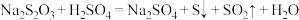 ,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。
,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。
设计如下(所取溶液体积均为10mL)。
(1)其他条件不变时,探究温度对化学反应速率的影响,应选择实验_____ (填实验编号);若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究_____ 对化学反应速率的影响。
实验二:已知 ,乙同学通过室温下溶液颜色褪至无色所需时间,研究外界条件对化学反应速率的影响(实验内容及记录如下表)。
,乙同学通过室温下溶液颜色褪至无色所需时间,研究外界条件对化学反应速率的影响(实验内容及记录如下表)。
(2)表中
_____ ,
_____ 。
(3)利用实验1中数据计算,若用KMnO4溶液的浓度变化表示的反应速率为:
_____ 。
(4)在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是_____ 的影响。
(5)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入_____(填字母)。
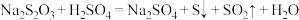 ,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。
,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计如下(所取溶液体积均为10mL)。
| 实验编号 | 实验温度/℃ |  |  |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
实验二:已知
 ,乙同学通过室温下溶液颜色褪至无色所需时间,研究外界条件对化学反应速率的影响(实验内容及记录如下表)。
,乙同学通过室温下溶液颜色褪至无色所需时间,研究外界条件对化学反应速率的影响(实验内容及记录如下表)。| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6mol/LH2C2O4溶液 | H2O | 3mol/L稀硫酸 | 0.05mol/LKMnO4溶液 | ||
| 1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
| 2 | 2.0 | 3.0 | 2.0 |  | 2.7 |
| 3 | 1.0 |  | 2.0 | 3.0 | 3.9 |


(3)利用实验1中数据计算,若用KMnO4溶液的浓度变化表示的反应速率为:

(4)在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是
(5)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入_____(填字母)。
| A.硫酸钾 | B.硫酸锰 | C.氯化锰 | D.水 |
您最近一年使用:0次
2023-10-27更新
|
55次组卷
|
3卷引用:四川省仁寿第一中学校(北校区)2023-2024学年高二上学期10月月考化学试题



