2021高三·全国·专题练习
解题方法
1 . 某兴趣小组在利用图所示装置做铜与稀硝酸反应的实验中,发现开始时气泡产生速率非常慢,一段时间后速率明显加快,烧瓶内溶液呈浅蓝色并不断加深,液面上方的气体颜色也在不断加深。该小组同学拟通过实验探究反应速率变化的原因。
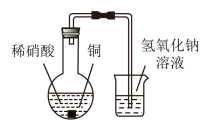
(1)图中铜与稀硝酸反应的离子方程式为___________ 。
(2)图中NaOH溶液能够吸收的有害气体是___________ 。
(3)小组同学提出了如下假设并设计实验探究:
I.甲同学认为反应速率变化的原因可能是反应放热导致溶液温度升高所致,故测定反应过程中溶液不同时间的温度,结果如下表:
结合实验目的和表中数据,你得出的结论是___________ 。
II.乙同学认为生成的Cu2+对反应有催化作用,为验证此假设,取A、B两支试管分别加入等量的铜片和稀硝酸,那么最好是在其中一支试管中加入少量的___________ (填序号)。
A.硝酸铜晶体 B.硝酸铜溶液 C.硫酸铜晶体 D.硫酸铜溶液
然后对比两支试管的反应,发现现象基本相同。故得出结论:Cu2+并不是反应的催化剂
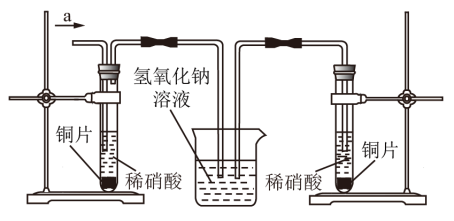
III.丙同学根据现象推测反应过程中还有少量______ 生成,进而认为该物质对反应有催化作用,如图所示,丙同学从a处通入该物质后,发现左管中产生气泡速率明显快于右管。小组同学得出最后结论:这种物质对铜和稀硝酸的反应有催化作用。
(4)实验结束后,发现试管中溶液呈绿色,而不显蓝色。部分同学认为是该溶液中Cu2+的浓度较高所致,另一部分同学认为是该溶液中溶解了通入的物质。丁同学设计了一个实验方案证明后者的推测更为合理。(在表格中写出该同学可能的实验操作和实验现象)

(1)图中铜与稀硝酸反应的离子方程式为
(2)图中NaOH溶液能够吸收的有害气体是
(3)小组同学提出了如下假设并设计实验探究:
I.甲同学认为反应速率变化的原因可能是反应放热导致溶液温度升高所致,故测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
II.乙同学认为生成的Cu2+对反应有催化作用,为验证此假设,取A、B两支试管分别加入等量的铜片和稀硝酸,那么最好是在其中一支试管中加入少量的
A.硝酸铜晶体 B.硝酸铜溶液 C.硫酸铜晶体 D.硫酸铜溶液
然后对比两支试管的反应,发现现象基本相同。故得出结论:Cu2+并不是反应的催化剂
III.丙同学根据现象推测反应过程中还有少量

(4)实验结束后,发现试管中溶液呈绿色,而不显蓝色。部分同学认为是该溶液中Cu2+的浓度较高所致,另一部分同学认为是该溶液中溶解了通入的物质。丁同学设计了一个实验方案证明后者的推测更为合理。(在表格中写出该同学可能的实验操作和实验现象)
| 操作 | 现象 |
您最近一年使用:0次
解题方法
2 . 双氧水在工业、医药等领域应用广泛。某小组采用如下方法制备 并探究
并探究 的分解反应机理。回答下列问题:
的分解反应机理。回答下列问题:
Ⅰ.电解-水解法制备 制备步骤:
制备步骤:
(1)①电解硫酸氢钾饱和溶液,制取 ;
;
②将电解所得 酸化水解制取
酸化水解制取 。电解时阳极反应式为
。电解时阳极反应式为___________ 。

Ⅱ.探究的分解反应机理
①按图1连接装置,检查装置气密性;
②向a中加入60mL15%H2O2,观察现象,通过pH传感器测pH;
③20s时,打开双通阀,向a中加入1滴管 溶液,搅拌,观察现象。反应部分实验数据结果和反应历程见图2和图3(忽略温度的影响)。
溶液,搅拌,观察现象。反应部分实验数据结果和反应历程见图2和图3(忽略温度的影响)。

回答下列问题:
(2)仪器a的名称是___________ ,已知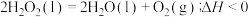 ,据此分析并说明常温常压下
,据此分析并说明常温常压下 能否分解
能否分解___________ ,前20s测得溶液pH为3.47,其原因是___________ (用电离方程式表示)。
(3)步骤③中加入 溶液后的现象为
溶液后的现象为___________ 、溶液颜色由黄色变深,又变回黄色。20~23s pH变化的原因是___________ 。结合图2和图3,23~150s pH变化对应的历程为___________ (用序号表示),150s后pH变化的原因是___________ (用反应式表示)。
(4)加入 溶液后,150s时收集到19.5mL
溶液后,150s时收集到19.5mL ,则用
,则用 的体积变化表示该反应的速率为
的体积变化表示该反应的速率为___________ 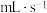 。该实验证明催化剂通过改变反应历程,从而加快反应速率。
。该实验证明催化剂通过改变反应历程,从而加快反应速率。
 并探究
并探究 的分解反应机理。回答下列问题:
的分解反应机理。回答下列问题:Ⅰ.电解-水解法制备
 制备步骤:
制备步骤:(1)①电解硫酸氢钾饱和溶液,制取
 ;
;②将电解所得
 酸化水解制取
酸化水解制取 。电解时阳极反应式为
。电解时阳极反应式为
Ⅱ.探究的分解反应机理
①按图1连接装置,检查装置气密性;
②向a中加入60mL15%H2O2,观察现象,通过pH传感器测pH;
③20s时,打开双通阀,向a中加入1滴管
 溶液,搅拌,观察现象。反应部分实验数据结果和反应历程见图2和图3(忽略温度的影响)。
溶液,搅拌,观察现象。反应部分实验数据结果和反应历程见图2和图3(忽略温度的影响)。
回答下列问题:
(2)仪器a的名称是
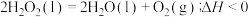 ,据此分析并说明常温常压下
,据此分析并说明常温常压下 能否分解
能否分解(3)步骤③中加入
 溶液后的现象为
溶液后的现象为(4)加入
 溶液后,150s时收集到19.5mL
溶液后,150s时收集到19.5mL ,则用
,则用 的体积变化表示该反应的速率为
的体积变化表示该反应的速率为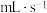 。该实验证明催化剂通过改变反应历程,从而加快反应速率。
。该实验证明催化剂通过改变反应历程,从而加快反应速率。
您最近一年使用:0次
3 . 为了深入探究某个化学问题,往往需要我们会依据一定的原理作出假设,并设计一定的化学实验方案。某化学兴趣小组的同学,对实验室制备氧气的若干问题进行如下探究:
[探究一]为探究影响双氧水分解速率的某种因素,A小组记录了如下实验数据:
(1)写出本实验中反应的化学方程式为___________ ;测量 体积的装置是
体积的装置是___________ (选填下图1中的装置编号)。
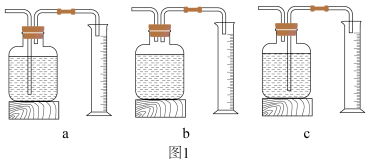
(2)由实验I、Ⅱ、Ⅲ可知:影响双氧水分解速率的因素是:___________
[探究二]B小组查阅资料:在过氧化氢溶液的分解反应中,氧化铜也能作催化剂。于是他们用天平称量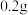 氧化铜,取5%过氧化氢溶液
氧化铜,取5%过氧化氢溶液 于试管中,进行如图2实验:
于试管中,进行如图2实验:
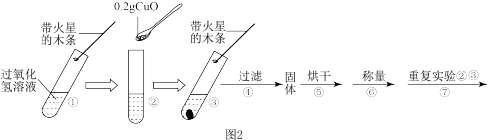
(3)填表:
(4)步骤①的目的是___________ 。
(5)步骤④需用到的玻璃仪器有铁架台(带铁圈)、烧杯、___________ 、___________ 。
(6)步骤⑦中应选用___________ 的过氧化氢溶液。
(7)过氧化氢能将二氧化硫氧化,请写出离子方程式为___________ 。
[探究一]为探究影响双氧水分解速率的某种因素,A小组记录了如下实验数据:
| 双氧水的质量 | 双氧水的浓度 |  的质量 的质量 | 相同时间内产生 的体积 的体积 | |
| I | 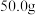 | 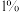 |  |  |
| Ⅱ | 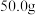 |  |  | 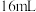 |
| Ⅲ | 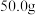 | 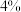 |  | 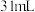 |
(1)写出本实验中反应的化学方程式为
 体积的装置是
体积的装置是
(2)由实验I、Ⅱ、Ⅲ可知:影响双氧水分解速率的因素是:
[探究二]B小组查阅资料:在过氧化氢溶液的分解反应中,氧化铜也能作催化剂。于是他们用天平称量
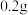 氧化铜,取5%过氧化氢溶液
氧化铜,取5%过氧化氢溶液 于试管中,进行如图2实验:
于试管中,进行如图2实验:
(3)填表:
| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
| 称得氧化铜的质量为 | 将固体加入盛有过氧化氢溶液的试管中,并把带火星的木条伸入试管,观察现象。 | 在过氧化氢溶液的分解实验中,氧化铜也能作催化剂。 |
(4)步骤①的目的是
(5)步骤④需用到的玻璃仪器有铁架台(带铁圈)、烧杯、
(6)步骤⑦中应选用
(7)过氧化氢能将二氧化硫氧化,请写出离子方程式为
您最近一年使用:0次
名校
4 . 某学习小组对硝酸工业活性炭脱硝工艺进行探究。回答下列问题:
Ⅰ.硝酸工业产生的烟气中含有大量 ,工艺如图所示:
,工艺如图所示:
(1)该流程中活性炭是催化剂,加入催化剂的目的是___________ 。
(2)若要使 和
和 恰好充分反应。则反应混合物中
恰好充分反应。则反应混合物中 与
与 的体积比为
的体积比为___________ (用含x的式子表示)。
Ⅱ.某同学为了探究干燥条件下 与
与 的反应,设计如图所示实验装置进行实验。
的反应,设计如图所示实验装置进行实验。

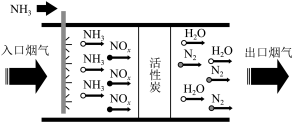
(3)装置A为氨气的发生装置,应选用___________ (填“X”或“Y”)为此实验制备氨气的装置,相关反应的化学方程式为___________ 。
(4)该实验设计中存在缺陷,请写出解决方案:___________ 。
(5)装置D用于制备 气体。
气体。
①有同学推测反应过程中有可能产生NO,该同学做此推测的理由为___________ 。
②装置D中发生反应的实验现象为___________ 。
③ 能与碱液反应,故在拆装置之前,应该怎么操作
能与碱液反应,故在拆装置之前,应该怎么操作___________ 。
Ⅰ.硝酸工业产生的烟气中含有大量
 ,工艺如图所示:
,工艺如图所示:
(1)该流程中活性炭是催化剂,加入催化剂的目的是
(2)若要使
 和
和 恰好充分反应。则反应混合物中
恰好充分反应。则反应混合物中 与
与 的体积比为
的体积比为Ⅱ.某同学为了探究干燥条件下
 与
与 的反应,设计如图所示实验装置进行实验。
的反应,设计如图所示实验装置进行实验。
(3)装置A为氨气的发生装置,应选用

(4)该实验设计中存在缺陷,请写出解决方案:
(5)装置D用于制备
 气体。
气体。①有同学推测反应过程中有可能产生NO,该同学做此推测的理由为
②装置D中发生反应的实验现象为
③
 能与碱液反应,故在拆装置之前,应该怎么操作
能与碱液反应,故在拆装置之前,应该怎么操作
您最近一年使用:0次
5 . 下面的装置是仿照工业上制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫。

请回答下列问题:
(1)装置甲的作用是_______ 。
(2)写出在催化剂表面所发生反应的化学方程式:_______ ,X中所含的气体有_______ 。
(3)在乙反应器内要求氧气的量要比二氧化硫的量多一倍左右,你是如何控制和估计的?_______ 。
(4)若丁装置在反应过程中先出现气泡,不久就出现了雾,而丙装置一直都没有任何现象,产生这种现象的原因可能是_______ (填字母)。
A.浓硫酸对三氧化硫的吸收效率远好于水,三氧化硫被浓硫酸充分吸收
B.三氧化硫的通气速率太快,三氧化硫未被浓硫酸充分吸收
C.丙中的导气管插得太深,导致三氧化硫未通入丙中

请回答下列问题:
(1)装置甲的作用是
(2)写出在催化剂表面所发生反应的化学方程式:
(3)在乙反应器内要求氧气的量要比二氧化硫的量多一倍左右,你是如何控制和估计的?
(4)若丁装置在反应过程中先出现气泡,不久就出现了雾,而丙装置一直都没有任何现象,产生这种现象的原因可能是
A.浓硫酸对三氧化硫的吸收效率远好于水,三氧化硫被浓硫酸充分吸收
B.三氧化硫的通气速率太快,三氧化硫未被浓硫酸充分吸收
C.丙中的导气管插得太深,导致三氧化硫未通入丙中
您最近一年使用:0次
6 . 化学实验是研究化学反应原理的途径之一、回答下列问题:
(1)实验一:中和反应热的测定
用50mL 盐酸与50mL
盐酸与50mL NaOH溶液在如图所示的装置中进行反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。
NaOH溶液在如图所示的装置中进行反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。

①指出装置存在的一处错误___________ 。
②已知中和后生成的溶液的比热容c为 ,溶液的密度约为
,溶液的密度约为 ,某学习小组三次实验测得温度平均升高了3.5℃。可计算出生成1mol
,某学习小组三次实验测得温度平均升高了3.5℃。可计算出生成1mol 时的反应热
时的反应热
___________ kJ/mol。(结果保留一位小数)
③经计算,得到生成1mol 时放出的热量大于57.3kJ,产生偏差的原因可能是
时放出的热量大于57.3kJ,产生偏差的原因可能是___________ (填标号)。
a.实验装置保温、隔热效果差
b.量取盐酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的内筒中
d.用温度计测定盐酸起始温度后直接测定NaOH溶液的温度
(2)实验二:探究影响化学反应速率的因素
为比较不同催化剂对 分解的催化效果,某实验小组设计了如图所示的实验。
分解的催化效果,某实验小组设计了如图所示的实验。

 对
对 的催化机理分两步进行,请写出第一步反应的离子方程式:
的催化机理分两步进行,请写出第一步反应的离子方程式:
①___________ 。
② 。
。
实验发现左边试管中产生气泡的速率更快,所得实验结论是___________ 。
(3)实验三:探究影响化学平衡移动的因素
①往2mL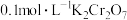 溶液中加入5~10滴
溶液中加入5~10滴 NaOH溶液,实验现象为
NaOH溶液,实验现象为___________ ,原因是 溶液中存在平衡体系:
溶液中存在平衡体系:___________ 。(用离子方程式表示),NaOH消耗量了 ,使平衡正向移动。
,使平衡正向移动。
②取少量 溶液于一支试管中加热,溶液由蓝色变为黄色,这表明升高温度使:
溶液于一支试管中加热,溶液由蓝色变为黄色,这表明升高温度使:___________ (用离子方程式表示)的平衡正向移动。
(1)实验一:中和反应热的测定
用50mL
 盐酸与50mL
盐酸与50mL NaOH溶液在如图所示的装置中进行反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。
NaOH溶液在如图所示的装置中进行反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。
①指出装置存在的一处错误
②已知中和后生成的溶液的比热容c为
 ,溶液的密度约为
,溶液的密度约为 ,某学习小组三次实验测得温度平均升高了3.5℃。可计算出生成1mol
,某学习小组三次实验测得温度平均升高了3.5℃。可计算出生成1mol 时的反应热
时的反应热
③经计算,得到生成1mol
 时放出的热量大于57.3kJ,产生偏差的原因可能是
时放出的热量大于57.3kJ,产生偏差的原因可能是a.实验装置保温、隔热效果差
b.量取盐酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的内筒中
d.用温度计测定盐酸起始温度后直接测定NaOH溶液的温度
(2)实验二:探究影响化学反应速率的因素
为比较不同催化剂对
 分解的催化效果,某实验小组设计了如图所示的实验。
分解的催化效果,某实验小组设计了如图所示的实验。
 对
对 的催化机理分两步进行,请写出第一步反应的离子方程式:
的催化机理分两步进行,请写出第一步反应的离子方程式:①
②
 。
。实验发现左边试管中产生气泡的速率更快,所得实验结论是
(3)实验三:探究影响化学平衡移动的因素
①往2mL
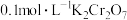 溶液中加入5~10滴
溶液中加入5~10滴 NaOH溶液,实验现象为
NaOH溶液,实验现象为 溶液中存在平衡体系:
溶液中存在平衡体系: ,使平衡正向移动。
,使平衡正向移动。②取少量
 溶液于一支试管中加热,溶液由蓝色变为黄色,这表明升高温度使:
溶液于一支试管中加热,溶液由蓝色变为黄色,这表明升高温度使:
您最近一年使用:0次
名校
解题方法
7 . 过氧化氢(H2O2)是常用的绿色氧化剂。某化学兴趣小组查阅了H2O2的相关信息,并针对它的某些性质进行了探究,具体如下:H2O2可以通过H2和O2在某催化剂表面直接反应合成,具体原理如下图所示:

(1)采用同位素示踪法研究催化剂中H+的作用:将H2用D2(2H2)代替再进行实验。催化剂中氢离子参与反应的证据是生成的产物中有H2O2或_______ 粒子(填化学式)。
II.H2O2不稳定,在Fe3+、Cu2+等粒子的催化下会很快分解并放出热量。为了比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如下实验。
(2)定性分析:通过观察甲装置两支试管中_______ 的现象,得出关于FeCl3和CuSO4催化效果的结论。某同学认为此方案还需要进一步控制变量,提出可将试剂CuSO4更换为_______ (填化学式)。
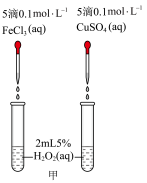
(3)定量测定:用乙装置进行定量实验。实验时组装好装置乙,关闭分液漏斗的活塞,将注射器活塞向外拉出一段距离后松开,观察活塞是否回到原来的位置。该操作的实验目的是_______ 。若反应30s后注射器中收集到气体的体积为VmL(标准状况),则锥形瓶A中实际产生气体的体积_______ VmL(填“>”、“<”或“=”)。
III.H2O2既有氧化性,又有还原性。
(4)H2O2可以氧化废水中的CN—,Cu2+可催化该反应。已知H2O2与CN—反应会生成参与大气循环的无毒气体。氰化氢(HCN)是一种易挥发的弱酸,有剧毒,对环境危害很大。
①H2O2与CN-的反应不能在酸性溶液中进行,原因是_______ ,反应生成气体的化学式为_______ 。
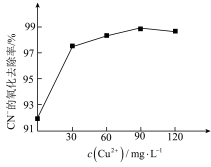
②一定条件下,测得CN-的氧化去除率随溶液中c(Cu2+)的变化如下图所示。c(Cu2+)过多时,CN-的氧化去除率有所下降,原因是_______ 。
(5)取少量84消毒液(有效成分为NaClO)于试管中,滴加H2O2溶液,产生大量无色气体。写出发生反应的化学方程式_______ 。

(1)采用同位素示踪法研究催化剂中H+的作用:将H2用D2(2H2)代替再进行实验。催化剂中氢离子参与反应的证据是生成的产物中有H2O2或
II.H2O2不稳定,在Fe3+、Cu2+等粒子的催化下会很快分解并放出热量。为了比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如下实验。
(2)定性分析:通过观察甲装置两支试管中

(3)定量测定:用乙装置进行定量实验。实验时组装好装置乙,关闭分液漏斗的活塞,将注射器活塞向外拉出一段距离后松开,观察活塞是否回到原来的位置。该操作的实验目的是

III.H2O2既有氧化性,又有还原性。
(4)H2O2可以氧化废水中的CN—,Cu2+可催化该反应。已知H2O2与CN—反应会生成参与大气循环的无毒气体。氰化氢(HCN)是一种易挥发的弱酸,有剧毒,对环境危害很大。
①H2O2与CN-的反应不能在酸性溶液中进行,原因是
②一定条件下,测得CN-的氧化去除率随溶液中c(Cu2+)的变化如下图所示。c(Cu2+)过多时,CN-的氧化去除率有所下降,原因是

(5)取少量84消毒液(有效成分为NaClO)于试管中,滴加H2O2溶液,产生大量无色气体。写出发生反应的化学方程式
您最近一年使用:0次
名校
解题方法
8 .  是一种绿色氧化还原试剂,在化学研究中应用广泛。
是一种绿色氧化还原试剂,在化学研究中应用广泛。
(一)A实验小组拟在同浓度 的催化下,探究
的催化下,探究 浓度对
浓度对 分解反应速率的影响。
分解反应速率的影响。
(1)写出本实验 分解反应方程式并标明电子转移的方向和数目:
分解反应方程式并标明电子转移的方向和数目:___________ 。
(2)设计实验方案:在不同 浓度下,测定
浓度下,测定___________ (要求所测得的数据能直接体现反应速率大小)。
(二)B实验小组在验证 氧化
氧化 时发现异常现象,并进行了深入探究。
时发现异常现象,并进行了深入探究。
实验Ⅰ:
(3)实验Ⅰ中溶液变红的原因是___________ 。(请用离子方程式表示其原理)
(4)探究实验Ⅰ中红色褪去的原因:取反应后溶液,___________ (填实验操作和现象),证明溶液中有 ,而几乎无
,而几乎无 。
。
(5)查阅资料发现,酸性溶液中 能氧化
能氧化 ,但反应很慢且无明显现象,
,但反应很慢且无明显现象, 对该反应没影响。实验Ⅰ中褪色相对较快,由此推测
对该反应没影响。实验Ⅰ中褪色相对较快,由此推测 在酸性溶液中能加快
在酸性溶液中能加快 与
与 的反应。通过实验Ⅱ和Ⅲ得到了证实。参照实验Ⅱ的图例,补全实验Ⅲ加入的试剂和现象。
的反应。通过实验Ⅱ和Ⅲ得到了证实。参照实验Ⅱ的图例,补全实验Ⅲ加入的试剂和现象。
实验Ⅱ:

实验Ⅲ:
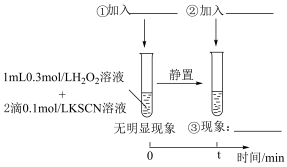
①___________ ;②___________ ;③___________ 。
(三)C实验小组猜测, 会否也能加快
会否也能加快 与
与 的反应。通过实验Ⅱ和Ⅳ得到了证实。
的反应。通过实验Ⅱ和Ⅳ得到了证实。
(6)实验Ⅳ:
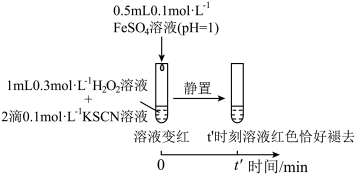
实验得知,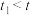 ,对比实验Ⅱ和Ⅳ得到结论:在本实验条件下,
,对比实验Ⅱ和Ⅳ得到结论:在本实验条件下,___________ 。
 是一种绿色氧化还原试剂,在化学研究中应用广泛。
是一种绿色氧化还原试剂,在化学研究中应用广泛。(一)A实验小组拟在同浓度
 的催化下,探究
的催化下,探究 浓度对
浓度对 分解反应速率的影响。
分解反应速率的影响。(1)写出本实验
 分解反应方程式并标明电子转移的方向和数目:
分解反应方程式并标明电子转移的方向和数目:(2)设计实验方案:在不同
 浓度下,测定
浓度下,测定(二)B实验小组在验证
 氧化
氧化 时发现异常现象,并进行了深入探究。
时发现异常现象,并进行了深入探究。实验Ⅰ:
| 装置与操作 | 现象 |
 | 溶液立即变红,继续滴加 溶液,红色变浅并逐渐褪去 溶液,红色变浅并逐渐褪去 |
(4)探究实验Ⅰ中红色褪去的原因:取反应后溶液,
 ,而几乎无
,而几乎无 。
。(5)查阅资料发现,酸性溶液中
 能氧化
能氧化 ,但反应很慢且无明显现象,
,但反应很慢且无明显现象, 对该反应没影响。实验Ⅰ中褪色相对较快,由此推测
对该反应没影响。实验Ⅰ中褪色相对较快,由此推测 在酸性溶液中能加快
在酸性溶液中能加快 与
与 的反应。通过实验Ⅱ和Ⅲ得到了证实。参照实验Ⅱ的图例,补全实验Ⅲ加入的试剂和现象。
的反应。通过实验Ⅱ和Ⅲ得到了证实。参照实验Ⅱ的图例,补全实验Ⅲ加入的试剂和现象。实验Ⅱ:

实验Ⅲ:

①
(三)C实验小组猜测,
 会否也能加快
会否也能加快 与
与 的反应。通过实验Ⅱ和Ⅳ得到了证实。
的反应。通过实验Ⅱ和Ⅳ得到了证实。(6)实验Ⅳ:

实验得知,
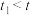 ,对比实验Ⅱ和Ⅳ得到结论:在本实验条件下,
,对比实验Ⅱ和Ⅳ得到结论:在本实验条件下,
您最近一年使用:0次
2023-10-19更新
|
162次组卷
|
2卷引用:广东省广州市执信中学2023-2024学年高二上学期10月选考化学试题
名校
解题方法
9 . 某校化学小组探究 与
与 溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):
溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):
(1)对比实验i、ii、iii,说明反应速率与___________ 有关。
(2)为了探究淡黄色固体的成分,甲同学进行实验:取实验iv试管壁上的淡黄色固体,发现其微溶于乙醇,易溶于 ,淡黄色固体是
,淡黄色固体是___________ 。
(3)根据上述实验现象,甲同学猜测一定有单质碘生成,猜测的理论依据是___________ ,但实验中溶液始终没有变蓝。
(4)利用如图装置继续实验,证实了单质碘可以生成。实验现象是___________ 。
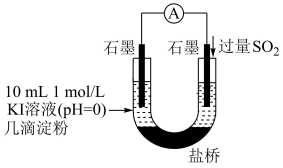
(5)对于实验i、ii、iii未能检测到单质碘,甲同学继续实验
根据(2)(4)(5)的实验现象,结合化学反应原理解释实验iv中始终未检测到单质碘的原因是___________ 。
(6)根据上述一系列实验,乙同学大胆猜测,整个反应中 起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是
起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是___________ 。
实验结果证实了猜想,则总反应的化学方程式是___________ 。
 与
与 溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):
溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):| 实验 | 实验操作 | 实验现象 |
| i | 取 淀粉 淀粉 溶液 溶液 ,通入 ,通入 至量 至量 | 溶液慢慢变为浅黄色 |
| ii | 取 淀粉 淀粉 溶液 溶液 ,通入 ,通入 至过量 至过量 | 溶液迅速变为黄色,略有浑浊 |
| iii | 取 淀粉 淀粉 溶液 溶液 (用盐酸酸化至 (用盐酸酸化至 ),通入 ),通入 至过量 至过量 | 溶液迅速变为黄色,有浑浊 |
| iv | 将实验iii中的黄色浊液进行离心分离 | 试管壁上附着淡黄色固体,溶液为黄色 |
(1)对比实验i、ii、iii,说明反应速率与
(2)为了探究淡黄色固体的成分,甲同学进行实验:取实验iv试管壁上的淡黄色固体,发现其微溶于乙醇,易溶于
 ,淡黄色固体是
,淡黄色固体是(3)根据上述实验现象,甲同学猜测一定有单质碘生成,猜测的理论依据是
(4)利用如图装置继续实验,证实了单质碘可以生成。实验现象是

(5)对于实验i、ii、iii未能检测到单质碘,甲同学继续实验
| 实验 | 实验操作 | 实验现象 |
| v | 将 通入蓝色的碘淀粉混合溶液中 通入蓝色的碘淀粉混合溶液中 | 溶液蓝色迅速褪去 |
| vi | 取实验iv离心后的黄色溶液少量,加入盐酸酸化的 溶液 溶液 | 生成白色沉淀 |
(6)根据上述一系列实验,乙同学大胆猜测,整个反应中
 起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是
起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是实验结果证实了猜想,则总反应的化学方程式是
您最近一年使用:0次
解题方法
10 . 铜和稀硝酸在无氧环境下会生成弱酸 。某实验小组为探究铜和稀硝酸的反应,设计实验装置如图。
。某实验小组为探究铜和稀硝酸的反应,设计实验装置如图。

实验过程现象记录如下表。
(1)仪器a的名称为_______ 。
(2)滴入硝酸前,为营造无氧环境,应进行的操作是_______ 。
(3)反应过程中产生的 会进一步与Cu反应生成NO,其离子方程式为
会进一步与Cu反应生成NO,其离子方程式为_______ 。
(4)溶液呈绿色是 和体系中某种微粒相互作用的结果,为探究该微粒进行下列实验:
和体系中某种微粒相互作用的结果,为探究该微粒进行下列实验:
根据以上实验现象可知, 和
和_______ (填化学式)相互作用达到平衡呈绿色。
(5)取适量150 min时反应液于试管中,加入_______ ,溶液由蓝色变为绿色,,说明150 min时反应液中含有 。
。
(6)结合平衡移动原理解释150~300 min反应液颜色变化的原因_______ 。
(7)基于上述装置,选择合适试剂,设计实验证明 对Cu与
对Cu与 硝酸的反应具有催化作用
硝酸的反应具有催化作用_______ (简述实验方案及观测指标)。
 。某实验小组为探究铜和稀硝酸的反应,设计实验装置如图。
。某实验小组为探究铜和稀硝酸的反应,设计实验装置如图。
实验过程现象记录如下表。
| 时间/min | 0~75 | 75~150 | 150~225 | 225~300 | 300~375 |
| 溶液颜色 | 接近无色 | 无色→浅蓝色 | 浅蓝色→绿色 | 绿色→深蓝色 | 浅蓝色 |
| 生成NO体积/mL | 0 | 1.0 | 42.0 | 137.5 | 0.5 |
| 反应体系温度/℃ | 26.6 | 26.8 | 26.8~27.2 | 27.2~28.8 | 28.8~28.6 |
(2)滴入硝酸前,为营造无氧环境,应进行的操作是
(3)反应过程中产生的
 会进一步与Cu反应生成NO,其离子方程式为
会进一步与Cu反应生成NO,其离子方程式为(4)溶液呈绿色是
 和体系中某种微粒相互作用的结果,为探究该微粒进行下列实验:
和体系中某种微粒相互作用的结果,为探究该微粒进行下列实验:| 序号 | 实验操作 | 现象 |
| a | 往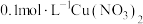 溶液中通入NO 溶液中通入NO | 溶液始终为蓝色 |
| b | 往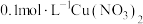 溶液中加入 溶液中加入 | 溶液变为绿色 |
| c | 往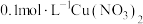 溶液中加入 溶液中加入 后逐滴加入 后逐滴加入 硝酸 硝酸 | 溶液先变为绿色后逐渐变为蓝色 |
 和
和(5)取适量150 min时反应液于试管中,加入
 。
。(6)结合平衡移动原理解释150~300 min反应液颜色变化的原因
(7)基于上述装置,选择合适试剂,设计实验证明
 对Cu与
对Cu与 硝酸的反应具有催化作用
硝酸的反应具有催化作用
您最近一年使用:0次



