解题方法
1 . 氨是人科学技术发史上的一项重大突,目前工业上用氢气和氨气直接合成氨。
(1)固氮一直是科学家致力研究的要课题,有关热力学数据如下:
常温下,大气固氮的倾向_______ 工业固氮(填“大于”或“小于”)
(2)N2(g)与H2(g) 反应的能量变化如图所示,则N2(g)与H2(g) 反应制备NH3(g) 的热化学方程式为:_______ ;

(3)T℃时,在2L恒容密闭容器中加入1.2mol N2和2mol H2模拟一定条件下工业固氮[N2(g)+3H2(g) 2NH3(g)],体系中n(NH3)随时间的变化如图所示;
2NH3(g)],体系中n(NH3)随时间的变化如图所示;

①前2分钟内的平均反应速率v(NH3)=_______ mol·L-1·min-1;
②有关工业固氮的说法正确的是_______ (选填序号) 。
A.使用化剂可提高反应物的转化率
B.循环使用N2、H2可提高NH3的产率
C.温度控制在500℃左右有利于反应向正方向行
D.增大压强有利于加快反应速率,所以压强大越好
③T℃时,该反应的平衡常数为_______ ;
(4)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位: mmol/min)与化剂的对应关系如表所示。
在不同催化剂的催化作用下,氨气分解反应中的活化能最大的催化剂是 _______ (填化学式)
(1)固氮一直是科学家致力研究的要课题,有关热力学数据如下:
| 反应 | 大气固氮N2(g)+O2(g)  2NO(g) 2NO(g) | 工业固氮N2(g)+3H2(g)  2NH3(g) 2NH3(g) | ||||
| 温度/℃ | 25 | 2000 | 25 | 350 | 400 | 450 |
| 平衡常数K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.504 | 0.152 |
(2)N2(g)与H2(g) 反应的能量变化如图所示,则N2(g)与H2(g) 反应制备NH3(g) 的热化学方程式为:

(3)T℃时,在2L恒容密闭容器中加入1.2mol N2和2mol H2模拟一定条件下工业固氮[N2(g)+3H2(g)
 2NH3(g)],体系中n(NH3)随时间的变化如图所示;
2NH3(g)],体系中n(NH3)随时间的变化如图所示;
①前2分钟内的平均反应速率v(NH3)=
②有关工业固氮的说法正确的是
A.使用化剂可提高反应物的转化率
B.循环使用N2、H2可提高NH3的产率
C.温度控制在500℃左右有利于反应向正方向行
D.增大压强有利于加快反应速率,所以压强大越好
③T℃时,该反应的平衡常数为
(4)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位: mmol/min)与化剂的对应关系如表所示。
| 催化剂 | Fe | Pd | Ru | Rh | Pt | Ni |
| 初始速率 | 0.5 | 1.8 | 7.9 | 4.0 | 2.2 | 3.0 |
您最近一年使用:0次
名校
2 . 如图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法正确的是
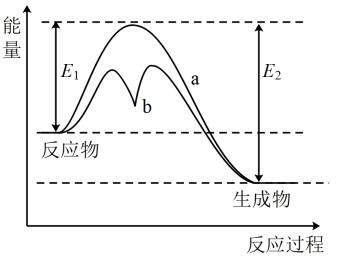

| A.反应为吸热反应 |
| B.a与b相比,a的反应速率更快 |
| C.a与b相比,反应的平衡常数一定不同 |
| D.反应物断键吸收的总能量小于生成物成键释放的总能量 |
您最近一年使用:0次
2022-02-18更新
|
211次组卷
|
2卷引用:广东省广州真光中学2021-2022学年高二上学期12月月考化学试题
3 . 氧化物在生产、生活中有广泛应用。下列氧化物的性质与应用具有对应关系的是
| A.Na2O2呈淡黄色,可用作呼吸面具的供氧剂 |
| B.MnO2具有氧化性,可用于加快H2O2的分解 |
| C.ClO2极易溶于水,可用于新型杀菌消毒剂 |
| D.SO2具有还原性,可用于葡萄酒的抗氧化剂 |
您最近一年使用:0次
2022-01-18更新
|
373次组卷
|
6卷引用:江苏省南通市新高考基地学校2021-2022学年高三上学期12月第二次大联考化学试题
江苏省南通市新高考基地学校2021-2022学年高三上学期12月第二次大联考化学试题(已下线)黄金卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)(已下线)查补易混易错点03 常见无机化合物及其应用-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)查补易混易错点03 常见无机化合物及其应用-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)押江苏卷第4题 元素化学——物质的性质、用途 -备战2022年高考化学临考题号押题(江苏卷)江苏省盐城市东台创新高级中学2021-2022学年高一下学期2月份月检测化学试题
名校
解题方法
4 . 如图,这种具有不同能量的分子百分数和能量的对应关系图,叫做一定温度下分子能量分布曲线图。图中E表示分子平均能量,Ec是活化分子具有的最低能量。下列说法不正确的是
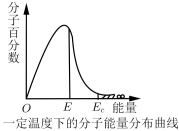

| A.图中Ec与E之差表示活化能 |
| B.升高温度,图中阴影部分面积会增大 |
| C.使用合适的催化剂,E不变,Ec变小 |
| D.能量大于Ec的分子间发生的碰撞一定是有效碰撞 |
您最近一年使用:0次
2020-03-05更新
|
258次组卷
|
3卷引用:江西省景德镇一中2020-2021学年高一下学期期末考试化学试题
名校
5 . 氨在能源、化肥生产等领域有着非常重要的用途。
(1)与H2-O2燃料电池相比,氨易液化、运输和储存方便,安全性能更高。新型NH3-O2燃科电池原理如下图所示:OH-离子向________ 移动(填“电极1或“电极2”),电极2的反应式为___________ 。

(2)氨的合成是当前的研究热点,目前最主要的方法是Haber-Bosch法:通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
①该反应放热,但仍选择较高温度。其原因是___________ 。
②列举一条既能提高速率又能提高原料转化率的措施___________ 。
(3)常温常压下电解法合成氨的原理如下图所示:
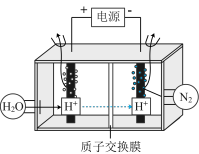
①阳极产生的气体是___________ 。
②阴极生成氨的电极反应式为___________ 。
③经检测在阴极表面发生了副反应,导致氨的产量降低。出该反应的电极反应式___________ 。
④为了尽可能避免副反应的发生,采用的方法是改进阴极表面的催化剂,这样设计是利用了催化剂具有___________ 性。
(1)与H2-O2燃料电池相比,氨易液化、运输和储存方便,安全性能更高。新型NH3-O2燃科电池原理如下图所示:OH-离子向

(2)氨的合成是当前的研究热点,目前最主要的方法是Haber-Bosch法:通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
①该反应放热,但仍选择较高温度。其原因是
②列举一条既能提高速率又能提高原料转化率的措施
(3)常温常压下电解法合成氨的原理如下图所示:

①阳极产生的气体是
②阴极生成氨的电极反应式为
③经检测在阴极表面发生了副反应,导致氨的产量降低。出该反应的电极反应式
④为了尽可能避免副反应的发生,采用的方法是改进阴极表面的催化剂,这样设计是利用了催化剂具有
您最近一年使用:0次
名校
6 . “氧来乐”是鱼塘养殖户的“救命药”,其标签如下表:

(1)“氧来乐”可以给鱼塘增氧的化学反应方程式:___________ 。有学生认为 也可以给鱼塘增氧,你认为可以吗?并简述理由:
也可以给鱼塘增氧,你认为可以吗?并简述理由:___________ 。
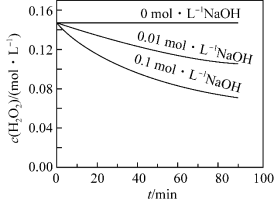
(2) 分解速率受多种因素影响。学生甲通过数字化实验测得
分解速率受多种因素影响。学生甲通过数字化实验测得 时,
时, 浓度随时间的变化如图所示,从下图中可得出的结论是:其他条件相同时,
浓度随时间的变化如图所示,从下图中可得出的结论是:其他条件相同时,___________ 。
(3)学生乙利用实验室提供的仪器和试剂进行了教材上的实验。
步骤:分别向①、②两支试管中加入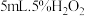 溶液,同时分别向两试管中加入2滴
溶液,同时分别向两试管中加入2滴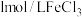 溶液(作催化剂)。待试管中均有适量气泡出现时,将试管①放入
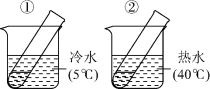
溶液(作催化剂)。待试管中均有适量气泡出现时,将试管①放入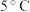 水浴中,将试管②放入
水浴中,将试管②放入 水浴中,观察实验现象。如下图。该实验是为了探究
水浴中,观察实验现象。如下图。该实验是为了探究___________ 对 分解速率的影响;
分解速率的影响;
(4)学生丙为探究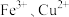 两种催化剂对
两种催化剂对 分解速率的影响。
分解速率的影响。
设计了如下实验(如下图):分别向 两支试管中加入
两支试管中加入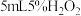 溶液,向试管a中加入2滴
溶液,向试管a中加入2滴 ,向试管b中加入2滴
,向试管b中加入2滴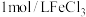 溶液,观察实验现象。该方案存在不严谨之处。请你改进:
溶液,观察实验现象。该方案存在不严谨之处。请你改进:___________ 。
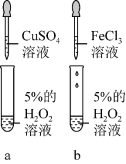

| 主要成分 | 过氧化氢 |
| 含量规格 |  |
| 作用与用途 | 本品在分解过程中释放出活泼的新生态氧,用于养殖池塘的增氧,药性温和,使用方便,无残留,绿色环保。 |
| 用法 | 将本品以1000倍水稀释后直接泼洒于养殖池塘中 |
| 用量 | 每亩水深1米用本品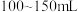 ,病情严重可加量使用,并可使用催化剂 ,病情严重可加量使用,并可使用催化剂 |
 也可以给鱼塘增氧,你认为可以吗?并简述理由:
也可以给鱼塘增氧,你认为可以吗?并简述理由:(2)
 分解速率受多种因素影响。学生甲通过数字化实验测得
分解速率受多种因素影响。学生甲通过数字化实验测得 时,
时, 浓度随时间的变化如图所示,从下图中可得出的结论是:其他条件相同时,
浓度随时间的变化如图所示,从下图中可得出的结论是:其他条件相同时,
(3)学生乙利用实验室提供的仪器和试剂进行了教材上的实验。
步骤:分别向①、②两支试管中加入
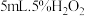 溶液,同时分别向两试管中加入2滴
溶液,同时分别向两试管中加入2滴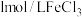 溶液(作催化剂)。待试管中均有适量气泡出现时,将试管①放入
溶液(作催化剂)。待试管中均有适量气泡出现时,将试管①放入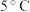 水浴中,将试管②放入
水浴中,将试管②放入 水浴中,观察实验现象。如下图。该实验是为了探究
水浴中,观察实验现象。如下图。该实验是为了探究 分解速率的影响;
分解速率的影响;
(4)学生丙为探究
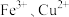 两种催化剂对
两种催化剂对 分解速率的影响。
分解速率的影响。设计了如下实验(如下图):分别向
 两支试管中加入
两支试管中加入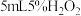 溶液,向试管a中加入2滴
溶液,向试管a中加入2滴 ,向试管b中加入2滴
,向试管b中加入2滴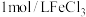 溶液,观察实验现象。该方案存在不严谨之处。请你改进:
溶液,观察实验现象。该方案存在不严谨之处。请你改进:
您最近一年使用:0次
名校
解题方法
7 . 草酸(H2C2O4)用途广泛,是一种易溶于水的二元有机弱酸,具有还原性,为探究草酸被氧化的速率问题,高二化学小组进行如下实验:
Ⅰ.探究H2C2O4与KMnO4溶液反应
(1)在酸性条件下反应,写出H2C2O4与KMnO4溶液反应的离子方程式:___________
(2)为探究外界条件对反应速率的影响,阳阳进行了如下实验:
对比实验___________ (填实验编号),可探究草酸浓度对反应速率的影响;实验测得t3< t2,由此得出的结论是____________
Ⅱ.探究H2C2O4与 溶液反应
溶液反应
查阅资料:H2C2O4与 溶液反应很慢,需数月时间才能完成,但加入
溶液反应很慢,需数月时间才能完成,但加入 可促进H2C2O4与
可促进H2C2O4与 的反应。依据此资料,阳阳设计如下实验证实了这一点。
的反应。依据此资料,阳阳设计如下实验证实了这一点。
(3)实验Ⅳ的目的是:___________ 。
(4)对实验Ⅱ继续进行探究,发现溶液中 浓度变化如图:
浓度变化如图:
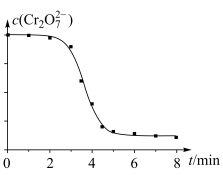
小宇认为此变化是通过两个过程实现的。
过程ⅰ: 与H2C2O4反应生成了
与H2C2O4反应生成了 。
。
过程ⅱ: 可加快草酸与重铬酸钾的反应
可加快草酸与重铬酸钾的反应
①查阅资料:溶液中 能被
能被 氧化为
氧化为 。针对过程ⅰ,小宇设计如下方法证实:
。针对过程ⅰ,小宇设计如下方法证实:
将 加入到
加入到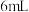
___________ 中,固体完全溶解;从中取出少量溶液,加入过量 固体,充分反应后静置,观察到
固体,充分反应后静置,观察到___________ 。
②小宇继续设计实验方案证实了过程ⅱ成立,他的实验方案如下:将2mL0.3moL/L H2C2O4溶液与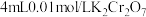 溶液混合,调至pH=2,加入
溶液混合,调至pH=2,加入 固体,6分钟后现象为:
固体,6分钟后现象为:___________ 。综合以上实验可知,草酸发生氧化反应的速率与___________ 有关。
Ⅰ.探究H2C2O4与KMnO4溶液反应
(1)在酸性条件下反应,写出H2C2O4与KMnO4溶液反应的离子方程式:
(2)为探究外界条件对反应速率的影响,阳阳进行了如下实验:
| 实验编号 | 所加试剂及用量/mL | 条件 | 溶液颜色褪至无色所需时间/min | |||
| 0.01mol/L H2C2O4溶液 | 0.01mol/L KMnO4溶液 | 3.0mol/L稀硫酸 | 水 | 温度/℃ | ||
| 1 | 8.0 | 2.0 | 2.0 | 3.0 | 20 | t1 |
| 2 | 6.0 | 2.0 | 2.0 | 5.0 | 20 | t2 |
| 3 | 6.0 | 2.0 | 2.0 | 5.0 | 30 | t3 |
| 4 | 5.0 | 2.0 | 2.0 | 5.0 | 30 | t4 |
Ⅱ.探究H2C2O4与
 溶液反应
溶液反应查阅资料:H2C2O4与
 溶液反应很慢,需数月时间才能完成,但加入
溶液反应很慢,需数月时间才能完成,但加入 可促进H2C2O4与
可促进H2C2O4与 的反应。依据此资料,阳阳设计如下实验证实了这一点。
的反应。依据此资料,阳阳设计如下实验证实了这一点。| 实验Ⅱ | 实验Ⅲ | 实验Ⅳ | |
| 实验操作 | 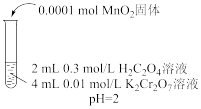 |  | 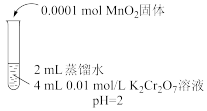 |
| 实验现象 | 6min后固体完全溶解,溶液橙色变浅,温度不变 | 6min后固体未溶解,溶液颜色无明显变化 | 6min后固体未溶解,溶液颜色无明显变化 |
(4)对实验Ⅱ继续进行探究,发现溶液中
 浓度变化如图:
浓度变化如图:
小宇认为此变化是通过两个过程实现的。
过程ⅰ:
 与H2C2O4反应生成了
与H2C2O4反应生成了 。
。过程ⅱ:
 可加快草酸与重铬酸钾的反应
可加快草酸与重铬酸钾的反应①查阅资料:溶液中
 能被
能被 氧化为
氧化为 。针对过程ⅰ,小宇设计如下方法证实:
。针对过程ⅰ,小宇设计如下方法证实:将
 加入到
加入到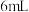
 固体,充分反应后静置,观察到
固体,充分反应后静置,观察到②小宇继续设计实验方案证实了过程ⅱ成立,他的实验方案如下:将2mL0.3moL/L H2C2O4溶液与
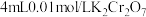 溶液混合,调至pH=2,加入
溶液混合,调至pH=2,加入 固体,6分钟后现象为:
固体,6分钟后现象为:
您最近一年使用:0次
2021-11-20更新
|
513次组卷
|
2卷引用:安徽省合肥市第六中学2021-2022学年高二上学期期中教学检测化学试题
解题方法
8 . 氢气在实验室和工业上有着广泛的用途。请回答:
(1)氢气可以与煤在催化剂作用下制备乙炔,已知部分反应如下:
Ⅰ.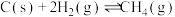

Ⅱ.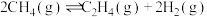

Ⅲ.
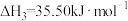
Ⅳ.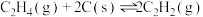

通过计算说明反应Ⅳ自发进行的条件_______ 。
(2)利用氢气与二氧化碳催化反应合成乙烯,是实现低碳转型的一条途径。在0.1MPa、120℃条件下,以 的投料比充入体积固定的密闭容器中,发生反应:
的投料比充入体积固定的密闭容器中,发生反应:
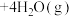 ,平衡时水蒸气的物质的量百分数为50.0%。请回答:
,平衡时水蒸气的物质的量百分数为50.0%。请回答:
①反应的平衡常数表达式为_______ 。
②达到平衡时, 的转化率为
的转化率为_______ 。
(3)氢气可合成氨气,氨气与二氧化碳可以合成尿素,反应为:
 ,分为两步:
,分为两步:
已知投料的组成为 、
、 和水蒸气(有助于分离尿素),一定条件下,氨基甲酸铵(
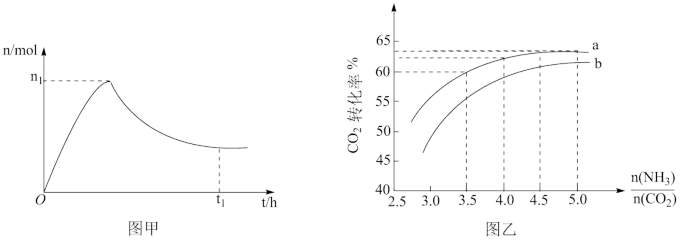
和水蒸气(有助于分离尿素),一定条件下,氨基甲酸铵( )物质的量与时间的关系图(图甲,t1后物质的量不再改变),以及不同氨碳比(
)物质的量与时间的关系图(图甲,t1后物质的量不再改变),以及不同氨碳比(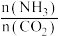 )与水碳比(
)与水碳比(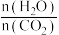 )投料时
)投料时 平衡转化率图象(图乙,a、b代表水碳比):
平衡转化率图象(图乙,a、b代表水碳比):
回答下列问题:
①已知反应I又可以分成两步:_______、 ,请写出第一步的化学方程式
,请写出第一步的化学方程式_______ 。
②下列叙述正确的是_______ 。
A.反应Ⅰ的活化能大于反应Ⅱ,
B.增大氨碳比有利于提高尿素产率,原因之一是过量氨气与反应Ⅱ生成的水反应,促进平衡正移
C.实际生产中若选择曲线a,则氨碳比应控制在4.0左右
D.曲线a的水碳比大于曲线b,减小水碳比有利于尿素生成
③如果某催化剂可以同等程度地加速反应Ⅰ和Ⅱ,请在图甲中画出保持其他条件不变,加入该催化剂后从0h到t1时的氨基甲酸铵物质的量变化曲线_______ 。
(1)氢气可以与煤在催化剂作用下制备乙炔,已知部分反应如下:
Ⅰ.
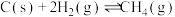

Ⅱ.
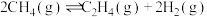

Ⅲ.

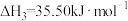
Ⅳ.
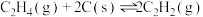

通过计算说明反应Ⅳ自发进行的条件
(2)利用氢气与二氧化碳催化反应合成乙烯,是实现低碳转型的一条途径。在0.1MPa、120℃条件下,以
 的投料比充入体积固定的密闭容器中,发生反应:
的投料比充入体积固定的密闭容器中,发生反应:
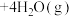 ,平衡时水蒸气的物质的量百分数为50.0%。请回答:
,平衡时水蒸气的物质的量百分数为50.0%。请回答:①反应的平衡常数表达式为
②达到平衡时,
 的转化率为
的转化率为(3)氢气可合成氨气,氨气与二氧化碳可以合成尿素,反应为:

 ,分为两步:
,分为两步:反应步骤 | 反应方程式 |
|
| Ⅰ | 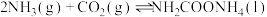  | 快速放热 |
| Ⅱ |  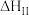 | 慢速吸热 |
已知投料的组成为
 、
、 和水蒸气(有助于分离尿素),一定条件下,氨基甲酸铵(
和水蒸气(有助于分离尿素),一定条件下,氨基甲酸铵( )物质的量与时间的关系图(图甲,t1后物质的量不再改变),以及不同氨碳比(
)物质的量与时间的关系图(图甲,t1后物质的量不再改变),以及不同氨碳比(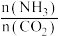 )与水碳比(
)与水碳比(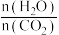 )投料时
)投料时 平衡转化率图象(图乙,a、b代表水碳比):
平衡转化率图象(图乙,a、b代表水碳比):
回答下列问题:
①已知反应I又可以分成两步:_______、
 ,请写出第一步的化学方程式
,请写出第一步的化学方程式②下列叙述正确的是
A.反应Ⅰ的活化能大于反应Ⅱ,

B.增大氨碳比有利于提高尿素产率,原因之一是过量氨气与反应Ⅱ生成的水反应,促进平衡正移
C.实际生产中若选择曲线a,则氨碳比应控制在4.0左右
D.曲线a的水碳比大于曲线b,减小水碳比有利于尿素生成
③如果某催化剂可以同等程度地加速反应Ⅰ和Ⅱ,请在图甲中画出保持其他条件不变,加入该催化剂后从0h到t1时的氨基甲酸铵物质的量变化曲线
您最近一年使用:0次
9 . 甲醇有广泛的用途和广阔的应用前景,工业上利用CO2生产甲醇,再利用甲醇生产丙烯。回答下列问题:
(1)常温下,H2和甲醇的燃烧热分别为285.8kJ·mol-1和726.4kJ·mol-1,1mol甲醇汽化需要吸收82.0kJ的热量,则CO2和H2在Cu/ZnO催化作用下合成气态甲醇的热化学方程式为___________ 。
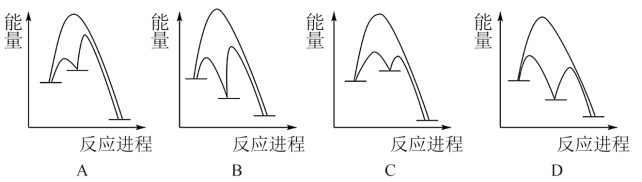
(2)在Cu/ZnO催化作用下,CO2和H2合成甲醇的总反应分两步进行:
第一步为___________ (写化学方程式) △H>0;
第二步为Cu/Zn*+2H2+CO2=Cu/ZnO*+CH3OH △H<0.
第二步反应几乎不影响总反应达到平衡所用的时间,由此推知以下能正确表示Cu/ZnO催化CO2和H2合成甲醇反应过程的示意图为___________ 。
(3)甲醇催化制取丙烯的过程中发生如下反应:
I.3CH3OH(g)⇌C3H6(g)+3H2O(g)
II.2CH3OH(g)⇌C2H4(g)+2H2O(g)
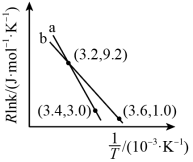
反应I的Arrhenius经验公式的实验数据如下图中曲线a所示,已知Arrhenius经验公式为 (
( 为活化能,k为速率常数,R和C为常数)。则该反应的活化能
为活化能,k为速率常数,R和C为常数)。则该反应的活化能 =
=___________ kJ/mol。当改变外界条件时,实验数据如下图中的曲线b所示,则实验可能改变的外界条件是___________ 。
(1)常温下,H2和甲醇的燃烧热分别为285.8kJ·mol-1和726.4kJ·mol-1,1mol甲醇汽化需要吸收82.0kJ的热量,则CO2和H2在Cu/ZnO催化作用下合成气态甲醇的热化学方程式为
(2)在Cu/ZnO催化作用下,CO2和H2合成甲醇的总反应分两步进行:
第一步为
第二步为Cu/Zn*+2H2+CO2=Cu/ZnO*+CH3OH △H<0.
第二步反应几乎不影响总反应达到平衡所用的时间,由此推知以下能正确表示Cu/ZnO催化CO2和H2合成甲醇反应过程的示意图为

(3)甲醇催化制取丙烯的过程中发生如下反应:
I.3CH3OH(g)⇌C3H6(g)+3H2O(g)
II.2CH3OH(g)⇌C2H4(g)+2H2O(g)
反应I的Arrhenius经验公式的实验数据如下图中曲线a所示,已知Arrhenius经验公式为
 (
( 为活化能,k为速率常数,R和C为常数)。则该反应的活化能
为活化能,k为速率常数,R和C为常数)。则该反应的活化能 =
=
您最近一年使用:0次
2021-12-15更新
|
193次组卷
|
2卷引用:四川省成都市树德中学2021-2022学年高二上学期11月阶段性测试(期中)化学试题
10 . 按要求完成下列问题。
(1)二氧化硫在工业上和生活中有广泛的用途。工业用SO2和O2反应合成SO3反应的反应热(ΔH)、活化能(Ea正)为:SO2(g)+ O2(g)⇌SO3(g) ΔH=-98.0kJ·mol-1 Ea正=125.5kJ·mol-1
O2(g)⇌SO3(g) ΔH=-98.0kJ·mol-1 Ea正=125.5kJ·mol-1
①三氧化硫的分解反应SO3(g)⇌SO2(g)+ O2(g)的活化能Ea正=
O2(g)的活化能Ea正=___________ 。
②下列关于工业用SO2和O2反应合成SO3反应的理解正确的是___________ 。
A.增大氧气浓度,活化分子百分数增大,有效碰撞频率增大,反应速率加快
B.该反应的实际工业生产条件是高温、高压、合适的催化剂
C.当温度、压强一定时,在原料气(SO2和O2的比例不变)中添加少量惰性气体,会使平衡转化率减小
D.反应过程中,可将SO3液化,并不断将液态SO3移去,有利于提高正反应速率
(2)CO和H2在Cu2O/ZnO作催化剂的条件下发生反应:CO(g)+2H2(g)⇌CH3OH(g)获得甲醇。向2L的密闭容器中通入1molCO(g)和2molH2(g),发生反应合成甲醇,反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图所示。
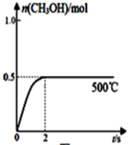
①500℃的此反应的平衡常数K=___________ 。
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2有利于维持Cu2O的量不变,原因是___________ (用化学方程式表示)。
③在500℃恒压条件下,请在图中画出反应体系中n(CH3OH)随时间t变化的总趋势图_________ 。
(1)二氧化硫在工业上和生活中有广泛的用途。工业用SO2和O2反应合成SO3反应的反应热(ΔH)、活化能(Ea正)为:SO2(g)+
 O2(g)⇌SO3(g) ΔH=-98.0kJ·mol-1 Ea正=125.5kJ·mol-1
O2(g)⇌SO3(g) ΔH=-98.0kJ·mol-1 Ea正=125.5kJ·mol-1①三氧化硫的分解反应SO3(g)⇌SO2(g)+
 O2(g)的活化能Ea正=
O2(g)的活化能Ea正=②下列关于工业用SO2和O2反应合成SO3反应的理解正确的是
A.增大氧气浓度,活化分子百分数增大,有效碰撞频率增大,反应速率加快
B.该反应的实际工业生产条件是高温、高压、合适的催化剂
C.当温度、压强一定时,在原料气(SO2和O2的比例不变)中添加少量惰性气体,会使平衡转化率减小
D.反应过程中,可将SO3液化,并不断将液态SO3移去,有利于提高正反应速率
(2)CO和H2在Cu2O/ZnO作催化剂的条件下发生反应:CO(g)+2H2(g)⇌CH3OH(g)获得甲醇。向2L的密闭容器中通入1molCO(g)和2molH2(g),发生反应合成甲醇,反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图所示。

①500℃的此反应的平衡常数K=
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2有利于维持Cu2O的量不变,原因是
③在500℃恒压条件下,请在图中画出反应体系中n(CH3OH)随时间t变化的总趋势图
您最近一年使用:0次



