名校
解题方法
1 . 某温度时,在一个容积固定的密闭容器中进行如下反应: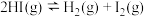 ,该反应达到化学平衡状态的标志是
,该反应达到化学平衡状态的标志是
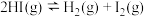 ,该反应达到化学平衡状态的标志是
,该反应达到化学平衡状态的标志是| A.反应停止了 | B.混合气体的密度不再改变 |
| C.混合气体的颜色不再改变 | D. |
您最近一年使用:0次
名校
解题方法
2 . 一定温度下,在2L的恒容密闭容器中发生反应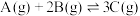 。反应过程中的部分数据如表所示。
。反应过程中的部分数据如表所示。
反应物A的转化率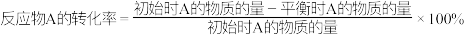 。
。
下列说法正确的是
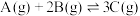 。反应过程中的部分数据如表所示。
。反应过程中的部分数据如表所示。 | 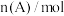 | 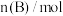 | 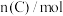 |
| 0 | 2.0 | 2.4 | 0 |
| 5 | 0.9 | ||
| 10 | 1.6 | ||
| 15 | 1.6 |
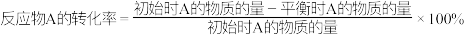 。
。下列说法正确的是
A. 用A表示的平均反应速率为 用A表示的平均反应速率为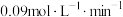 |
B.平衡状态时,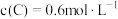 |
C.该反应在 后才达到平衡 后才达到平衡 |
D.物质B的平衡转化率为 |
您最近一年使用:0次
名校
解题方法
3 . 氮的化合物广泛应用于工业、航天、医药等领域。
(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的 和
和 。在一定条件下发生反应:
。在一定条件下发生反应: 。该反应已达到平衡状态的标志是
。该反应已达到平衡状态的标志是_______ 。
a.12
 键断裂的同时生成5
键断裂的同时生成5
 键
键
b.容器内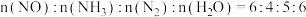
c.容器内 的物质的量分数不再变化
的物质的量分数不再变化
d.混合气体的平均相对分子质量不再改变
(2)肼( )是火箭推进器中常用的高能燃料,已知0.4
)是火箭推进器中常用的高能燃料,已知0.4 液态肼和足量
液态肼和足量 反应,生成
反应,生成 和水蒸气,放出256.65
和水蒸气,放出256.65 的热量,请写出该反应的热化学方程式:
的热量,请写出该反应的热化学方程式:_______ 。
(3)一定条件下,在5L密闭容器内,反应 ,
, 的物质的量随时间变化如表:
的物质的量随时间变化如表:
①用 表示0~2s内该反应的平均速率为
表示0~2s内该反应的平均速率为_______ 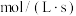 ,在第5s时,
,在第5s时, 的转化率为
的转化率为_______ 。
②为加快反应速率,可以采取的措施是_______ 。
a.升高温度 b.恒容时充入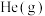 c.恒压时充入
c.恒压时充入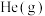 d.恒容时充入
d.恒容时充入
(4)已知: ,不同温度(T)下,
,不同温度(T)下, 分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度
分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度 消耗一半时所需的相应时间),则
消耗一半时所需的相应时间),则
_______  (填“>”、“=”或“<")。当温度为T、起始压强为
(填“>”、“=”或“<")。当温度为T、起始压强为 ,反应至
,反应至 min时,此时体系压强
min时,此时体系压强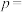
_______ (用 表示)。
表示)。
(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的
 和
和 。在一定条件下发生反应:
。在一定条件下发生反应: 。该反应已达到平衡状态的标志是
。该反应已达到平衡状态的标志是a.12

 键断裂的同时生成5
键断裂的同时生成5
 键
键b.容器内
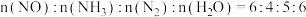
c.容器内
 的物质的量分数不再变化
的物质的量分数不再变化d.混合气体的平均相对分子质量不再改变
(2)肼(
 )是火箭推进器中常用的高能燃料,已知0.4
)是火箭推进器中常用的高能燃料,已知0.4 液态肼和足量
液态肼和足量 反应,生成
反应,生成 和水蒸气,放出256.65
和水蒸气,放出256.65 的热量,请写出该反应的热化学方程式:
的热量,请写出该反应的热化学方程式:(3)一定条件下,在5L密闭容器内,反应
 ,
, 的物质的量随时间变化如表:
的物质的量随时间变化如表:时间/s | 0 | 1 | 2 | 3 | 5 | 4 |
| 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
 表示0~2s内该反应的平均速率为
表示0~2s内该反应的平均速率为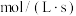 ,在第5s时,
,在第5s时, 的转化率为
的转化率为②为加快反应速率,可以采取的措施是
a.升高温度 b.恒容时充入
 c.恒压时充入
c.恒压时充入 d.恒容时充入
d.恒容时充入
(4)已知:
 ,不同温度(T)下,
,不同温度(T)下, 分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度
分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度 消耗一半时所需的相应时间),则
消耗一半时所需的相应时间),则
 (填“>”、“=”或“<")。当温度为T、起始压强为
(填“>”、“=”或“<")。当温度为T、起始压强为 ,反应至
,反应至 min时,此时体系压强
min时,此时体系压强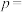
 表示)。
表示)。
您最近一年使用:0次
4 . 丙烷的价格低廉且产量大,丙烷脱氢制丙烯是获取丙烯及其衍生物的重要途径。
反应ⅰ(直接脱氢):

反应ⅱ:

(1)已知下列键能数据,结合反应ⅰ数据,计算 的键能是
的键能是________  。
。
(2)计算反应ⅲ( 氧化丙烷脱氢):
氧化丙烷脱氢): 的
的
________  。
。
(3) 催化丙烷直接脱氢的主要副反应为
催化丙烷直接脱氢的主要副反应为 。
。
①一定温度下,向恒容容器中充入一定量丙烷,在 催化作用下脱氢制丙烯,下列情况表明反应达到平衡状态的是
催化作用下脱氢制丙烯,下列情况表明反应达到平衡状态的是________________ (填标号)。
A.气体密度不再改变
B.气体平均摩尔质量不再改变
C.体系压强不再改变
D.单位时间内消耗 的物质的量与生成
的物质的量与生成 的物质的量相等
的物质的量相等
② 下,在
下,在 容器中充入
容器中充入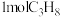 ,
,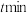 后达到平衡状态时,
后达到平衡状态时, 转化率为
转化率为 ,
, 选择性为
选择性为 ,则
,则 的消耗速率
的消耗速率
________  ,丙烷脱氢反应的平衡常数
,丙烷脱氢反应的平衡常数
________ 。(已知 选择性
选择性 )
)
(4)以 作催化剂,对反应ⅲ的机理展开研究.以
作催化剂,对反应ⅲ的机理展开研究.以 和
和 为原料,初期产物中没有检测到
为原料,初期产物中没有检测到 ;以含有
;以含有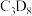 的
的 和
和 为原料,反应过程中没有检测到
为原料,反应过程中没有检测到 。下列推断合理的是
。下列推断合理的是________ (填标号)
A. 先吸附氧气,吸附的氧气直接与吸附的丙烷反应
先吸附氧气,吸附的氧气直接与吸附的丙烷反应
B. 直接氧化吸附的丙烷,吸附的氧气补充
直接氧化吸附的丙烷,吸附的氧气补充 中反应掉的氧
中反应掉的氧
C. 催化丙烷脱氢过程中,碳氢键的断裂是可逆的
催化丙烷脱氢过程中,碳氢键的断裂是可逆的
(5)用 替换
替换 ,进行氧化丙烷脱氢,可避免丙烷深度氧化、
,进行氧化丙烷脱氢,可避免丙烷深度氧化、 资源化利用等优势。
资源化利用等优势。
①结合键能数据分析 氧化丙烷脱氢反应的挑战和难点
氧化丙烷脱氢反应的挑战和难点________________ 。
② 也可以进行氧化乙苯脱氢制取苯乙烯,
也可以进行氧化乙苯脱氢制取苯乙烯, 参与的乙苯脱氢机理如图所示(
参与的乙苯脱氢机理如图所示( ,
, 表示乙苯分子中C或H原子的位置;A、B为催化剂的活性位点,其中A位点带部分正电荷,
表示乙苯分子中C或H原子的位置;A、B为催化剂的活性位点,其中A位点带部分正电荷, 、
、 位点带部分负电荷)。
位点带部分负电荷)。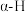 带部分正电荷,被带部分负电荷的
带部分正电荷,被带部分负电荷的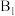 位点吸引,随后解离出
位点吸引,随后解离出 并吸附在
并吸附在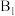 位点上;步骤Ⅱ可描述为:
位点上;步骤Ⅱ可描述为:________________ 。
反应ⅰ(直接脱氢):


反应ⅱ:


(1)已知下列键能数据,结合反应ⅰ数据,计算
 的键能是
的键能是 。
。化学键 |
|
|
|
|
键能( | 347.7 | 413.4 | 436.0 | 745 |
(2)计算反应ⅲ(
 氧化丙烷脱氢):
氧化丙烷脱氢): 的
的
 。
。(3)
 催化丙烷直接脱氢的主要副反应为
催化丙烷直接脱氢的主要副反应为 。
。①一定温度下,向恒容容器中充入一定量丙烷,在
 催化作用下脱氢制丙烯,下列情况表明反应达到平衡状态的是
催化作用下脱氢制丙烯,下列情况表明反应达到平衡状态的是A.气体密度不再改变
B.气体平均摩尔质量不再改变
C.体系压强不再改变
D.单位时间内消耗
 的物质的量与生成
的物质的量与生成 的物质的量相等
的物质的量相等②
 下,在
下,在 容器中充入
容器中充入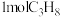 ,
,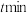 后达到平衡状态时,
后达到平衡状态时, 转化率为
转化率为 ,
, 选择性为
选择性为 ,则
,则 的消耗速率
的消耗速率
 ,丙烷脱氢反应的平衡常数
,丙烷脱氢反应的平衡常数
 选择性
选择性 )
)(4)以
 作催化剂,对反应ⅲ的机理展开研究.以
作催化剂,对反应ⅲ的机理展开研究.以 和
和 为原料,初期产物中没有检测到
为原料,初期产物中没有检测到 ;以含有
;以含有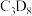 的
的 和
和 为原料,反应过程中没有检测到
为原料,反应过程中没有检测到 。下列推断合理的是
。下列推断合理的是A.
 先吸附氧气,吸附的氧气直接与吸附的丙烷反应
先吸附氧气,吸附的氧气直接与吸附的丙烷反应B.
 直接氧化吸附的丙烷,吸附的氧气补充
直接氧化吸附的丙烷,吸附的氧气补充 中反应掉的氧
中反应掉的氧C.
 催化丙烷脱氢过程中,碳氢键的断裂是可逆的
催化丙烷脱氢过程中,碳氢键的断裂是可逆的(5)用
 替换
替换 ,进行氧化丙烷脱氢,可避免丙烷深度氧化、
,进行氧化丙烷脱氢,可避免丙烷深度氧化、 资源化利用等优势。
资源化利用等优势。①结合键能数据分析
 氧化丙烷脱氢反应的挑战和难点
氧化丙烷脱氢反应的挑战和难点②
 也可以进行氧化乙苯脱氢制取苯乙烯,
也可以进行氧化乙苯脱氢制取苯乙烯, 参与的乙苯脱氢机理如图所示(
参与的乙苯脱氢机理如图所示( ,
, 表示乙苯分子中C或H原子的位置;A、B为催化剂的活性位点,其中A位点带部分正电荷,
表示乙苯分子中C或H原子的位置;A、B为催化剂的活性位点,其中A位点带部分正电荷, 、
、 位点带部分负电荷)。
位点带部分负电荷)。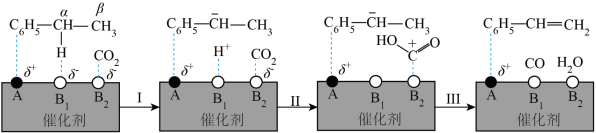
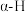 带部分正电荷,被带部分负电荷的
带部分正电荷,被带部分负电荷的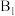 位点吸引,随后解离出
位点吸引,随后解离出 并吸附在
并吸附在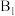 位点上;步骤Ⅱ可描述为:
位点上;步骤Ⅱ可描述为:
您最近一年使用:0次
5 .  和
和 催化耦合脱氢制备丙烯是实现碳中和的有效途径之一,其微观过程示意如图1。
催化耦合脱氢制备丙烯是实现碳中和的有效途径之一,其微观过程示意如图1。 的量不变,向体积相同的恒容密闭容器中分别通入
的量不变,向体积相同的恒容密闭容器中分别通入 为0:1、1:1、2:1、3:1的
为0:1、1:1、2:1、3:1的 的混合气,测得
的混合气,测得 的平衡转化率随温度的变化曲线如图2。
的平衡转化率随温度的变化曲线如图2。
Ⅰ.
Ⅱ.
Ⅲ.
(1) =
=___________ 。
(2)① =1:1对应图中曲线
=1:1对应图中曲线___________ (填序号)。
②900K下,曲线b、c、d的平衡转化率显著大于a的原理为___________ 。
(3)900K,将 =3:1的混合气通入恒容密闭容器中进行反应。
=3:1的混合气通入恒容密闭容器中进行反应。
①下列说法正确的是___________ (填序号)。
A.通入氩气可提高 的平衡转化率
的平衡转化率
B.体系达到平衡时,若缩小容器容积,反应Ⅱ平衡不移动
C.当 和
和 的比值不变时,体系达到平衡
的比值不变时,体系达到平衡
D.改善催化剂的性能可提高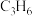 生产效率
生产效率
②若初始压强为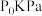 ,t min时达到平衡,此时
,t min时达到平衡,此时 分压是CO的5倍,0~t min内
分压是CO的5倍,0~t min内 =
=___________  ;反应Ⅰ的压强平衡常数
;反应Ⅰ的压强平衡常数 =
=___________ 。
(4)利用反应 可制备高纯Ni。
可制备高纯Ni。
① 晶体中不存在的作用力有
晶体中不存在的作用力有___________ 。
A.离子键 B.π键 C.范德华力 D.极性键 E.金属键
② 中Ni为
中Ni为 杂化,配位原子是
杂化,配位原子是___________ ,判断依据是___________ 。
 和
和 催化耦合脱氢制备丙烯是实现碳中和的有效途径之一,其微观过程示意如图1。
催化耦合脱氢制备丙烯是实现碳中和的有效途径之一,其微观过程示意如图1。
 的量不变,向体积相同的恒容密闭容器中分别通入
的量不变,向体积相同的恒容密闭容器中分别通入 为0:1、1:1、2:1、3:1的
为0:1、1:1、2:1、3:1的 的混合气,测得
的混合气,测得 的平衡转化率随温度的变化曲线如图2。
的平衡转化率随温度的变化曲线如图2。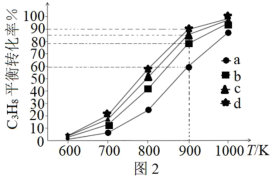
Ⅰ.

Ⅱ.

Ⅲ.

(1)
 =
=(2)①
 =1:1对应图中曲线
=1:1对应图中曲线②900K下,曲线b、c、d的平衡转化率显著大于a的原理为
(3)900K,将
 =3:1的混合气通入恒容密闭容器中进行反应。
=3:1的混合气通入恒容密闭容器中进行反应。①下列说法正确的是
A.通入氩气可提高
 的平衡转化率
的平衡转化率B.体系达到平衡时,若缩小容器容积,反应Ⅱ平衡不移动
C.当
 和
和 的比值不变时,体系达到平衡
的比值不变时,体系达到平衡D.改善催化剂的性能可提高
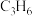 生产效率
生产效率②若初始压强为
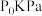 ,t min时达到平衡,此时
,t min时达到平衡,此时 分压是CO的5倍,0~t min内
分压是CO的5倍,0~t min内 =
= ;反应Ⅰ的压强平衡常数
;反应Ⅰ的压强平衡常数 =
=(4)利用反应
 可制备高纯Ni。
可制备高纯Ni。①
 晶体中不存在的作用力有
晶体中不存在的作用力有A.离子键 B.π键 C.范德华力 D.极性键 E.金属键
②
 中Ni为
中Ni为 杂化,配位原子是
杂化,配位原子是
您最近一年使用:0次
6 . 甲硫醇(CH3SH)是重要的有机化工中间体,可用于合成维生素。通过CH3OH和H2S合成CH3SH的主要反应为:
Ⅰ.
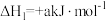
Ⅱ.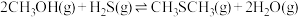
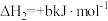
回答下列问题:
(1)计算反应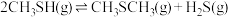 的△H=
的△H=________ kJ/mol。
(2)T1℃时,向恒容密闭容器中充入一定量CH3OH(g)和H2S(g)发生反应,下列事实能说明反应达到平衡状态的是________ (填选项字母);若按相同比例再充入一定量CH3OH(g)和H2S(g),CH3OH(g)的平衡转化率将________ (填“变大”“变小”或“不变”)。
A.容器内气体密度不再发生变化 B.混合气体的平均相对分子质量不再发生变化
C.H2S(g)的体积分数不再发生变化 D.CH3SCH3(g)和H2O(g)的物质的量之比不再变化
(3)T2℃时,向压强为P0的恒压密闭容器中按物质的量之比为1:2充入CH3OH(g)和H2S(g)发生反应,达到平衡时,CH3OH(g)的转化率为80%,CH3SCH3(g)的体积分数为5%。
①计算H2S(g)的选择性为________ (CH3SH的选择性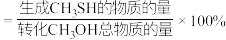 )。
)。
②反应Ⅰ的平衡常数Kp=________ (Kp是用分压表示的平衡常数,结果保留两位小数)。
(4)在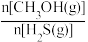 =1:2、反应压力为0.7Mpa条件下,气体按90 mL/min的速率通过催化剂表面发生反应,每分钟反应体系中CH3OH(g)转化率、CH3SH(g)选择性随温度的变化如图甲所示,催化机理如图乙所示。
=1:2、反应压力为0.7Mpa条件下,气体按90 mL/min的速率通过催化剂表面发生反应,每分钟反应体系中CH3OH(g)转化率、CH3SH(g)选择性随温度的变化如图甲所示,催化机理如图乙所示。________ Mpa/min(结果保留两位有效数字)。
②当温度高于370℃时,CH3OH(g)转化率随温度升高而降低的原因可能为________ 。
③从电负性的角度描述ⅲ→ⅰ中脱水的过程:________ 。
Ⅰ.

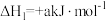
Ⅱ.
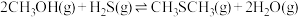
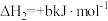
回答下列问题:
(1)计算反应
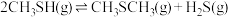 的△H=
的△H=(2)T1℃时,向恒容密闭容器中充入一定量CH3OH(g)和H2S(g)发生反应,下列事实能说明反应达到平衡状态的是
A.容器内气体密度不再发生变化 B.混合气体的平均相对分子质量不再发生变化
C.H2S(g)的体积分数不再发生变化 D.CH3SCH3(g)和H2O(g)的物质的量之比不再变化
(3)T2℃时,向压强为P0的恒压密闭容器中按物质的量之比为1:2充入CH3OH(g)和H2S(g)发生反应,达到平衡时,CH3OH(g)的转化率为80%,CH3SCH3(g)的体积分数为5%。
①计算H2S(g)的选择性为
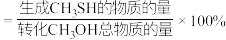 )。
)。②反应Ⅰ的平衡常数Kp=
(4)在
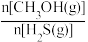 =1:2、反应压力为0.7Mpa条件下,气体按90 mL/min的速率通过催化剂表面发生反应,每分钟反应体系中CH3OH(g)转化率、CH3SH(g)选择性随温度的变化如图甲所示,催化机理如图乙所示。
=1:2、反应压力为0.7Mpa条件下,气体按90 mL/min的速率通过催化剂表面发生反应,每分钟反应体系中CH3OH(g)转化率、CH3SH(g)选择性随温度的变化如图甲所示,催化机理如图乙所示。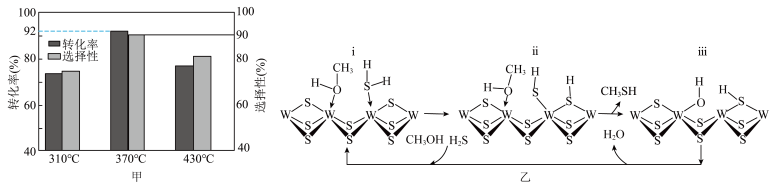
②当温度高于370℃时,CH3OH(g)转化率随温度升高而降低的原因可能为
③从电负性的角度描述ⅲ→ⅰ中脱水的过程:
您最近一年使用:0次
名校
7 . 化学反应过程既有物质变化也有能量变化。
Ⅰ.关于工业合成氨的反应,已知H-H键、N-H键、N≡N键的键能分别为436 、391
、391 、946
、946 。请根据键能的数据判断下列问题。
。请根据键能的数据判断下列问题。
(1)由 和
和 合成氨时,需要
合成氨时,需要_____________ (填“吸收”或“放出”)能量,写出该反应的热化学方程式_________________ 。
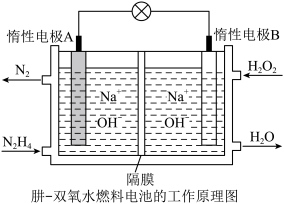
Ⅱ.原电池是化学能转化为电能的装置。
(2)肼(液态)—过氧化氢碱性燃料电池由于其较高的能量密度而备受关注,其工作原理如图。_______ (填“氧化反应”或“还原反应”),电池工作过程中, 向极移动
向极移动_________ (填“A”或“B”);
②该燃料电池的总反应方程式可表示为__________ 。在标准状况下,若A极区产生11.2L  ,则外电路中理论上通过的电子的物质的量是
,则外电路中理论上通过的电子的物质的量是__________ mol。
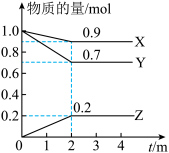
Ⅲ.某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:_____________ 。
(4)反应开始至2min,以气体X表示的平均反应速率为___________ 。
(5)下列措施能增大反应速率的是_________ 。
A.升高温度 B.加入高效催化剂
C.持容器压强不变,充入一定量氦气 D.保持容器容积不变,充入气体X
E.保持容器容积不变,充入一定量氦气
(6)能说明上述反应达到平衡状态的是 。(填字母)
Ⅰ.关于工业合成氨的反应,已知H-H键、N-H键、N≡N键的键能分别为436
 、391
、391 、946
、946 。请根据键能的数据判断下列问题。
。请根据键能的数据判断下列问题。(1)由
 和
和 合成氨时,需要
合成氨时,需要Ⅱ.原电池是化学能转化为电能的装置。
(2)肼(液态)—过氧化氢碱性燃料电池由于其较高的能量密度而备受关注,其工作原理如图。
 向极移动
向极移动②该燃料电池的总反应方程式可表示为
 ,则外电路中理论上通过的电子的物质的量是
,则外电路中理论上通过的电子的物质的量是Ⅲ.某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
(4)反应开始至2min,以气体X表示的平均反应速率为
(5)下列措施能增大反应速率的是
A.升高温度 B.加入高效催化剂
C.持容器压强不变,充入一定量氦气 D.保持容器容积不变,充入气体X
E.保持容器容积不变,充入一定量氦气
(6)能说明上述反应达到平衡状态的是 。(填字母)
| A.混合气体的压强不随时间的变化而变化 | B. |
| C.X体积分数保持不变 | D.混合气体的密度不随时间的变化而变化 |
您最近一年使用:0次
名校
8 . 一定条件下,对于反应 ,若X、Y、Z的起始浓度分别为
,若X、Y、Z的起始浓度分别为 、
、 、
、 (均不为零)。达到平衡时,X、Y、Z的浓度分别为0.1
(均不为零)。达到平衡时,X、Y、Z的浓度分别为0.1 、0.3
、0.3 和0.08
和0.08 ,则下列判断合理的是
,则下列判断合理的是
①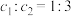
②平衡时,Y和Z的生成速率之比为2∶3
③X和Y转化量之比为1∶1
④ 的取值范围为
的取值范围为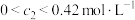
 ,若X、Y、Z的起始浓度分别为
,若X、Y、Z的起始浓度分别为 、
、 、
、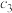 (均不为零)。达到平衡时,X、Y、Z的浓度分别为0.1
(均不为零)。达到平衡时,X、Y、Z的浓度分别为0.1 、0.3
、0.3 和0.08
和0.08 ,则下列判断合理的是
,则下列判断合理的是①
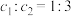
②平衡时,Y和Z的生成速率之比为2∶3
③X和Y转化量之比为1∶1
④
 的取值范围为
的取值范围为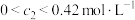
| A.①② | B.①④ | C.②③ | D.③④ |
您最近一年使用:0次
9 . Ⅰ。在下列事实中,什么因素影响了化学反应速率?
(1)集气瓶中有 和
和 的混合气体,在瓶外点燃镁条时发生爆炸
的混合气体,在瓶外点燃镁条时发生爆炸___________ ;
黄铁矿煅烧时要粉碎成细小的矿粒。___________ ;
熔化的 放出气泡很慢,加入少量
放出气泡很慢,加入少量 后很快产生气体。
后很快产生气体。___________ ;
夏天食品容易变质,冬天就不易发生该现象。___________ ;
同样大小的石灰石分别在 的盐酸和
的盐酸和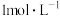 的盐酸中反应,反应速率不同。
的盐酸中反应,反应速率不同。___________ 。
Ⅱ。某温度时,在 密闭容器中
密闭容器中 三种气态物质的物质的量
三种气态物质的物质的量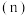 随时间
随时间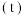 变化的曲线如图所示,由图中数据分析:
变化的曲线如图所示,由图中数据分析:___________ 。
(3)反应开始至 ,用
,用 表示的平均反应速率为
表示的平均反应速率为___________ 。此时, 的转化率为
的转化率为___________ 。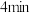 时,加入1体积
时,加入1体积 ,反应速率
,反应速率___________ (填“变大”、“变小”、“不变”)
(4)下列叙述不能说明上述反应达到化学平衡状态的是___________ (填序号)。
A. 的物质的量不随时间变化而变化
的物质的量不随时间变化而变化
B. 的质量分数不随时间变化而变化
的质量分数不随时间变化而变化
C.混合气体的总物质的量不随时间变化而变化
D.
E.
F.单位时间内每消耗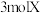 ,同时生成
,同时生成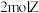
(1)集气瓶中有
 和
和 的混合气体,在瓶外点燃镁条时发生爆炸
的混合气体,在瓶外点燃镁条时发生爆炸黄铁矿煅烧时要粉碎成细小的矿粒。
熔化的
 放出气泡很慢,加入少量
放出气泡很慢,加入少量 后很快产生气体。
后很快产生气体。夏天食品容易变质,冬天就不易发生该现象。
同样大小的石灰石分别在
 的盐酸和
的盐酸和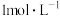 的盐酸中反应,反应速率不同。
的盐酸中反应,反应速率不同。Ⅱ。某温度时,在
 密闭容器中
密闭容器中 三种气态物质的物质的量
三种气态物质的物质的量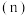 随时间
随时间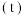 变化的曲线如图所示,由图中数据分析:
变化的曲线如图所示,由图中数据分析: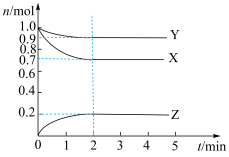
(3)反应开始至
 ,用
,用 表示的平均反应速率为
表示的平均反应速率为 的转化率为
的转化率为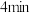 时,加入1体积
时,加入1体积 ,反应速率
,反应速率(4)下列叙述不能说明上述反应达到化学平衡状态的是
A.
 的物质的量不随时间变化而变化
的物质的量不随时间变化而变化 B.
 的质量分数不随时间变化而变化
的质量分数不随时间变化而变化C.混合气体的总物质的量不随时间变化而变化
D.

E.

F.单位时间内每消耗
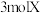 ,同时生成
,同时生成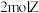
您最近一年使用:0次
10 . 对于在一定条件下的密闭容器中进行的反应 ,下列说法不正确的是
,下列说法不正确的是
 ,下列说法不正确的是
,下列说法不正确的是| A.将木炭磨成粉末可以加快反应速率 | B.升高温度可以加快反应速率 |
C.容器体积不变时,向其中充入 ,反应速率不变 ,反应速率不变 | D.容器中物质总质量不变可说明反应达到平衡 |
您最近一年使用:0次

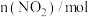
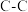



 )
)

