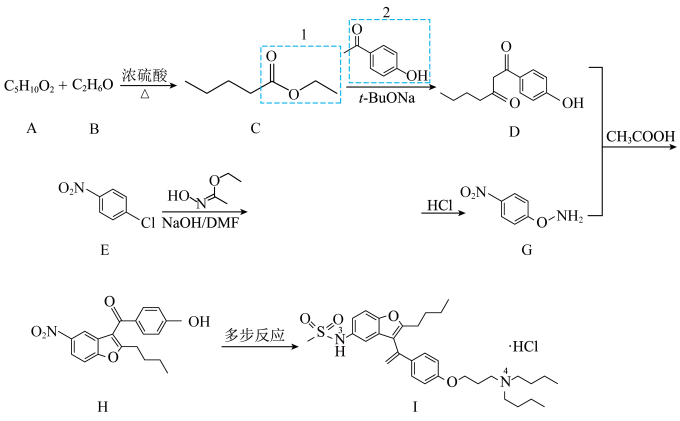
1 . 抗心律失常药物盐酸决奈达隆(Ⅰ)的合成路线如下。 的反应类型为
的反应类型为___________ 。
(2) 同时生成
同时生成 。
。
①D中官能团的名称是___________ 。
②吸电子能力:1号基团___________ 2号基团(填“>”或“<”)。
(3) 的化学方程式为
的化学方程式为___________ 。
(4)G的同分异构体中符合以下条件的有___________ 种。
①含有苯环和硝基。
②遇 溶液显紫色。
溶液显紫色。
③该有机物具有两性。
(5)结合平衡移动原理说明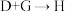 中
中 的作用为
的作用为___________ 。
(6)I中3号N的杂化类型为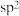 ,4号N的杂化类型为
,4号N的杂化类型为___________ ;更易与 结合的为
结合的为___________ N(填“3号”或“4号”),原因是___________ 。
 的反应类型为
的反应类型为(2)
 同时生成
同时生成 。
。①D中官能团的名称是
②吸电子能力:1号基团
(3)
 的化学方程式为
的化学方程式为(4)G的同分异构体中符合以下条件的有
①含有苯环和硝基。
②遇
 溶液显紫色。
溶液显紫色。③该有机物具有两性。
(5)结合平衡移动原理说明
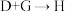 中
中 的作用为
的作用为(6)I中3号N的杂化类型为
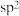 ,4号N的杂化类型为
,4号N的杂化类型为 结合的为
结合的为
您最近一年使用:0次
2 . 某光敏剂的结构如图。前四周期元素X、Y、Z、W、Q的原子半径依次增大,X、Z、W、Q位于不同周期。下列说法错误的是
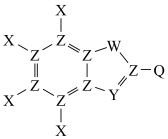
A.第一电离能: |
| B.Q的单质颜色为深红棕色 |
C.沸点: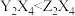 |
D.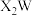 形成四面体形的VSEPR模型 形成四面体形的VSEPR模型 |
您最近一年使用:0次
3 . 可利用干法热分解法和湿法催化氧化法高效脱除沼气中的 。
。
(1)已知:部分键能数据为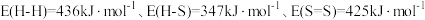 。
。
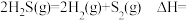
___________  。
。
(2)干法热分解法原理为 。向体积为
。向体积为 恒容容器中充入
恒容容器中充入 ,初始压强为
,初始压强为 ,平衡时体系中各物质
,平衡时体系中各物质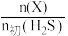 随温度t的变化如图。
随温度t的变化如图。 对应图中的曲线是
对应图中的曲线是___________ (填字母),结合平衡移动原理说明理由。___________
②t1℃时, 的平衡转化率为
的平衡转化率为___________ ,分压平衡常数
___________ (以分压表示,分压=总压×物质的量分数,列计算式即可)。
(3)湿法催化氧化法高效脱除 的过程如下。
的过程如下。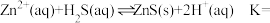
___________ 。(已知:25℃时, 的
的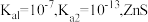 的
的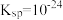 )
)
②“氧化沉硫”中发生反应的离子方程式有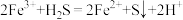 、
、___________ 。
③ 对脱硫效率影响如图。随着
对脱硫效率影响如图。随着 增大,脱硫效率趋于平缓的原因是
增大,脱硫效率趋于平缓的原因是___________ 。___________ (填化学式)。
(4)相比湿法催化氧化法,干法热分解法的优点是___________ ,缺点是___________ 。
 。
。(1)已知:部分键能数据为
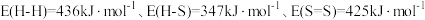 。
。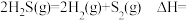
 。
。(2)干法热分解法原理为
 。向体积为
。向体积为 恒容容器中充入
恒容容器中充入 ,初始压强为
,初始压强为 ,平衡时体系中各物质
,平衡时体系中各物质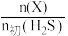 随温度t的变化如图。
随温度t的变化如图。
 对应图中的曲线是
对应图中的曲线是②t1℃时,
 的平衡转化率为
的平衡转化率为
(3)湿法催化氧化法高效脱除
 的过程如下。
的过程如下。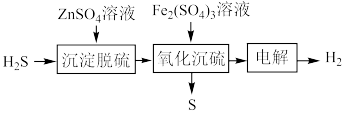
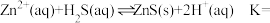
 的
的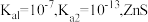 的
的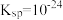 )
)②“氧化沉硫”中发生反应的离子方程式有
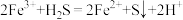 、
、③
 对脱硫效率影响如图。随着
对脱硫效率影响如图。随着 增大,脱硫效率趋于平缓的原因是
增大,脱硫效率趋于平缓的原因是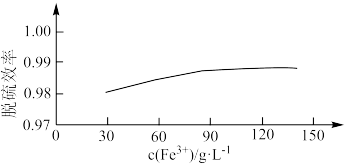
(4)相比湿法催化氧化法,干法热分解法的优点是
您最近一年使用:0次
4 . 在浓硫酸作用下,苯与浓硝酸发生反应的反应历程如图。下列说法错误的是
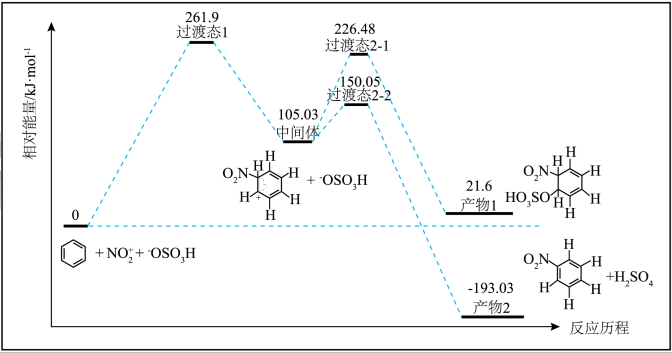
| A.生成中间体时碳的杂化方式未发生改变 |
| B.生成中间体的反应为决速步骤 |
| C.产物1为加成反应的产物 |
| D.动力学和热力学优势产物均为产物2 |
您最近一年使用:0次
5 . 乌苯美司用作治疗肿瘤的辅助作用剂,其结构如图所示。下列说法错误的是
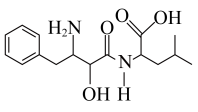
| A.分子中含有3个手性碳原子 | B.分子中含4种官能团 |
| C.1mol乌苯美司最多能消耗3molNaOH | D.乌苯美司的分子式为C16H24N2O4 |
您最近一年使用:0次
解题方法
6 . 丙氨酸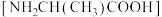 是人体内重要的氨基酸。25℃时,
是人体内重要的氨基酸。25℃时,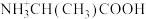 、
、 、
、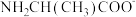 的分布分数[如
的分布分数[如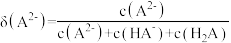 ]与
]与 关系如图。下列说法错误的是
关系如图。下列说法错误的是
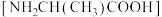 是人体内重要的氨基酸。25℃时,
是人体内重要的氨基酸。25℃时,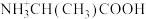 、
、 、
、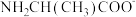 的分布分数[如
的分布分数[如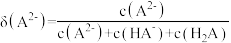 ]与
]与 关系如图。下列说法错误的是
关系如图。下列说法错误的是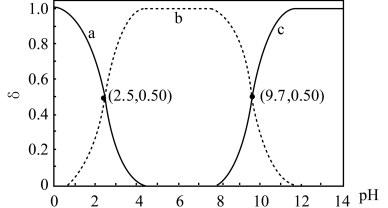
A.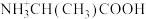 中 中 电离能力强于 电离能力强于 |
B. 时,丙氨酸微粒无法在电场作用下定向移动 时,丙氨酸微粒无法在电场作用下定向移动 |
C.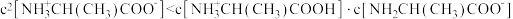 |
D.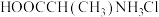 溶液中 溶液中 |
您最近一年使用:0次
解题方法
7 . 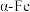 晶体为体心立方晶胞结构。
晶体为体心立方晶胞结构。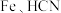 与
与 在一定条件下发生如下反应:
在一定条件下发生如下反应: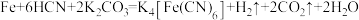 。
。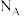 是阿伏加德罗常数的值。下列说法错误的是
是阿伏加德罗常数的值。下列说法错误的是
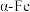 晶体为体心立方晶胞结构。
晶体为体心立方晶胞结构。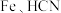 与
与 在一定条件下发生如下反应:
在一定条件下发生如下反应: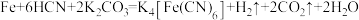 。
。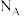 是阿伏加德罗常数的值。下列说法错误的是
是阿伏加德罗常数的值。下列说法错误的是A. 的 的 溶液中 溶液中 数目为 数目为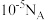 |
B.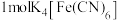 中配位键数为 中配位键数为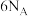 |
C.生成 (标准状况) (标准状况) ,转移电子数为 ,转移电子数为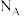 |
D.1个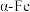 晶胞质量为 晶胞质量为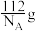 |
您最近一年使用:0次
8 .  和
和 催化耦合脱氢制备丙烯是实现碳中和的有效途径之一,其微观过程示意如图1。
催化耦合脱氢制备丙烯是实现碳中和的有效途径之一,其微观过程示意如图1。 的量不变,向体积相同的恒容密闭容器中分别通入
的量不变,向体积相同的恒容密闭容器中分别通入 为0:1、1:1、2:1、3:1的
为0:1、1:1、2:1、3:1的 的混合气,测得
的混合气,测得 的平衡转化率随温度的变化曲线如图2。
的平衡转化率随温度的变化曲线如图2。
Ⅰ.
Ⅱ.
Ⅲ.
(1) =
=___________ 。
(2)① =1:1对应图中曲线
=1:1对应图中曲线___________ (填序号)。
②900K下,曲线b、c、d的平衡转化率显著大于a的原理为___________ 。
(3)900K,将 =3:1的混合气通入恒容密闭容器中进行反应。
=3:1的混合气通入恒容密闭容器中进行反应。
①下列说法正确的是___________ (填序号)。
A.通入氩气可提高 的平衡转化率
的平衡转化率
B.体系达到平衡时,若缩小容器容积,反应Ⅱ平衡不移动
C.当 和
和 的比值不变时,体系达到平衡
的比值不变时,体系达到平衡
D.改善催化剂的性能可提高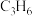 生产效率
生产效率
②若初始压强为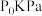 ,t min时达到平衡,此时
,t min时达到平衡,此时 分压是CO的5倍,0~t min内
分压是CO的5倍,0~t min内 =
=___________  ;反应Ⅰ的压强平衡常数
;反应Ⅰ的压强平衡常数 =
=___________ 。
(4)利用反应 可制备高纯Ni。
可制备高纯Ni。
① 晶体中不存在的作用力有
晶体中不存在的作用力有___________ 。
A.离子键 B.π键 C.范德华力 D.极性键 E.金属键
② 中Ni为
中Ni为 杂化,配位原子是
杂化,配位原子是___________ ,判断依据是___________ 。
 和
和 催化耦合脱氢制备丙烯是实现碳中和的有效途径之一,其微观过程示意如图1。
催化耦合脱氢制备丙烯是实现碳中和的有效途径之一,其微观过程示意如图1。
 的量不变,向体积相同的恒容密闭容器中分别通入
的量不变,向体积相同的恒容密闭容器中分别通入 为0:1、1:1、2:1、3:1的
为0:1、1:1、2:1、3:1的 的混合气,测得
的混合气,测得 的平衡转化率随温度的变化曲线如图2。
的平衡转化率随温度的变化曲线如图2。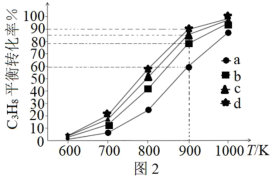
Ⅰ.

Ⅱ.

Ⅲ.

(1)
 =
=(2)①
 =1:1对应图中曲线
=1:1对应图中曲线②900K下,曲线b、c、d的平衡转化率显著大于a的原理为
(3)900K,将
 =3:1的混合气通入恒容密闭容器中进行反应。
=3:1的混合气通入恒容密闭容器中进行反应。①下列说法正确的是
A.通入氩气可提高
 的平衡转化率
的平衡转化率B.体系达到平衡时,若缩小容器容积,反应Ⅱ平衡不移动
C.当
 和
和 的比值不变时,体系达到平衡
的比值不变时,体系达到平衡D.改善催化剂的性能可提高
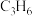 生产效率
生产效率②若初始压强为
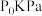 ,t min时达到平衡,此时
,t min时达到平衡,此时 分压是CO的5倍,0~t min内
分压是CO的5倍,0~t min内 =
= ;反应Ⅰ的压强平衡常数
;反应Ⅰ的压强平衡常数 =
=(4)利用反应
 可制备高纯Ni。
可制备高纯Ni。①
 晶体中不存在的作用力有
晶体中不存在的作用力有A.离子键 B.π键 C.范德华力 D.极性键 E.金属键
②
 中Ni为
中Ni为 杂化,配位原子是
杂化,配位原子是
您最近一年使用:0次
名校
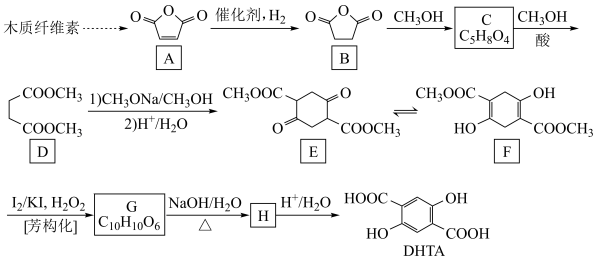
9 . 2,5—二羟基对苯二甲酸(DHTA)是一种重要的化工原料,广泛用于合成高性能有机颜料及光敏聚合物;作为钠离子电池的正、负电极材料也表现出优异的性能。利用生物质资源合成DHTA的路线如下:
(1)A→B的反应类型为___________ 。
(2)C的结构简式为___________ 。
(3)D的化学名称为___________ 。
(4)G→H的化学方程式为___________ 。
(5)写出一种能同时满足下列条件的G的同分异构体的结构简式___________ 。
(a)核磁共振氢谱有两组峰,且峰面积比为3:2;
(b)红外光谱中存在 吸收峰,但没有
吸收峰,但没有 吸收峰;
吸收峰;
(c)可与NaOH水溶液反应,反应液酸化后可与 溶液发生显色反应。
溶液发生显色反应。
(6)阿伏苯宗(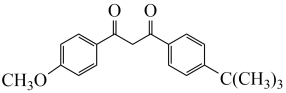 )是防晒霜的添加剂之一、以碘甲烷(
)是防晒霜的添加剂之一、以碘甲烷( )、对羟基苯乙酮(
)、对羟基苯乙酮(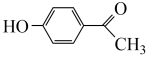 )和对叔丁基甲苯(
)和对叔丁基甲苯(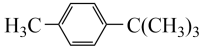 )为原料,合成阿伏苯宗的路线如下。
)为原料,合成阿伏苯宗的路线如下。___________ ;N___________ ;Q___________ 。
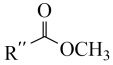
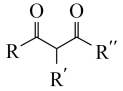
已知: +
+

(1)A→B的反应类型为
(2)C的结构简式为
(3)D的化学名称为
(4)G→H的化学方程式为
(5)写出一种能同时满足下列条件的G的同分异构体的结构简式
(a)核磁共振氢谱有两组峰,且峰面积比为3:2;
(b)红外光谱中存在
 吸收峰,但没有
吸收峰,但没有 吸收峰;
吸收峰;(c)可与NaOH水溶液反应,反应液酸化后可与
 溶液发生显色反应。
溶液发生显色反应。(6)阿伏苯宗(
 )是防晒霜的添加剂之一、以碘甲烷(
)是防晒霜的添加剂之一、以碘甲烷( )、对羟基苯乙酮(
)、对羟基苯乙酮( )和对叔丁基甲苯(
)和对叔丁基甲苯( )为原料,合成阿伏苯宗的路线如下。
)为原料,合成阿伏苯宗的路线如下。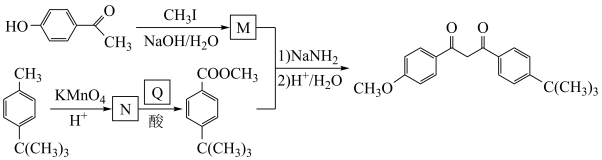
您最近一年使用:0次
10 . 以某四氯化钛精制厂的尾渣(主要含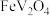 、
、 、NaCl及少量的
、NaCl及少量的 、
、 等)为原料制备
等)为原料制备 的工艺流程如下:
的工艺流程如下: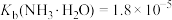 ;
; ;
;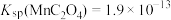
(1)“水洗”的目的为___________ 。“水洗”和“酸浸”后均采用减压过滤,与常压过滤相比,其优点为___________ 。
(2)“焙烧”的目的是将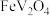 转化为
转化为 和可溶于水的
和可溶于水的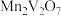 ,以利于“酸浸”时钒浸出。
,以利于“酸浸”时钒浸出。
①该反应的化学方程式为___________ 。
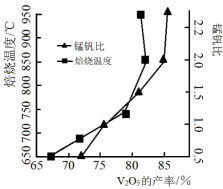
②钒浸出率与焙烧温度、锰钒比的关系如图所示。“焙烧”的最佳温度和锰钒比分别为___________ 、___________ 温度不宜过低的可能原因为___________ 。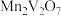 与
与 按物质的量比1:1进行反应的离子方程式为
按物质的量比1:1进行反应的离子方程式为___________
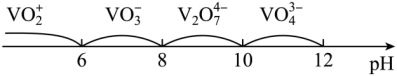
(4)“沉钒”时,在25℃下维持溶液pH=7,向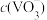 =0.2
=0.2 的酸浸液中加入等体积的
的酸浸液中加入等体积的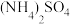 溶液进行反应(忽略溶液混合时体积的变化),反应后溶液中
溶液进行反应(忽略溶液混合时体积的变化),反应后溶液中 =0.005
=0.005 ,则沉钒率为
,则沉钒率为___________ %。
(5)“煅烧”所得 可制成铝钒合金(
可制成铝钒合金(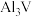 ),其晶胞结构如图所示。用原子的分数坐标可以表示晶胞中各原子的位置,如A点原子的分数坐标为
),其晶胞结构如图所示。用原子的分数坐标可以表示晶胞中各原子的位置,如A点原子的分数坐标为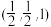 。
。___________ 。
②B点原子的分数坐标为(1, ,
,___________ )(用含b、c的代数式表示),V原子的配位数为___________ 。
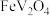 、
、 、NaCl及少量的
、NaCl及少量的 、
、 等)为原料制备
等)为原料制备 的工艺流程如下:
的工艺流程如下: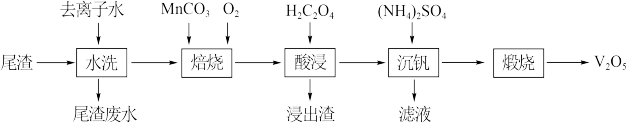
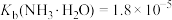 ;
; ;
;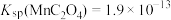
(1)“水洗”的目的为
(2)“焙烧”的目的是将
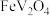 转化为
转化为 和可溶于水的
和可溶于水的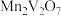 ,以利于“酸浸”时钒浸出。
,以利于“酸浸”时钒浸出。①该反应的化学方程式为
②钒浸出率与焙烧温度、锰钒比的关系如图所示。“焙烧”的最佳温度和锰钒比分别为
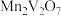 与
与 按物质的量比1:1进行反应的离子方程式为
按物质的量比1:1进行反应的离子方程式为(4)“沉钒”时,在25℃下维持溶液pH=7,向
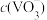 =0.2
=0.2 的酸浸液中加入等体积的
的酸浸液中加入等体积的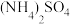 溶液进行反应(忽略溶液混合时体积的变化),反应后溶液中
溶液进行反应(忽略溶液混合时体积的变化),反应后溶液中 =0.005
=0.005 ,则沉钒率为
,则沉钒率为(5)“煅烧”所得
 可制成铝钒合金(
可制成铝钒合金(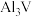 ),其晶胞结构如图所示。用原子的分数坐标可以表示晶胞中各原子的位置,如A点原子的分数坐标为
),其晶胞结构如图所示。用原子的分数坐标可以表示晶胞中各原子的位置,如A点原子的分数坐标为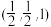 。
。
②B点原子的分数坐标为(1,
 ,
,
您最近一年使用:0次



