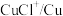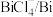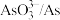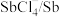名校
1 . 制取催化剂 的原理为:
的原理为: 。下列说法错误的是
。下列说法错误的是
 的原理为:
的原理为: 。下列说法错误的是
。下列说法错误的是A.基态碳原子价电子轨道表示式为 |
B. 中3p-3p轨道重叠示意图为 中3p-3p轨道重叠示意图为 |
C. 为非极性分子 为非极性分子 |
D.CO电子式为: |
您最近一年使用:0次
名校
2 . 下列关于原子核外电子排布与元素在周期表中位置关系的表述正确的是
A.原子的价电子排布式为 的元素一定是主族元素 的元素一定是主族元素 |
| B.基态原子的p能级上有5个电子的元素一定是第ⅦA族元素 |
C.原子的价电子排布式为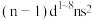 的元素一定位于第ⅢB~第ⅧB族 的元素一定位于第ⅢB~第ⅧB族 |
| D.基态原子的N层上只有1个电子的元素一定是主族元素 |
您最近一年使用:0次
3 . 下列描述正确的是
A.在中性条件下可用KSCN溶液检验补铁剂中是否含有 |
| B.可用核磁共振法测定出青蒿素的相对分子质量 |
| C.液晶属于晶体的一种,可用于制造液晶显示器 |
D. 、石墨烯、碳纳米管都是碳的同素异形体,是纳米材料中的“明星” 、石墨烯、碳纳米管都是碳的同素异形体,是纳米材料中的“明星” |
您最近一年使用:0次
名校
4 . 对于物质的结构与性质描述中,前者大于后者的是
| 结构与性质 | 前者 | 后者 | |
| A | 熔点 | 碳化硅 | 晶体硅 |
| B | 沸点 |
|
|
| C | 分子的极性 |  |  |
| D | 在水中的溶解度 |  |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
5 . 设 为阿伏加德罗常数的值,下列说法不正确的是
为阿伏加德罗常数的值,下列说法不正确的是
 为阿伏加德罗常数的值,下列说法不正确的是
为阿伏加德罗常数的值,下列说法不正确的是A.1mol甲基(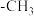 )的电子数为9 )的电子数为9 |
B.60g  晶体中含Si-O键的数目为4 晶体中含Si-O键的数目为4 |
C.1mol  分子中,S原子的价层电子对数目为2 分子中,S原子的价层电子对数目为2 |
D.标准状况下,22.4L乙烷中含有的极性键的数目为6 |
您最近一年使用:0次
名校
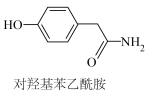
6 . 甲硝唑主要用作治疗或预防厌氧菌引起的系统或局部感染,结构简式如图所示,杂环中存在大 键。下列说法错误的是
键。下列说法错误的是
 键。下列说法错误的是
键。下列说法错误的是
A.该分子中①号 更易和盐酸形成盐,增大药物水溶性 更易和盐酸形成盐,增大药物水溶性 |
| B.该分子可发生加成反应、消去反应 |
| C.该分子中含有两种含氧官能团 |
| D.该分子是极性分子 |
您最近一年使用:0次
名校
7 . 下列化学用语表达正确的是
A.乙酸的分子式: | B. 的电子式: 的电子式: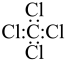 |
C.甲烷分子的空间填充模型: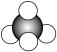 | D.乙烯的结构简式: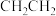 |
您最近一年使用:0次
8 . 下列化学用语正确的是
A.乙烯分子的空间填充模型: |
B.甲基的电子式: |
C.聚丙烯的结构简式: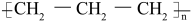 |
D.烷烃的通式: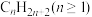 |
您最近一年使用:0次
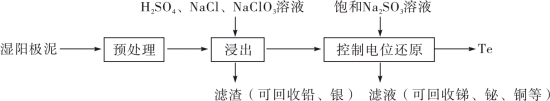
9 . 碲(Te)是一种重要的稀有分散元素,广泛应用于冶金、石油、化工、航空、电子等领域。以某冶炼厂的湿阳极泥(含水26%,主要含锑、砷、铅、铋、银和少量铜、碲等)为原料回收碲的流程如下:
请回答下列问题:
(1)52Te的基态原子的电子排布式为___________ 。
(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是_______________ ;氧化后的原料还需粉碎、过筛,目的是_________________ 。
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为___________ 、___________ ;添加 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、 而被浸出的离子方程式
而被浸出的离子方程式________________ 。
(4)电解时为防止除Te以外的单质生成,需控制电位的范围为___________ ;加入饱和Na2SO3溶液还原 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成_____________ (填化学式)。
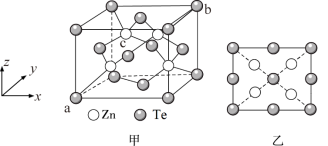
(5)将碲与锌一起加热,然后升华可制得碲化锌。碲化锌是一种重要的半导体材料,图甲为它的一种立方晶胞结构,图乙为该晶胞沿z轴投影图。已知a点的坐标为(0,0,0),b点的坐标为(1,1,1),则c点的坐标为_______________ ,设ZnTe的摩尔质量为M,阿伏加德罗常数的值为NA,密度为dg/cm3,则Zn与Te最近距离为___________ nm(列出计算式即可)。
物质 |
|
|
|
|
|
氧化还原电位(E)/V | 0.342 | 0.568 | 0.16 | 小于0.16 | 小于0.16 |
(1)52Te的基态原子的电子排布式为
(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为
 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、 而被浸出的离子方程式
而被浸出的离子方程式(4)电解时为防止除Te以外的单质生成,需控制电位的范围为
 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成(5)将碲与锌一起加热,然后升华可制得碲化锌。碲化锌是一种重要的半导体材料,图甲为它的一种立方晶胞结构,图乙为该晶胞沿z轴投影图。已知a点的坐标为(0,0,0),b点的坐标为(1,1,1),则c点的坐标为
您最近一年使用:0次
7日内更新
|
50次组卷
|
2卷引用:福建省永春一中2023-2024学年高三化学最后一卷试卷
名校
解题方法
10 . 叠氮化钠 是汽车安全气囊的气体发生剂,可由
是汽车安全气囊的气体发生剂,可由 和氨基钠
和氨基钠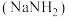 为原料加热制得,某小组对
为原料加热制得,某小组对 的制备和产品纯度测定进行相关探究。回答下列问题。
的制备和产品纯度测定进行相关探究。回答下列问题。
查阅资料:部分物质及性质
Ⅰ.制备
 ,反应的离子方程式为
,反应的离子方程式为___________ 。
(2)按气流方向,仪器口的连接顺序为a→___________ →h.
(3)装置B的生成物中除了 和
和 外,还有一种生成物是
外,还有一种生成物是___________ (填化学式)。
(4)在装置E中将氮元素转化为对环境无污染的气体,同时生成 沉淀,发生反应的化学方程式为
沉淀,发生反应的化学方程式为___________ 。
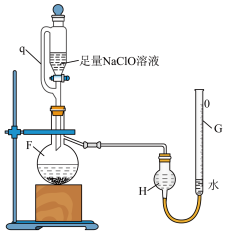
Ⅱ.用如图所示装置测定产品纯度。___________ ,恒压分液漏斗中侧管q的作用除平衡气压有利于液体顺利流下外,还有___________ 。
(6)取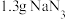 样品与足量的
样品与足量的 反应(杂质不与
反应(杂质不与 溶液反应),利用如图装置测量所得氮气的体积,初始时G、H两液面相平,G管的读数为
溶液反应),利用如图装置测量所得氮气的体积,初始时G、H两液面相平,G管的读数为 ,充分反应后,恢复至室温,移动G使两液面再次相平,G管读数为
,充分反应后,恢复至室温,移动G使两液面再次相平,G管读数为 (其中
(其中 ),则产品中
),则产品中 的质量分数为
的质量分数为___________ %(本实验条件下气体摩尔体积为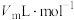 )。
)。
 是汽车安全气囊的气体发生剂,可由
是汽车安全气囊的气体发生剂,可由 和氨基钠
和氨基钠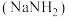 为原料加热制得,某小组对
为原料加热制得,某小组对 的制备和产品纯度测定进行相关探究。回答下列问题。
的制备和产品纯度测定进行相关探究。回答下列问题。查阅资料:部分物质及性质
| 物质 | 氨基钠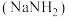 |  |  |
| 性质 | 易氧化、易潮解 | 遇强酸易爆炸 | 有强氧化性,与酸、碱不反应 |


 ,反应的离子方程式为
,反应的离子方程式为(2)按气流方向,仪器口的连接顺序为a→
(3)装置B的生成物中除了
 和
和 外,还有一种生成物是
外,还有一种生成物是(4)在装置E中将氮元素转化为对环境无污染的气体,同时生成
 沉淀,发生反应的化学方程式为
沉淀,发生反应的化学方程式为Ⅱ.用如图所示装置测定产品纯度。
(6)取
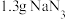 样品与足量的
样品与足量的 反应(杂质不与
反应(杂质不与 溶液反应),利用如图装置测量所得氮气的体积,初始时G、H两液面相平,G管的读数为
溶液反应),利用如图装置测量所得氮气的体积,初始时G、H两液面相平,G管的读数为 ,充分反应后,恢复至室温,移动G使两液面再次相平,G管读数为
,充分反应后,恢复至室温,移动G使两液面再次相平,G管读数为 (其中
(其中 ),则产品中
),则产品中 的质量分数为
的质量分数为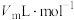 )。
)。
您最近一年使用:0次