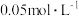1 . 利用CO2合成甲醇(CH3OH)是实现碳中和的措施之一,其反应方程式为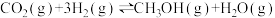 。回答下列问题:
。回答下列问题:
(1)CO2合成甲醇的能量变化如图所示。_______ 反应(填“放热”或“吸热”),反应物的化学键断裂所吸收的总能量_______ 生成物的化学键形成所释放的总能量(填“大于”或“小于”)。
(2)向2L恒容密闭容器中加入4molCO2、10molH2,恒温下发生反应,测得CO2(g)和CH3OH(g)的物质的量随时间变化如图所示。_______ 逆反应速率(填“>”、“<”或“=”)。
②0~9min内,用H2表示的平均反应速率v(H2)=_______ mol·L-1·min-1。
③下列能说明反应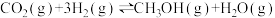 达到平衡状态的是
达到平衡状态的是_______ (填标号)。
A.混合气体的密度保持不变 B.3v正(CH3OH)=v逆(H2)
C.c(CH3OH)=c(H2O) D.2molC=O键断裂的同时生成3molH-H键
(3)以甲醇作燃料的燃料电池如图所示。_______ (填“甲醇”或“空气”);正极的电极反应式为_______ 。
②若有1molCO2生成,理论上通过质子交换膜的H+的物质的量为_______ 。
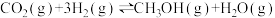 。回答下列问题:
。回答下列问题:(1)CO2合成甲醇的能量变化如图所示。

(2)向2L恒容密闭容器中加入4molCO2、10molH2,恒温下发生反应,测得CO2(g)和CH3OH(g)的物质的量随时间变化如图所示。

②0~9min内,用H2表示的平均反应速率v(H2)=
③下列能说明反应
 达到平衡状态的是
达到平衡状态的是A.混合气体的密度保持不变 B.3v正(CH3OH)=v逆(H2)
C.c(CH3OH)=c(H2O) D.2molC=O键断裂的同时生成3molH-H键
(3)以甲醇作燃料的燃料电池如图所示。
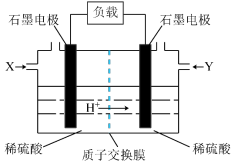
②若有1molCO2生成,理论上通过质子交换膜的H+的物质的量为
您最近一年使用:0次
名校
解题方法
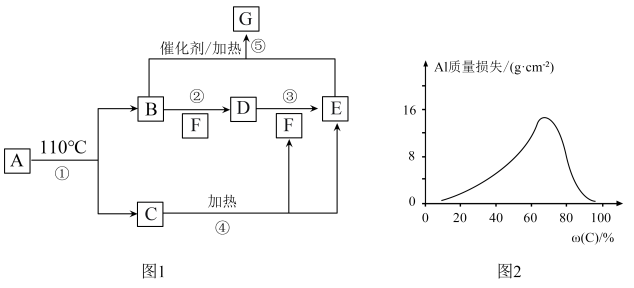
2 . A~G的转化关系如图1所示(部分产物略去),其中E为红棕色气体,G为单质。常温下,将Al片浸在不同质量分数的C溶液中,经过相同时间的腐蚀后,Al片的质量损失情况如图2所示。
(1)A的化学式为_______ 。
(2)实验室中常用_______ 检验B,现象是_______ 。
(3)反应④、⑤的化学方程式依次为_______ 、_______ 。
(4)图2中Al质量损失随C溶液质量分数的变化先增大后减小,减小的原因为_______ 。
(5)足量Al与一定浓度的C反应,得到H溶液和D、E的混合物,这些混合物与1.68 LO2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成C.若向所得H溶液中加入5 mol/LNaOH溶液至Al3+恰好完全沉淀,则消耗NaOH溶液的体积是_______ mL。
(1)A的化学式为
(2)实验室中常用
(3)反应④、⑤的化学方程式依次为
(4)图2中Al质量损失随C溶液质量分数的变化先增大后减小,减小的原因为
(5)足量Al与一定浓度的C反应,得到H溶液和D、E的混合物,这些混合物与1.68 LO2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成C.若向所得H溶液中加入5 mol/LNaOH溶液至Al3+恰好完全沉淀,则消耗NaOH溶液的体积是
您最近一年使用:0次
3 . 下列有关说法正确的是
| A.S与H2、O2、Fe反应过程中S表现氧化性 |
| B.硫、碳在空气中完全燃烧产物分别为SO3、CO2 |
| C.液氨汽化时吸收大量热,可用作制冷剂 |
| D.SO2通入紫色石蕊试液,溶液先变红后褪色,体现了SO2酸性氧化物的性质和漂白性 |
您最近一年使用:0次
名校
解题方法
4 . I.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
[实验原理]
[实验内容及记录]
(1)请完成此实验设计,其中:
_______ ,
_______ 。
(2)实验①、②探究的是_______ 对化学反应速率的影响,根据上表中的实验数据,可以得到的结论是_______ 。
(3)探究温度对化学反应速率的影响,应选择实验_______ (填实验编号)。
(4)利用实验①中的数据,计算用 表示的化学反应速率为
表示的化学反应速率为_______ 。
Ⅱ.某小组同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像 那样还原
那样还原 呢?他们设计实验制取氨气并探究上述问题:
呢?他们设计实验制取氨气并探究上述问题:
①制取氨气
(5)实验室除可用氯化铵和熟石灰制备氨气外,还有多种快速制氨气的方法,写出实验室用生石灰和浓氨水取氨气的化学方程式_______ 。
(6)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为他能否达到目的?_______ (填“能”或“否”),理由是_______ 。
②该小组中某同学设计了如下实验装置(夹持及尾气处理装置未画出),探究氨气的还原性:_______ 。
(8)利用改进后的装置进行实验,观察到 变为红色物质,无水
变为红色物质,无水 变蓝色,同时生成一种无污染的气体。写出氨气与
变蓝色,同时生成一种无污染的气体。写出氨气与 反应的化学方程式
反应的化学方程式_______ 。
[实验原理]
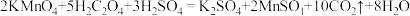
[实验内容及记录]
实验编号 | ① | ② | ③ | |
实验温度/ | 25 | 25 | 50 | |
试管中所加试剂及其用量/ |
| 3.0 | 2.0 | 2.0 |
|
| 3.0 |
| |
| 2.0 | 2.0 | 2.0 | |
| 3.0 | 3.0 | 3.0 | |
溶液褪至无色所需时间/ | 1.5 | 2.7 | 1.0 | |
(1)请完成此实验设计,其中:


(2)实验①、②探究的是
(3)探究温度对化学反应速率的影响,应选择实验
(4)利用实验①中的数据,计算用
 表示的化学反应速率为
表示的化学反应速率为Ⅱ.某小组同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像
 那样还原
那样还原 呢?他们设计实验制取氨气并探究上述问题:
呢?他们设计实验制取氨气并探究上述问题:①制取氨气
(5)实验室除可用氯化铵和熟石灰制备氨气外,还有多种快速制氨气的方法,写出实验室用生石灰和浓氨水取氨气的化学方程式
(6)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为他能否达到目的?
②该小组中某同学设计了如下实验装置(夹持及尾气处理装置未画出),探究氨气的还原性:
(8)利用改进后的装置进行实验,观察到
 变为红色物质,无水
变为红色物质,无水 变蓝色,同时生成一种无污染的气体。写出氨气与
变蓝色,同时生成一种无污染的气体。写出氨气与 反应的化学方程式
反应的化学方程式
您最近一年使用:0次
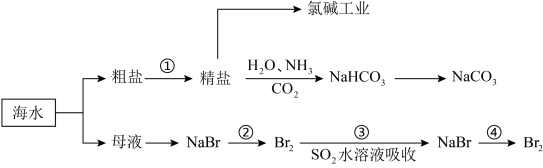
5 . 海洋中有丰富的矿产、能源、水产……等资源,部分化学资源获取途径如下:
(1)下列有关实验室模拟步骤①的说法正确的是_______ 。
a.溶解粗盐时,尽量使溶液稀些,以保证食盐完全溶解
b.滤去不溶性杂质后,将滤液移到坩埚内加热浓缩
c.当蒸发到剩有少量液体时停止加热,利用余热蒸干
d.制得的晶体转移到新过滤器中,需用大量水进行洗涤
(2)在海水提溴的实验中,通入热空气吹出Br2,利用了溴的_______ 性。
(3)步骤③反应的离子方程式为_______ 。
(4)下列有关说法正确的是_______ (填字母序号)。
a.在第②、④步骤中,溴元素均被氧化,在第③步骤中,溴元素被还原
b.用澄清的石灰水可鉴别NaHCO3溶液和Na2CO3溶液
c.除去粗盐中Ca2+、Mg2+、 加入试剂的先后顺序为NaOH、BaCl2、Na2CO3
加入试剂的先后顺序为NaOH、BaCl2、Na2CO3
d.海水中还含有碘元素,将海水中的碘升华可直接制备单质碘
Ⅱ.如图是从海水中提取镁的简单流程。_______ (填名称)。
②由无水MgCl2制取Mg的化学方程式是_______ 。
(1)下列有关实验室模拟步骤①的说法正确的是
a.溶解粗盐时,尽量使溶液稀些,以保证食盐完全溶解
b.滤去不溶性杂质后,将滤液移到坩埚内加热浓缩
c.当蒸发到剩有少量液体时停止加热,利用余热蒸干
d.制得的晶体转移到新过滤器中,需用大量水进行洗涤
(2)在海水提溴的实验中,通入热空气吹出Br2,利用了溴的
(3)步骤③反应的离子方程式为
(4)下列有关说法正确的是
a.在第②、④步骤中,溴元素均被氧化,在第③步骤中,溴元素被还原
b.用澄清的石灰水可鉴别NaHCO3溶液和Na2CO3溶液
c.除去粗盐中Ca2+、Mg2+、
 加入试剂的先后顺序为NaOH、BaCl2、Na2CO3
加入试剂的先后顺序为NaOH、BaCl2、Na2CO3d.海水中还含有碘元素,将海水中的碘升华可直接制备单质碘
Ⅱ.如图是从海水中提取镁的简单流程。

②由无水MgCl2制取Mg的化学方程式是
您最近一年使用:0次
名校
6 . 某化学兴趣小组用以下装置制备SO2并探究其部分性质。_______ ,装置B可贮存多余的SO2,B中试剂瓶内应盛放的液体是_______ 。
(2)若装置C中溶液无明显现象,装置D中溶液红色褪去,说明使品红水溶液褪色的含硫微粒是_______ (填化学式)。
(3)通入SO2后,E中溶液立即由棕黄色变成红棕色,将混合液静置12小时后,溶液变成浅绿色。查阅资料,发现溶液出现红棕色是因为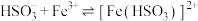 (红棕色)。
(红棕色)。
①溶液中产生 的离子方程式为
的离子方程式为_______ 。与该过程发生的其他化学反应相比, 与Fe3+反应生成[Fe(HSO3)]2+的活化能更
与Fe3+反应生成[Fe(HSO3)]2+的活化能更_______ (填“大”或“小”)。
②红棕色的[Fe(HSO3)]2+与Fe3+反应,溶液变成浅绿色,反应的离子方程式为_______ ;检验生成的阴离子的方法_______ 。
③为了缩短红棕色变为浅绿色的时间,该小组进行如下实验:
实验Ⅰ:往5 mL 1 mol/LFeCl3溶液中通入SO2,微热3分钟,溶液变为浅绿色。
实验Ⅱ:用浓盐酸酸化FeCl3溶液后再通入SO2,几分钟后,溶液变为浅绿色。
结论:通过_______ 可缩短浅绿色出现的时间。
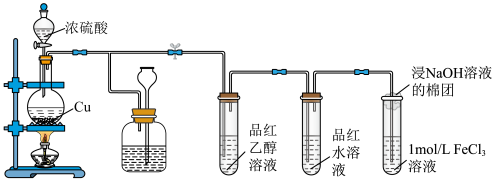
A B C D E
(1)装置A中制备SO2的化学反应方程式为(2)若装置C中溶液无明显现象,装置D中溶液红色褪去,说明使品红水溶液褪色的含硫微粒是
(3)通入SO2后,E中溶液立即由棕黄色变成红棕色,将混合液静置12小时后,溶液变成浅绿色。查阅资料,发现溶液出现红棕色是因为
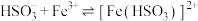 (红棕色)。
(红棕色)。①溶液中产生
 的离子方程式为
的离子方程式为 与Fe3+反应生成[Fe(HSO3)]2+的活化能更
与Fe3+反应生成[Fe(HSO3)]2+的活化能更②红棕色的[Fe(HSO3)]2+与Fe3+反应,溶液变成浅绿色,反应的离子方程式为
③为了缩短红棕色变为浅绿色的时间,该小组进行如下实验:
实验Ⅰ:往5 mL 1 mol/LFeCl3溶液中通入SO2,微热3分钟,溶液变为浅绿色。
实验Ⅱ:用浓盐酸酸化FeCl3溶液后再通入SO2,几分钟后,溶液变为浅绿色。
结论:通过
您最近一年使用:0次
7 . 我国力争2030年前实现碳达峰,2060年前实现碳中和。 的捕集利用已成为科学家们研究的重要课题。
的捕集利用已成为科学家们研究的重要课题。 加氢可转化为二甲醚(
加氢可转化为二甲醚( ),反应原理为
),反应原理为 。该反应的能量变化如图所示。
。该反应的能量变化如图所示。
(1)该反应为_______ (填“放热”或“吸热”)反应。
(2)在固定体积的绝热密闭容器中发生该反应,能说明该反应达到平衡状态的是_______ (填字母)。
a. 的含量保持不变 c.容器内温度不变
的含量保持不变 c.容器内温度不变
b.混合气体的密度不变 d.混合气体的平均相对分子质量不变
e.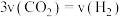
(3)恒温条件下,在体积为 密闭容器中充入
密闭容器中充入 和
和 ,测得
,测得 、
、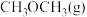 的物质的量随时间变化如图甲所示。
的物质的量随时间变化如图甲所示。
①反应到达 时,
时,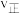
_______  (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。
②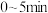 内,
内,
_______ 。
③反应达到平衡状态时,容器内的压强与起始压强之比为_______ 。
④“二甲醚( )酸性燃料电池”的工作原理示意图如图乙所示。
)酸性燃料电池”的工作原理示意图如图乙所示。
X电极为_______ (填“正”或“负”)极;X电极的电极反应式为_______ ;Y电极的电极反应式为_______ 。
 的捕集利用已成为科学家们研究的重要课题。
的捕集利用已成为科学家们研究的重要课题。 加氢可转化为二甲醚(
加氢可转化为二甲醚( ),反应原理为
),反应原理为 。该反应的能量变化如图所示。
。该反应的能量变化如图所示。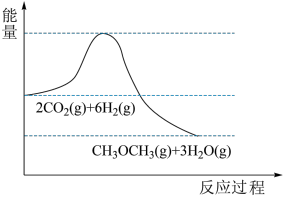
(1)该反应为
(2)在固定体积的绝热密闭容器中发生该反应,能说明该反应达到平衡状态的是
a.
 的含量保持不变 c.容器内温度不变
的含量保持不变 c.容器内温度不变b.混合气体的密度不变 d.混合气体的平均相对分子质量不变
e.
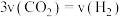
(3)恒温条件下,在体积为
 密闭容器中充入
密闭容器中充入 和
和 ,测得
,测得 、
、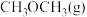 的物质的量随时间变化如图甲所示。
的物质的量随时间变化如图甲所示。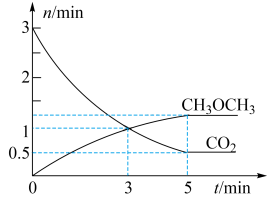
①反应到达
 时,
时,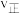
 (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。②
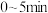 内,
内,
③反应达到平衡状态时,容器内的压强与起始压强之比为
④“二甲醚(
 )酸性燃料电池”的工作原理示意图如图乙所示。
)酸性燃料电池”的工作原理示意图如图乙所示。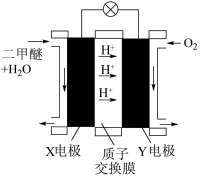
X电极为
您最近一年使用:0次
名校
8 . 请回答下列问题:
(1)硅是无机非金属材料里的明星,硅在元素周期表中的位置_______ ,硅的氧化物和硅酸盐约占地壳质量的90%以上,在 中,硅原子和氧原子通过
中,硅原子和氧原子通过_______ (选填“极性共价键”、“非极性共价键”、“离子键”)连接形成立体网状结构,所以 硬度大。建筑粘合剂和防火剂硅酸钠,可用
硬度大。建筑粘合剂和防火剂硅酸钠,可用 溶解在
溶解在 溶液中制备,反应的离子方程式为
溶液中制备,反应的离子方程式为_______ 。
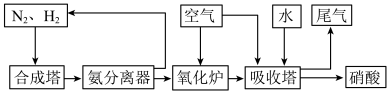
(2)氨和硝酸是重要的化工产品,工业合成氨及制备硝酸的部分流程图如下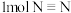 、
、 、
、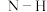 分别需要吸收
分别需要吸收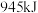 、
、 、
、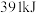 的能量,在一定条件下消耗了
的能量,在一定条件下消耗了 和
和 生成
生成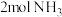 ,该过程会
,该过程会_______  的能量。
的能量。
②氧化炉中,标准状况下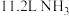 转化为
转化为 时转移的电子数目为
时转移的电子数目为_______ 。
③在模拟实验中,吸收塔中出来的尾气 和
和 ,通过调节其体积比,可用
,通过调节其体积比,可用 溶液完全吸收,生成硝酸盐或亚硝酸盐。当
溶液完全吸收,生成硝酸盐或亚硝酸盐。当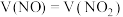 时,发生反应的化学方程式为
时,发生反应的化学方程式为_______ 。仅含 和
和 的混合气被完全吸收,且体积分数之比
的混合气被完全吸收,且体积分数之比 ,则产物中亚硝酸盐和硝酸盐的比例为
,则产物中亚硝酸盐和硝酸盐的比例为_______ 。
(1)硅是无机非金属材料里的明星,硅在元素周期表中的位置
 中,硅原子和氧原子通过
中,硅原子和氧原子通过 硬度大。建筑粘合剂和防火剂硅酸钠,可用
硬度大。建筑粘合剂和防火剂硅酸钠,可用 溶解在
溶解在 溶液中制备,反应的离子方程式为
溶液中制备,反应的离子方程式为(2)氨和硝酸是重要的化工产品,工业合成氨及制备硝酸的部分流程图如下
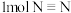 、
、 、
、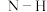 分别需要吸收
分别需要吸收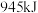 、
、 、
、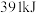 的能量,在一定条件下消耗了
的能量,在一定条件下消耗了 和
和 生成
生成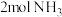 ,该过程会
,该过程会 的能量。
的能量。②氧化炉中,标准状况下
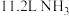 转化为
转化为 时转移的电子数目为
时转移的电子数目为③在模拟实验中,吸收塔中出来的尾气
 和
和 ,通过调节其体积比,可用
,通过调节其体积比,可用 溶液完全吸收,生成硝酸盐或亚硝酸盐。当
溶液完全吸收,生成硝酸盐或亚硝酸盐。当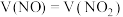 时,发生反应的化学方程式为
时,发生反应的化学方程式为 和
和 的混合气被完全吸收,且体积分数之比
的混合气被完全吸收,且体积分数之比 ,则产物中亚硝酸盐和硝酸盐的比例为
,则产物中亚硝酸盐和硝酸盐的比例为
您最近一年使用:0次
名校
解题方法
9 . 某温度下,在一恒容密闭容器中进行反应:CaC2O4(s) CaO(s)+CO2(g)+CO(g),下列情况一定能说明反应已达到平衡的是
CaO(s)+CO2(g)+CO(g),下列情况一定能说明反应已达到平衡的是
①容器内压强不随时间而变化
②单位时间内,消耗1 mol CO2同时生成1 mol CO
③气体的密度不随时间而变化
④混合气体的平均摩尔质量不随时间而变化
 CaO(s)+CO2(g)+CO(g),下列情况一定能说明反应已达到平衡的是
CaO(s)+CO2(g)+CO(g),下列情况一定能说明反应已达到平衡的是①容器内压强不随时间而变化
②单位时间内,消耗1 mol CO2同时生成1 mol CO
③气体的密度不随时间而变化
④混合气体的平均摩尔质量不随时间而变化
| A.①③④ | B.①②③ | C.②③④ | D.①②④ |
您最近一年使用:0次
名校
10 . 在一定条件下,将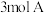 和
和 投入容积为
投入容积为 的密闭容器中,发生如下反应:
的密闭容器中,发生如下反应: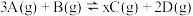 。
。 末测得此时容器中C和D的浓度为
末测得此时容器中C和D的浓度为 和
和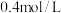 。下列叙述正确的是
。下列叙述正确的是
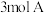 和
和 投入容积为
投入容积为 的密闭容器中,发生如下反应:
的密闭容器中,发生如下反应: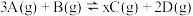 。
。 末测得此时容器中C和D的浓度为
末测得此时容器中C和D的浓度为 和
和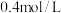 。下列叙述正确的是
。下列叙述正确的是A. |
B. 时,B的浓度为 时,B的浓度为 |
C.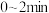 内B的反应速率为 内B的反应速率为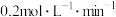 |
D.此时A的转化率为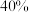 |
您最近一年使用:0次




 溶液
溶液


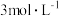 稀
稀 溶液
溶液