解题方法
1 . 回答下列问题
(1)对于在一个密闭容器中进行的反应 C(s)+H2O(g) = CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是___________ 。
①增加C的量;②增加CO的量;③将容器的体积缩小一半; ④保持体积不变,充入 He以增大压强;⑤升高反应体系的温度; ⑥保持压强不变,充入 He 以增大体积。
(2)新型纳米材料氧缺位高铁酸盐( )能将烟气中
)能将烟气中 除去,原理如图所示。该过程中转化的
除去,原理如图所示。该过程中转化的 和消耗的
和消耗的 体积比为
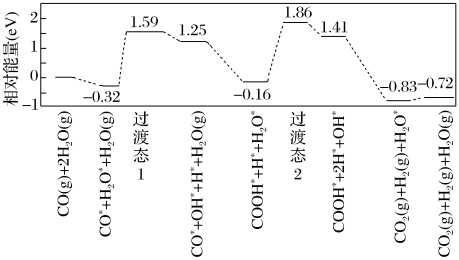
体积比为___________ 。___________ 0(填“大于”“等于”或“小于”)。该历程中最大能垒(活化能)E正=___________ eV,写出该步骤的化学方程式___________ 。
(1)对于在一个密闭容器中进行的反应 C(s)+H2O(g) = CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是
①增加C的量;②增加CO的量;③将容器的体积缩小一半; ④保持体积不变,充入 He以增大压强;⑤升高反应体系的温度; ⑥保持压强不变,充入 He 以增大体积。
(2)新型纳米材料氧缺位高铁酸盐(
 )能将烟气中
)能将烟气中 除去,原理如图所示。该过程中转化的
除去,原理如图所示。该过程中转化的 和消耗的
和消耗的 体积比为
体积比为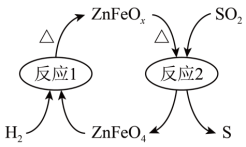
您最近一年使用:0次
解题方法
2 . 回答下列问题
(1)下列反应是氧化还原反应且是吸热反应的是___________ 。
A.稀醋酸与烧碱溶液的反应
B.灼热的炭与CO2的反应
C.铁片与稀盐酸反应
D.Ba(OH)2•8H2O与NH4Cl反应
E.干冰汽化
(2)实际生产生活中,钢铁等金属因电化学腐蚀损失巨大,而电化学在金属制备和加工中也发挥着重要的作用。生活中钢铁腐蚀以吸氧腐蚀为主,该腐蚀过程中正极的电极反应式为___________ 。金属的两种常见电化学防护方法如下图所示,图甲中铁闸门连接电源的___________ (填“正极”或“负极”),图乙所示金属的防护方法称为___________ 。
(1)下列反应是氧化还原反应且是吸热反应的是
A.稀醋酸与烧碱溶液的反应
B.灼热的炭与CO2的反应
C.铁片与稀盐酸反应
D.Ba(OH)2•8H2O与NH4Cl反应
E.干冰汽化
(2)实际生产生活中,钢铁等金属因电化学腐蚀损失巨大,而电化学在金属制备和加工中也发挥着重要的作用。生活中钢铁腐蚀以吸氧腐蚀为主,该腐蚀过程中正极的电极反应式为
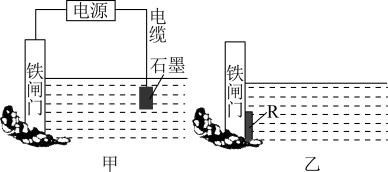
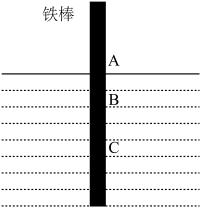
| A.铁棒AB段发生的反应为O2+2H2O+4e-=4OH- |
| B.腐蚀过程中在铁棒上会产生微电流,且方向是从BC段到AB段 |
| C.向水中加入一定量硫酸钾固体后,对铁棒的生锈速率几乎无影响 |
| D.产生这种现象的本质是铁棒所处的化学环境不同 |
您最近一年使用:0次
解题方法
3 . 如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,完成下列问题:___________ 。
(2)写出乙池石墨电极的名称为___________ (填“正极”“负极”或“阴极”“阳极”)。写出乙池中电解总反应的化学方程式:___________ 。
(3)甲池中消耗224 mL(标准状况下)O2,此时丙池中理论上最多产生___________ g沉淀,此时乙池中溶液的体积为400 mL,该溶液的pH=___________ 。
(4)若丙中电极不变,将其溶液换成NaOH溶液,开关闭合一段时间后,甲中溶液的pH将___________ (填“增大”“减小”或“不变”,下同),丙中溶液的pH将___________ 。
(5)某同学利用甲醇燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图)。若用于制漂白液,a为电池的___________ 极,电解质溶液最好用___________ 。若用于制Fe(OH)2,使用硫酸钠溶液作电解质溶液,阳极选用___________ 作电极。阳极反应的电极方程式为___________ 。
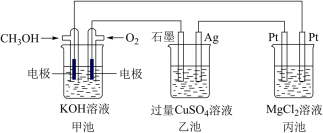
(2)写出乙池石墨电极的名称为
(3)甲池中消耗224 mL(标准状况下)O2,此时丙池中理论上最多产生
(4)若丙中电极不变,将其溶液换成NaOH溶液,开关闭合一段时间后,甲中溶液的pH将
(5)某同学利用甲醇燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图)。若用于制漂白液,a为电池的

您最近一年使用:0次
解题方法
4 . 某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”,进行了如下实验:
请回答:
(1)实验计时方法是从溶液混合开始记时,至___________ 时记时结束。
(2)V1=___________ ,V2=___________ ;设计实验Ⅰ、Ⅲ的目的是探究___________ 对反应速率的影响。
(3)利用实验Ⅲ中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=___________ 。
(4)有同学在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。某同学认为是放热导致溶液温度升高所致,重做Ⅰ号实验,测定过程中溶液不同时间的温度,结果温度没有明显变化。由此你得出的结论是:
①___________ 不是反应速率突然加快的原因;
②可能是反应产物有催化作用。Ⅳ号实验是为验证你的猜测,实验中要加入的少量某种物质是___________ 。
| 实验编号 | 0.01mol•L﹣1 酸性KMnO4溶液 | 0.1mol•L﹣1 H2C2O4溶液 | 水 | 某种物质 | 反应温度/℃ | 反应时间(min) |
| Ⅰ | 2ml | 2ml | 0 | 0 | 20 | 2.1 |
| Ⅱ | V1ml | 2ml | 1ml | 0 | 20 | 5.5 |
| Ⅲ | V2 ml | 2ml | 0 | 0 | 50 | 0.5 |
| Ⅳ | 2ml | 2ml | 0 | 少量 | 20 | 0.2 |
(1)实验计时方法是从溶液混合开始记时,至
(2)V1=
(3)利用实验Ⅲ中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=
(4)有同学在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。某同学认为是放热导致溶液温度升高所致,重做Ⅰ号实验,测定过程中溶液不同时间的温度,结果温度没有明显变化。由此你得出的结论是:
①
②可能是反应产物有催化作用。Ⅳ号实验是为验证你的猜测,实验中要加入的少量某种物质是
您最近一年使用:0次
解题方法
5 . 50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。实验数据如下表。
(1)①从实验装置看,图中还缺少的一种玻璃仪器是___________ 。在实验过程中,该仪器搅拌的正确操作方法是:___________ 。
②近似认为0.55 mol·L-1NaOH溶液和0.50 mol·L-1HCl溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1.则中和热ΔH=___________ (取小数点后一位)。中和热测定时采用稍过量的氢氧化钠的原因:___________ 。
③测定稀硫酸和稀氢氧化钠中和热(中和热为57.3kJ/mol)的实验装置如图所示。某兴趣小组的实验数值结果小于57.3kJ/mol原因可能是___________ (填字母)。
A.实验装置保温、隔热效果差
B.读取混合液的最高温度记为终点温度
C.一次就把NaOH溶液全倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度
④用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和反应的中和热的数值与57.3kJ•mol-1相比较
会___________ (填“偏大”“偏小”或“无影响”)。
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如图:
反应Ⅲ:S(s)+O2(g)=SO2(g) △H3=-297kJ•mol-1
反应Ⅱ的热化学方程式:___________ 。
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能。已知表中所列键能数据:
则N2(g)+3H2(g)═2NH3(g) △H=___________ kJ•mol-1(用小写字母表示)。
(4)一定条件下,在水溶液均为1mol以下离子Cl-、ClO-、ClO 、ClO
、ClO 、ClO
、ClO 的能量(kJ)相对大小如图所示,则3ClO-(aq)=ClO
的能量(kJ)相对大小如图所示,则3ClO-(aq)=ClO +2Cl-(aq)的△H=
+2Cl-(aq)的△H=___________ kJ•mol-1。
起始温度t1/℃ | 终止温度t2/℃ | 温度差(t1-t2)/℃ | |||
HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(1)①从实验装置看,图中还缺少的一种玻璃仪器是
②近似认为0.55 mol·L-1NaOH溶液和0.50 mol·L-1HCl溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1.则中和热ΔH=
③测定稀硫酸和稀氢氧化钠中和热(中和热为57.3kJ/mol)的实验装置如图所示。某兴趣小组的实验数值结果小于57.3kJ/mol原因可能是
A.实验装置保温、隔热效果差
B.读取混合液的最高温度记为终点温度
C.一次就把NaOH溶液全倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度
④用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和反应的中和热的数值与57.3kJ•mol-1相比较
会
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如图:
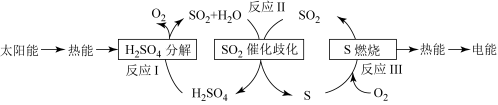
反应Ⅲ:S(s)+O2(g)=SO2(g) △H3=-297kJ•mol-1
反应Ⅱ的热化学方程式:
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能。已知表中所列键能数据:
| 化学键 | H-H | N-H | N≡N |
| 键能kJ/mol | a | b | c |
(4)一定条件下,在水溶液均为1mol以下离子Cl-、ClO-、ClO
 、ClO
、ClO 、ClO
、ClO 的能量(kJ)相对大小如图所示,则3ClO-(aq)=ClO
的能量(kJ)相对大小如图所示,则3ClO-(aq)=ClO +2Cl-(aq)的△H=
+2Cl-(aq)的△H=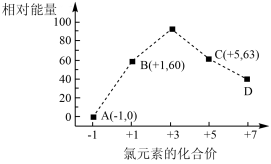
您最近一年使用:0次
名校
解题方法
6 . 镁菱锌矿(主要成分为ZnCO3、MgCO3等,含有少量FeCO3、CaCO3等杂质)可用于生产媒染剂、防腐剂ZnSO4•7H2O以及耐火材料MgO。制备工艺流程如图:
回答下列有关问题:
(1)浓盐酸浸取矿石时,保持较大液固体积比(如3:1),目的是_______ 。
(2)“氧化除铁”在90℃,控制溶液pH在4.0~5.0,得到针铁矿渣的离子方程式为_______ 。
(3)“沉锌”时,加入氨水调节pH的范围是_______ 。
(4)“酸解”后获得ZnSO4•7H2O的操作依次经过蒸发浓缩、_______ 制得的ZnSO4•7H2O在烘干时需减压烘干的原因是_______ 。
(5)“滤液”中加入H2C2O4饱和溶液产生MgC2O4沉淀,若“灼烧”时产生两种气体,则该反应的化学方程式为:_______ 。
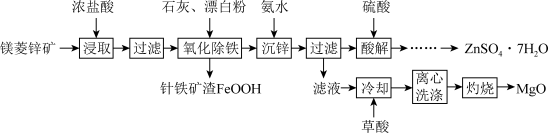
| 阳离子 | Fe3+ | Fe2+ | Zn2+ | Mg2+ | Ca2+ |
| 开始沉淀 | 2.7 | 7.6 | 6.2 | 9.4 | 13 |
| 完全沉淀 | 3.7 | 9.6 | 8.2 | 12.4 | _______ |
(1)浓盐酸浸取矿石时,保持较大液固体积比(如3:1),目的是
(2)“氧化除铁”在90℃,控制溶液pH在4.0~5.0,得到针铁矿渣的离子方程式为
(3)“沉锌”时,加入氨水调节pH的范围是
(4)“酸解”后获得ZnSO4•7H2O的操作依次经过蒸发浓缩、
(5)“滤液”中加入H2C2O4饱和溶液产生MgC2O4沉淀,若“灼烧”时产生两种气体,则该反应的化学方程式为:
您最近一年使用:0次
7 . 锰酸锂( )是锂电池的正极材料,有望取代
)是锂电池的正极材料,有望取代 。一种以废旧电池正极材料(主要成分为
。一种以废旧电池正极材料(主要成分为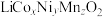 ,其中Co为+3价,还含少量铝箔、炭黑和有机黏合剂)为原料制备
,其中Co为+3价,还含少量铝箔、炭黑和有机黏合剂)为原料制备 的流程如下:
的流程如下:
(1)Ni位于元素周期表中___________ 区;基态Mn原子的价层电子轨道表示式为___________ 。
(2)“灼烧”的目的是___________ 。
(3)根据“酸浸”前后物质价态的变化,推测双氧水的作用是___________ 。
(4)“沉锰”过程中,溶液先变为紫红色,一段时间后紫红色褪去。溶液变为紫红色的原因是___________ (用离子方程式表示,加入 溶液之前,锰以
溶液之前,锰以 形式存在)。“紫红色褪去”后,还可能有的实验现象是
形式存在)。“紫红色褪去”后,还可能有的实验现象是___________ 。
(5)“合成”在600~750℃下进行,写出发生反应的化学方程式:___________ 。
(6) 材料在脱锂过程中形成的某种晶体为六方晶系,结构如图,晶胞底面边长为a nm、高为b nm,
材料在脱锂过程中形成的某种晶体为六方晶系,结构如图,晶胞底面边长为a nm、高为b nm, ,
,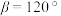 ,设
,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。___________ 。
②该晶体的密度为___________  。
。
 )是锂电池的正极材料,有望取代
)是锂电池的正极材料,有望取代 。一种以废旧电池正极材料(主要成分为
。一种以废旧电池正极材料(主要成分为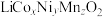 ,其中Co为+3价,还含少量铝箔、炭黑和有机黏合剂)为原料制备
,其中Co为+3价,还含少量铝箔、炭黑和有机黏合剂)为原料制备 的流程如下:
的流程如下: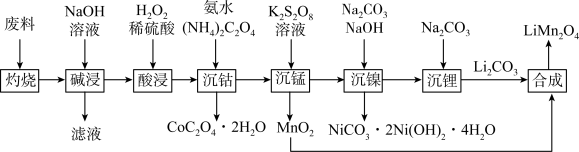
(1)Ni位于元素周期表中
(2)“灼烧”的目的是
(3)根据“酸浸”前后物质价态的变化,推测双氧水的作用是
(4)“沉锰”过程中,溶液先变为紫红色,一段时间后紫红色褪去。溶液变为紫红色的原因是
 溶液之前,锰以
溶液之前,锰以 形式存在)。“紫红色褪去”后,还可能有的实验现象是
形式存在)。“紫红色褪去”后,还可能有的实验现象是(5)“合成”在600~750℃下进行,写出发生反应的化学方程式:
(6)
 材料在脱锂过程中形成的某种晶体为六方晶系,结构如图,晶胞底面边长为a nm、高为b nm,
材料在脱锂过程中形成的某种晶体为六方晶系,结构如图,晶胞底面边长为a nm、高为b nm, ,
, ,设
,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
②该晶体的密度为
 。
。
您最近一年使用:0次
8 . 爱护水资源,落实长江大保护。
(1)树立保护水体意识。下列做法正确的有___________ 。
A.节约用水 B.工业用水重复利用 C.洗衣污水集中处理
(2)掌握水的净化方法。日常生活中,我们常使用活性炭制作净水器滤芯,是利用活性炭的___________ 性,为降低水的硬度,我们常选择的方法是___________ 。
(3)学习净水材料制备。高铁酸钾(K2FeO4)是一种新型非氯高效水处理消毒剂,主要用于饮用水处理,制备高铁酸钾的一种模拟流程如图(部分反应条件未标出):___________ 。
②反应A、B、C、D中属于复分解反应的是___________ 。
③反应A的化学方程式是___________ 。
(1)树立保护水体意识。下列做法正确的有
A.节约用水 B.工业用水重复利用 C.洗衣污水集中处理
(2)掌握水的净化方法。日常生活中,我们常使用活性炭制作净水器滤芯,是利用活性炭的
(3)学习净水材料制备。高铁酸钾(K2FeO4)是一种新型非氯高效水处理消毒剂,主要用于饮用水处理,制备高铁酸钾的一种模拟流程如图(部分反应条件未标出):
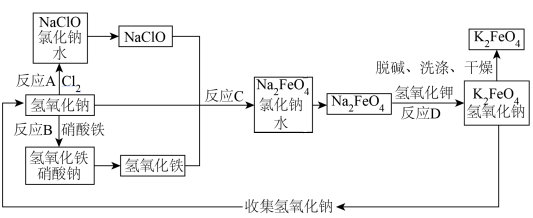
②反应A、B、C、D中属于复分解反应的是
③反应A的化学方程式是
您最近一年使用:0次
9 . 二氧化钼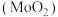 是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿(主要成分为
是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿(主要成分为 )通过一定条件来制备。回答下列相关问题:
)通过一定条件来制备。回答下列相关问题:
(1)已知:①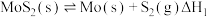
②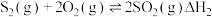
③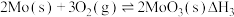
则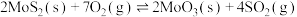 的
的
_______ (用含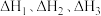 的代数式表示)。
的代数式表示)。
(2)若在恒温恒容条件下,仅发生反应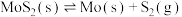 。
。
①下列说法正确的是_______ (填序号)。
A.气体的密度不变,则反应一定达到了平衡状态
B.气体的相对分子质量不变,反应不一定处于平衡状态
C.增加 的量,平衡正向移动
的量,平衡正向移动
②达到平衡时 的浓度为
的浓度为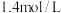 ,充入一定量的
,充入一定量的 ,反应再次达到平衡,
,反应再次达到平衡, 浓度
浓度_______ (填“ ”“
”“ ”或“
”或“ ”)
”)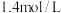 。
。
(3)在 恒容密闭容器中充入
恒容密闭容器中充入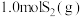 和
和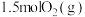 ,若仅发生反应:
,若仅发生反应: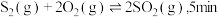 后反应达到平衡,此时容器压强为起始时的
后反应达到平衡,此时容器压强为起始时的 ,则
,则 内,
内, 的反应速率为
的反应速率为_______  。
。
(4)在恒容密闭容器中,加入足量的 和
和 ,仅发生反应:
,仅发生反应: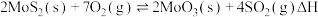 。测得氧气的平衡转化率与起始压强、温度的关系如图所示。
。测得氧气的平衡转化率与起始压强、温度的关系如图所示。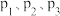 的大小:
的大小:_______ 。
②若在 为
为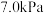 下,初始通入
下,初始通入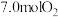 ,则
,则 点平衡常数
点平衡常数
_______ 。(用气体平衡分压代替气体平衡浓度计算,分压 总压
总压 气体的物质的量分数,写出计算式即可)。
气体的物质的量分数,写出计算式即可)。
(5) 可采用“电解法”制备,装置如图所示,写出电解时阴极的电极反应式:
可采用“电解法”制备,装置如图所示,写出电解时阴极的电极反应式:_______ 。
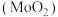 是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿(主要成分为
是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿(主要成分为 )通过一定条件来制备。回答下列相关问题:
)通过一定条件来制备。回答下列相关问题:(1)已知:①
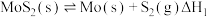
②
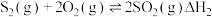
③
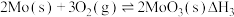
则
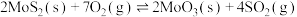 的
的
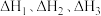 的代数式表示)。
的代数式表示)。(2)若在恒温恒容条件下,仅发生反应
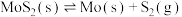 。
。①下列说法正确的是
A.气体的密度不变,则反应一定达到了平衡状态
B.气体的相对分子质量不变,反应不一定处于平衡状态
C.增加
 的量,平衡正向移动
的量,平衡正向移动②达到平衡时
 的浓度为
的浓度为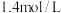 ,充入一定量的
,充入一定量的 ,反应再次达到平衡,
,反应再次达到平衡, 浓度
浓度 ”“
”“ ”或“
”或“ ”)
”)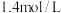 。
。(3)在
 恒容密闭容器中充入
恒容密闭容器中充入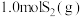 和
和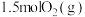 ,若仅发生反应:
,若仅发生反应: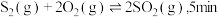 后反应达到平衡,此时容器压强为起始时的
后反应达到平衡,此时容器压强为起始时的 ,则
,则 内,
内, 的反应速率为
的反应速率为 。
。(4)在恒容密闭容器中,加入足量的
 和
和 ,仅发生反应:
,仅发生反应: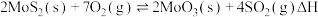 。测得氧气的平衡转化率与起始压强、温度的关系如图所示。
。测得氧气的平衡转化率与起始压强、温度的关系如图所示。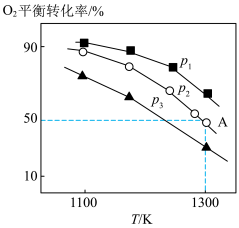
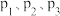 的大小:
的大小:②若在
 为
为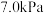 下,初始通入
下,初始通入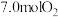 ,则
,则 点平衡常数
点平衡常数
 总压
总压 气体的物质的量分数,写出计算式即可)。
气体的物质的量分数,写出计算式即可)。(5)
 可采用“电解法”制备,装置如图所示,写出电解时阴极的电极反应式:
可采用“电解法”制备,装置如图所示,写出电解时阴极的电极反应式: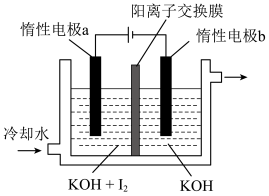
您最近一年使用:0次
名校
解题方法
10 . 磷酸亚铁锂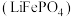 是重要的锂电池正极材料,一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图。
是重要的锂电池正极材料,一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图。
(1)操作1、操作2的实验名称为_______ 。
(2)加入 溶液的目的是
溶液的目的是_______ ,聚丙烯的作用是_______ 。
(3)向滤液2中加入 溶液需控制溶液的
溶液需控制溶液的 ,其原因为
,其原因为_______ ;反应生成 的离子方程式为
的离子方程式为_______ 。
(4)已知: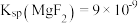 、
、 。若取
。若取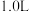 废液,测得
废液,测得 浓度为
浓度为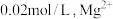 浓度为
浓度为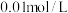 ,则至少需加入
,则至少需加入_______ 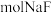 才能使废液中
才能使废液中 沉淀完全(当离子浓度
沉淀完全(当离子浓度 ,可认为沉淀完全)。
,可认为沉淀完全)。
(5)锂离子电池充电时, 作阳极,脱出部分
作阳极,脱出部分 ,形成
,形成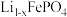 ,当
,当 时,则电极材料中
时,则电极材料中
_______ 。
(6)已知 的某种晶胞结构如图。晶胞参数为
的某种晶胞结构如图。晶胞参数为 ,以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。则A原子的坐标为
,以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。则A原子的坐标为 原子的坐标为
原子的坐标为 。设
。设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。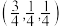 的
的 原子
原子_______ (在图中标出 ,可用头指明)。
,可用头指明)。
②距离 原子最近且等距离的
原子最近且等距离的 原子的数目为
原子的数目为_______ 。
③该晶胞的密度为_______  (列出计算式即可)。
(列出计算式即可)。
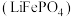 是重要的锂电池正极材料,一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图。
是重要的锂电池正极材料,一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图。
| 物质 |  |  |  |  |  |
 |  | 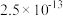 | 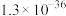 |  |  |
(1)操作1、操作2的实验名称为
(2)加入
 溶液的目的是
溶液的目的是(3)向滤液2中加入
 溶液需控制溶液的
溶液需控制溶液的 ,其原因为
,其原因为 的离子方程式为
的离子方程式为(4)已知:
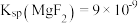 、
、 。若取
。若取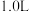 废液,测得
废液,测得 浓度为
浓度为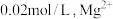 浓度为
浓度为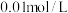 ,则至少需加入
,则至少需加入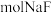 才能使废液中
才能使废液中 沉淀完全(当离子浓度
沉淀完全(当离子浓度 ,可认为沉淀完全)。
,可认为沉淀完全)。(5)锂离子电池充电时,
 作阳极,脱出部分
作阳极,脱出部分 ,形成
,形成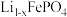 ,当
,当 时,则电极材料中
时,则电极材料中
(6)已知
 的某种晶胞结构如图。晶胞参数为
的某种晶胞结构如图。晶胞参数为 ,以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。则A原子的坐标为
,以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。则A原子的坐标为 原子的坐标为
原子的坐标为 。设
。设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
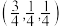 的
的 原子
原子 ,可用头指明)。
,可用头指明)。②距离
 原子最近且等距离的
原子最近且等距离的 原子的数目为
原子的数目为③该晶胞的密度为
 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次



