磷酸亚铁锂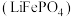 是重要的锂电池正极材料,一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图。
是重要的锂电池正极材料,一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图。
(1)操作1、操作2的实验名称为_______ 。
(2)加入 溶液的目的是
溶液的目的是_______ ,聚丙烯的作用是_______ 。
(3)向滤液2中加入 溶液需控制溶液的
溶液需控制溶液的 ,其原因为
,其原因为_______ ;反应生成 的离子方程式为
的离子方程式为_______ 。
(4)已知: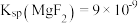 、
、 。若取
。若取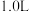 废液,测得
废液,测得 浓度为
浓度为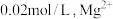 浓度为
浓度为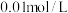 ,则至少需加入
,则至少需加入_______ 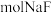 才能使废液中
才能使废液中 沉淀完全(当离子浓度
沉淀完全(当离子浓度 ,可认为沉淀完全)。
,可认为沉淀完全)。
(5)锂离子电池充电时, 作阳极,脱出部分
作阳极,脱出部分 ,形成
,形成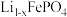 ,当
,当 时,则电极材料中
时,则电极材料中
_______ 。
(6)已知 的某种晶胞结构如图。晶胞参数为
的某种晶胞结构如图。晶胞参数为 ,以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。则A原子的坐标为
,以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。则A原子的坐标为 原子的坐标为
原子的坐标为 。设
。设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。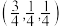 的
的 原子
原子_______ (在图中标出 ,可用头指明)。
,可用头指明)。
②距离 原子最近且等距离的
原子最近且等距离的 原子的数目为
原子的数目为_______ 。
③该晶胞的密度为_______  (列出计算式即可)。
(列出计算式即可)。
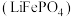 是重要的锂电池正极材料,一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图。
是重要的锂电池正极材料,一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图。
| 物质 |  |  |  |  |  |
 |  | 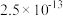 | 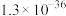 |  |  |
(1)操作1、操作2的实验名称为
(2)加入
 溶液的目的是
溶液的目的是(3)向滤液2中加入
 溶液需控制溶液的
溶液需控制溶液的 ,其原因为
,其原因为 的离子方程式为
的离子方程式为(4)已知:
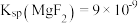 、
、 。若取
。若取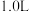 废液,测得
废液,测得 浓度为
浓度为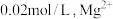 浓度为
浓度为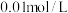 ,则至少需加入
,则至少需加入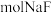 才能使废液中
才能使废液中 沉淀完全(当离子浓度
沉淀完全(当离子浓度 ,可认为沉淀完全)。
,可认为沉淀完全)。(5)锂离子电池充电时,
 作阳极,脱出部分
作阳极,脱出部分 ,形成
,形成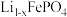 ,当
,当 时,则电极材料中
时,则电极材料中
(6)已知
 的某种晶胞结构如图。晶胞参数为
的某种晶胞结构如图。晶胞参数为 ,以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。则A原子的坐标为
,以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。则A原子的坐标为 原子的坐标为
原子的坐标为 。设
。设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
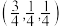 的
的 原子
原子 ,可用头指明)。
,可用头指明)。②距离
 原子最近且等距离的
原子最近且等距离的 原子的数目为
原子的数目为③该晶胞的密度为
 (列出计算式即可)。
(列出计算式即可)。
更新时间:2024-05-08 15:23:19
|
相似题推荐
【推荐1】闪锌矿的主要成分为ZnS(还含有少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:
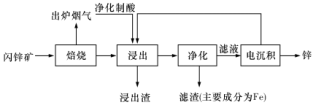
(l)闪锌矿焙烧过程中产生的出炉烟气可净化制酸,用于浸出操作。制酸过程中的主要化学方程式为_______ 。
(2)浸出操作中Fe3+浓度较高,需先加入SO2或ZnS将Fe3+还原为Fe2+,再以ZnO调整溶液酸度,将Fe2+转化成针铁矿( FeOOH)沉淀形成浸出渣。则Fe2+沉淀过程的总化学方程式为_____________ 。
(3)已知净化操作后的滤液中c(Zn2+)=0.2 mol/L,将该滤液与0.4 mol/L的Na2S溶液等体积混合,充分反应后,混合溶液中c(Zn2+)=_______ (ZnS的溶度积帝数Ksp=1. 20×10-23)。
(4)净化操作后的滤液加入阴极室内进行电沉积可得到纯锌,原理如右图所示:

①阳极的电极反应式为___________ 。
②以乙醚(C2H5OC2H5)空气燃料电池为电源电沉积制取纯锌时,阴极室内沉积1.3 g锌,理论上乙醚-空气燃料电池消耗____ g乙醚。
(5)上述冶炼工艺中的焙烧过程易导致空气污染。采用“氧压酸浸”流程,既可省略焙烧过程又可获得一种非金属单质。“氧压酸浸”流程中发生的主要反应的离子方程式为___________________ 。

(l)闪锌矿焙烧过程中产生的出炉烟气可净化制酸,用于浸出操作。制酸过程中的主要化学方程式为
(2)浸出操作中Fe3+浓度较高,需先加入SO2或ZnS将Fe3+还原为Fe2+,再以ZnO调整溶液酸度,将Fe2+转化成针铁矿( FeOOH)沉淀形成浸出渣。则Fe2+沉淀过程的总化学方程式为
(3)已知净化操作后的滤液中c(Zn2+)=0.2 mol/L,将该滤液与0.4 mol/L的Na2S溶液等体积混合,充分反应后,混合溶液中c(Zn2+)=
(4)净化操作后的滤液加入阴极室内进行电沉积可得到纯锌,原理如右图所示:

①阳极的电极反应式为
②以乙醚(C2H5OC2H5)空气燃料电池为电源电沉积制取纯锌时,阴极室内沉积1.3 g锌,理论上乙醚-空气燃料电池消耗
(5)上述冶炼工艺中的焙烧过程易导致空气污染。采用“氧压酸浸”流程,既可省略焙烧过程又可获得一种非金属单质。“氧压酸浸”流程中发生的主要反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】某研究小组用工业生产高锰酸钾产生的废渣——锰泥(含 、
、 及Pb、Ca等元素)和轧钢废酸液制取工业级碳酸锰(
及Pb、Ca等元素)和轧钢废酸液制取工业级碳酸锰( ),其流程如下:
),其流程如下:

(1)操作Ⅰ、操作Ⅱ、操作Ⅲ的名称是____ 。
(2)轧钢废酸中 的作用是
的作用是_________________ 。
(3)固体A是_____________ 。(填化学式,下同)
(4)溶液B中含有____ 阳离子,通过表格中数据简单说明固体B与以上离子分离的原因_____ 。
(5)若固体C中不含 ,则溶液C中
,则溶液C中
__ 。(已知:
 )
)
 、
、 及Pb、Ca等元素)和轧钢废酸液制取工业级碳酸锰(
及Pb、Ca等元素)和轧钢废酸液制取工业级碳酸锰( ),其流程如下:
),其流程如下:
(1)操作Ⅰ、操作Ⅱ、操作Ⅲ的名称是
(2)轧钢废酸中
 的作用是
的作用是(3)固体A是
(4)溶液B中含有
(5)若固体C中不含
 ,则溶液C中
,则溶液C中

 )
)
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(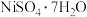 ):
):
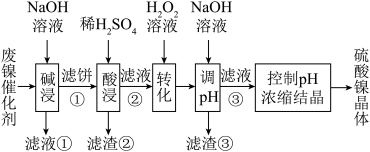
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“碱浸”中 的两个作用分别是除去油脂和
的两个作用分别是除去油脂和___________ 。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式___________ 。
(2)“转化”中可替代 的最佳物质是___________。
的最佳物质是___________。
(3)利用上述表格数据,计算 的
的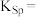
___________ 。如果“转化”后的溶液中 浓度为
浓度为 ,则“调
,则“调 ”应控制的
”应控制的 范围是
范围是___________ 。
(4)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是___________ 。
 ):
):
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
开始沉淀时(c=0.01mol/L)的 | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时(c=1.0×10-5mol/L)的 | 8.7 | 4.7 | 3.2 | 9.0 |
(1)“碱浸”中
 的两个作用分别是除去油脂和
的两个作用分别是除去油脂和(2)“转化”中可替代
 的最佳物质是___________。
的最佳物质是___________。A.酸性 溶液 溶液 | B. | C.硝酸 | D.新制氯水 |
(3)利用上述表格数据,计算
 的
的
 浓度为
浓度为 ,则“调
,则“调 ”应控制的
”应控制的 范围是
范围是(4)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】钙钛矿(主要成分是CaTiO3)太阳能薄膜电池制备工艺简单、成本低、效率高,引起了科研工作者的广泛关注,科学家认为钙钛矿太阳能电池将取代硅基太阳能电池的统治地位。
(1)基态钛原子的电子排布式为______ ,若钙原子核外有7种能量状态的电子,则钙原子处于____ (填“基”或“激发”)态,氧元素所在周期第一电离能由小到大的前三种元素依次是_______ 。
(2)硅能形成一系列硅氢化合物,如硅烷系列:SiH4、Si2H6;硅烯系列:Si2H4、Si3H6等,其中硅烷广泛应用于微电子、制造太阳能电池。
①上述分子中硅原子存在sp2杂化的是____ ,属于正四面体的是_____ 。
②硅烷链长度远小于烷烃,最可能的原因是______ ,硅烷同系物熔、沸点的变化规律可能是________ .
(3) CaTiO3的晶胞为立方晶胞,结构如下图所示:
则与A距离最近且相等的X有___ 个,M的坐标是_____ ;若晶胞参数是r pm, NA为阿伏加 德罗常数的值,则该晶体的密度是_____ g/cm3。
(1)基态钛原子的电子排布式为
(2)硅能形成一系列硅氢化合物,如硅烷系列:SiH4、Si2H6;硅烯系列:Si2H4、Si3H6等,其中硅烷广泛应用于微电子、制造太阳能电池。
①上述分子中硅原子存在sp2杂化的是
②硅烷链长度远小于烷烃,最可能的原因是
(3) CaTiO3的晶胞为立方晶胞,结构如下图所示:
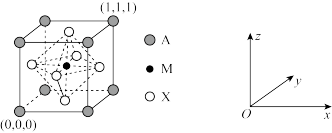
则与A距离最近且相等的X有
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】催化裂化是石油精炼中最重要的转化之一、FCC催化剂中含有多种金属元素,一种针对FCC废催化剂(含较多的CeO2、铁铝的氧化物和少量其他可溶于酸的物质)综合回收利用的工艺流程如下:
②常温下Ksp[Fe(OH)2]=4.0×10-16,Ksp[Fe(OH)3]=8.0×10-38,Ksp [Al(OH)3]=3.0×10-33,lg2=0.3。
回答下列问题:
(1)已知基态Ce原子价层电子排布式为4f15d16s2,它有___________ 个未成对电子,它的最高正化合价为___________ 。
(2)物质X为___________ ,若利用pH传感器监测反应2,当pH=___________ 时,Fe3+已沉淀完全。(c(Fe3+) ≤ 1×10-5mol/L时视为完全沉淀)
(3)从溶液中获得NH4Al(SO4)2•6H2O晶体的“一系列操作”包括___________ 、过滤、洗涤、常温干燥。SO 的空间构型为
的空间构型为___________ 。
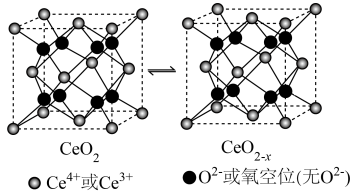
(4)CeO2是一种重要的光催化材料,光催化过程中立方晶胞的组成变化如图所示,假设CeO2晶胞边长为a pm,CeO2晶体结构中与Ce4+相邻且最近的Ce4+有___________ 个,CeO2晶胞中Ce4+与最近O2-的核间距为___________ ,每个CeO2-x晶胞中Ce4+个数为___________ 。

②常温下Ksp[Fe(OH)2]=4.0×10-16,Ksp[Fe(OH)3]=8.0×10-38,Ksp [Al(OH)3]=3.0×10-33,lg2=0.3。
回答下列问题:
(1)已知基态Ce原子价层电子排布式为4f15d16s2,它有
(2)物质X为
(3)从溶液中获得NH4Al(SO4)2•6H2O晶体的“一系列操作”包括
 的空间构型为
的空间构型为(4)CeO2是一种重要的光催化材料,光催化过程中立方晶胞的组成变化如图所示,假设CeO2晶胞边长为a pm,CeO2晶体结构中与Ce4+相邻且最近的Ce4+有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是___________(填标号)。
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中碳、氮的杂化类型分别是___________ 。乙二胺能与Cu2+等金属离子形成稳定环状离子,其原因是___________ 。
(3)一些氧化物的熔点如下表所示:
解释表中氧化物之间熔点差异的原因___________ 。
(4)原子晶体GaAs的晶胞参数a = x pm,它的晶胞结构如下图所示。该晶胞内部存在的共价键数为___________ ;A原子距离B原子所在六面体的侧面的最短距离为___________ (用x表示)pm ;该晶胞的密度为___________ g·cm-3。(阿伏加德罗常数用NA表示)。

(1)下列状态的镁中,电离最外层一个电子所需能量最大的是___________(填标号)。
A. | B. | C. | D. |
(3)一些氧化物的熔点如下表所示:
| 氧化物 | Li2O | MgO | P4O6 | SO2 |
| 熔点/°C | 1570 | 2800 | 23.8 | −75.5 |
解释表中氧化物之间熔点差异的原因
(4)原子晶体GaAs的晶胞参数a = x pm,它的晶胞结构如下图所示。该晶胞内部存在的共价键数为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量 、
、 )称为“烂板液”。某化学兴趣小组用“烂板液”制取
)称为“烂板液”。某化学兴趣小组用“烂板液”制取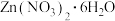 的过程如下:
的过程如下:

已知: 能与强碱反应;常温下,Ksp(Fe(OH)3=8×10-39, Ksp(Zn(OH)2=1.2×10-17。
能与强碱反应;常温下,Ksp(Fe(OH)3=8×10-39, Ksp(Zn(OH)2=1.2×10-17。
(1)上述过程中多步操作需控制溶液pH,实验室用pH试纸测溶液pH的正确操作是_______ 。
(2)操作1的名称为_______ ,在操作1中pH不宜过高的原因是_______ 。
(3)操作2中加入的物质A可以是_______ (填化学式),调节pH的范围是_______ 。【已知:c(Zn2+)=0.12 mol·L-1,离子完全沉淀时浓度≤10-5mol·L-1 , lg5=0.7】
(4)“冷却结晶”步骤中需加入硝酸的目的是_______ 。
 、
、 )称为“烂板液”。某化学兴趣小组用“烂板液”制取
)称为“烂板液”。某化学兴趣小组用“烂板液”制取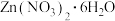 的过程如下:
的过程如下:
已知:
 能与强碱反应;常温下,Ksp(Fe(OH)3=8×10-39, Ksp(Zn(OH)2=1.2×10-17。
能与强碱反应;常温下,Ksp(Fe(OH)3=8×10-39, Ksp(Zn(OH)2=1.2×10-17。(1)上述过程中多步操作需控制溶液pH,实验室用pH试纸测溶液pH的正确操作是
(2)操作1的名称为
(3)操作2中加入的物质A可以是
(4)“冷却结晶”步骤中需加入硝酸的目的是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】磁选后的炼铁高钛炉渣,主要成分有 、
、 、
、 、MgO、CaO以及少量的
、MgO、CaO以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
已知:①“焙烧”中, 、
、 几乎不发生反应,
几乎不发生反应, 、MgO、CaO、
、MgO、CaO、 转化为相应的硫酸盐;②
转化为相应的硫酸盐;② 。回答下列问题:
。回答下列问题:
(1)为了加快“焙烧”速率,可采用的物理方法为______ (填一种即可)。
(2) “焙烧”时,转化为
“焙烧”时,转化为 ;在
;在 的
的 溶液中,各离子浓度由大到小的顺序为
溶液中,各离子浓度由大到小的顺序为______ (填离子符号)。
(3)“水浸”后的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,最先析出的离子为______ (填离子符号)。
(4)水浸渣在160℃“酸溶”,最适合的加热方式为______ (填“水浴”或“油浴”)加热。
(5)“酸溶”后,将溶液适当稀释并加热, 水解析出
水解析出 沉淀,该反应的离子方程式为
沉淀,该反应的离子方程式为______ 。
 、
、 、
、 、MgO、CaO以及少量的
、MgO、CaO以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。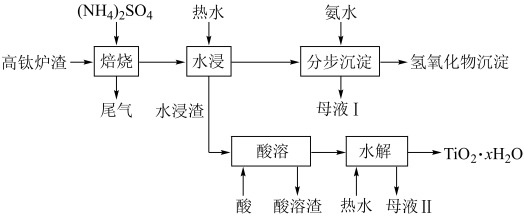
金属离子 |
|
|
|
|
开始沉淀( | 1.5 | 3.4 | 8.9 | 12.0 |
沉淀完全( | 2.8 | 4.7 | 10.9 | 13.8 |
 、
、 几乎不发生反应,
几乎不发生反应, 、MgO、CaO、
、MgO、CaO、 转化为相应的硫酸盐;②
转化为相应的硫酸盐;② 。回答下列问题:
。回答下列问题:(1)为了加快“焙烧”速率,可采用的物理方法为
(2)
 “焙烧”时,转化为
“焙烧”时,转化为 ;在
;在 的
的 溶液中,各离子浓度由大到小的顺序为
溶液中,各离子浓度由大到小的顺序为(3)“水浸”后的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,最先析出的离子为
(4)水浸渣在160℃“酸溶”,最适合的加热方式为
(5)“酸溶”后,将溶液适当稀释并加热,
 水解析出
水解析出 沉淀,该反应的离子方程式为
沉淀,该反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某研究性学习小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产提取镁,主要过程如下:
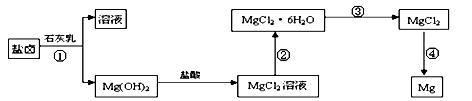
回答下列问题:
(1)从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2 ,除去少量Ca(OH)2的方法是先将沉淀加入到盛有________ 饱和溶液的烧杯中,充分搅拌后经______ 、______ (填操作方法)可得纯净的Mg(OH)2。写出有关反应的离子方程式__________ 。
(2)右图是该研究性学习小组设计进行过程③的实验装置图。其中装置A的作用是_______ 。
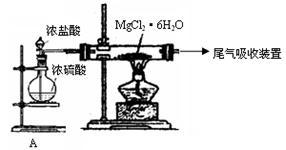
若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是________________ 。
(3)写出过程④中发生反应的化学方程式_______________ 。

回答下列问题:
(1)从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2 ,除去少量Ca(OH)2的方法是先将沉淀加入到盛有
(2)右图是该研究性学习小组设计进行过程③的实验装置图。其中装置A的作用是

若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是
(3)写出过程④中发生反应的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】铝土矿主要成分Al2O3,还含少量 SiO2、Fe2O3杂质。可用下图制备铝:

已知 2Na2SiO3+2NaAlO2+2H2O === Na2Al2Si2O8↓+4NaOH。 回答下列问题:
(1)在工艺流程第五步中,灼烧所需的实验仪器除酒精灯、坩埚、坩埚钳、玻璃棒之外,还需要_____________ 、_________________________ 。
(2)Na2Al2Si2O8的氧化物形式为_________________________ 。
(3)滤渣A经多步可制得粗硅 ,请写出由二氧化硅制得粗硅的化学方程式________________ 。
(4)在工艺流程第三步中,通入过量的二氧化碳时,该反应的离子方程式有_______________ , 得到的滤液与足量Ba(OH)2溶液反应的主要离子方程式为 ____________________ 。
(5)将a g铝土矿经过以上一系列操作之后,最终得到b g Al(不考虑实验过程中操作引起的损耗), 下列说法正确的是____________ 。 (NA表示阿伏伽德罗常数)
A.铝土矿中 Al3+数目小于
B.铝土矿中Al2O3物质的量小于b/54 mol
C.铝土矿中铝元素的质量分数为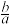 ×100℅
×100℅

已知 2Na2SiO3+2NaAlO2+2H2O === Na2Al2Si2O8↓+4NaOH。 回答下列问题:
(1)在工艺流程第五步中,灼烧所需的实验仪器除酒精灯、坩埚、坩埚钳、玻璃棒之外,还需要
(2)Na2Al2Si2O8的氧化物形式为
(3)滤渣A经多步可制得粗硅 ,请写出由二氧化硅制得粗硅的化学方程式
(4)在工艺流程第三步中,通入过量的二氧化碳时,该反应的离子方程式有
(5)将a g铝土矿经过以上一系列操作之后,最终得到b g Al(不考虑实验过程中操作引起的损耗), 下列说法正确的是
A.铝土矿中 Al3+数目小于

B.铝土矿中Al2O3物质的量小于b/54 mol
C.铝土矿中铝元素的质量分数为
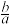 ×100℅
×100℅
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】二氧化硅、氮化硅是性能优异的无机非金属材料。氮化硅的熔点高、硬度大、电绝缘性好,化学性质稳定。合成光导纤维和氮化硅的工艺流程如下。
(1)硅在元素周期表中位置___________ 。
(2)氮化硅中只有极性共价键,则氮化硅化学式为___________ 。
(3)“高温还原”过程中,氧化剂和还原剂的物质的量之比为___________ 。
(4)“高温”反应阶段所得的 粗品中所含的物质如下:
粗品中所含的物质如下:
“操作X”的名称为___________ 。
(5)制备氮化硅的化学方程式为___________ 。
(6)依据性能及生产成本推测氮化硅可能应用在___________(填标号)。

(1)硅在元素周期表中位置
(2)氮化硅中只有极性共价键,则氮化硅化学式为
(3)“高温还原”过程中,氧化剂和还原剂的物质的量之比为
(4)“高温”反应阶段所得的
 粗品中所含的物质如下:
粗品中所含的物质如下:| 组分名称 |  |  | 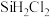 | HCl |  |  |
| 质量分数 | 0.545 | 0.405 | 0.0462 | 0.0003 | 0.00193 | 0.00157 |
| 沸点/℃ | 57.6 | 31.8 | 8.2 | -85 | 12.5 | 75.5 |
(5)制备氮化硅的化学方程式为
(6)依据性能及生产成本推测氮化硅可能应用在___________(填标号)。
| A.建筑材料 | B.计算机芯片 | C.制作切削刀具 | D.制作坩埚 |
您最近一年使用:0次
【推荐3】锆(40Zr)是现代工业中重要的金属原料,具有良好的可塑性,其抗蚀性能强于钛。以锆英石(主要成分是ZrSiO4,还含有少量A12O3、SiO2、Fe2O3等杂质)为原料生产锆及其化合物的流程如图所示:

(1)分馏属于_______ (填“物理变化”或“化学变化”)。
(2)锆英石_______ (填“能”或“不能”)直接用稀盐酸浸取后再分馏,理由是_______ 。
(3)“高温气化”中ZrSiO4发生反应得到ZrC14的反应的化学方程式为_______ 。
(4)流程中ZrC14与水反应后经过滤、洗涤、干燥等操作可获得ZrOC12·8H2O,检验该物质是否洗涤干净的实验操作为_______ 。
(5)工业上使用惰性电极电解K2ZrF6与KC1组成的熔盐来制取金属锆。阳极上的电极反应式为_______ ,每转移0.4mole-,理论上阴极增加的质量为_______ 。

(1)分馏属于
(2)锆英石
(3)“高温气化”中ZrSiO4发生反应得到ZrC14的反应的化学方程式为
(4)流程中ZrC14与水反应后经过滤、洗涤、干燥等操作可获得ZrOC12·8H2O,检验该物质是否洗涤干净的实验操作为
(5)工业上使用惰性电极电解K2ZrF6与KC1组成的熔盐来制取金属锆。阳极上的电极反应式为
您最近一年使用:0次

 )的pH
)的pH )的pH
)的pH

