名校
1 . M、X、Y、Z、Q为相邻两个短周期的主族元素,且原子序数依次增大。这五种元素可形成化合物甲,其结构式如图所示,1mol甲含58mol电子,并且含有1mol配位键。下列说法正确的是
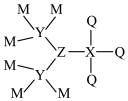
| A.Q是五种元素中原子半径最大的 |
B.水中溶解性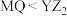 |
| C.Q、Y、Z三种元素的最简单氢化物具有相同的电子数 |
D.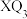 中所有原子均达到 中所有原子均达到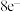 稳定结构 稳定结构 |
您最近一年使用:0次
昨日更新
|
116次组卷
|
3卷引用:2024届甘肃省高三下学期二模化学试题
名校
2 . 下列反应中,原子利用率为100%的是
A.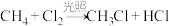 |
B.2CH2=CH2+O2 2 2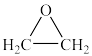 |
C. |
D.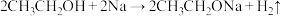 |
您最近一年使用:0次
昨日更新
|
130次组卷
|
2卷引用:广东省普通高中2023-2024学年高一上学期第一次学业水平合格性考试化学试题(1月)
解题方法
3 . 如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,完成下列问题:___________ 。
(2)写出乙池石墨电极的名称为___________ (填“正极”“负极”或“阴极”“阳极”)。写出乙池中电解总反应的化学方程式:___________ 。
(3)甲池中消耗224 mL(标准状况下)O2,此时丙池中理论上最多产生___________ g沉淀,此时乙池中溶液的体积为400 mL,该溶液的pH=___________ 。
(4)若丙中电极不变,将其溶液换成NaOH溶液,开关闭合一段时间后,甲中溶液的pH将___________ (填“增大”“减小”或“不变”,下同),丙中溶液的pH将___________ 。
(5)某同学利用甲醇燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图)。若用于制漂白液,a为电池的___________ 极,电解质溶液最好用___________ 。若用于制Fe(OH)2,使用硫酸钠溶液作电解质溶液,阳极选用___________ 作电极。阳极反应的电极方程式为___________ 。
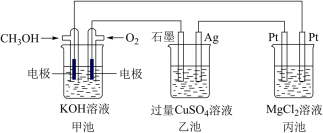
(2)写出乙池石墨电极的名称为
(3)甲池中消耗224 mL(标准状况下)O2,此时丙池中理论上最多产生
(4)若丙中电极不变,将其溶液换成NaOH溶液,开关闭合一段时间后,甲中溶液的pH将
(5)某同学利用甲醇燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图)。若用于制漂白液,a为电池的

您最近一年使用:0次
解题方法
4 . 某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”,进行了如下实验:
请回答:
(1)实验计时方法是从溶液混合开始记时,至___________ 时记时结束。
(2)V1=___________ ,V2=___________ ;设计实验Ⅰ、Ⅲ的目的是探究___________ 对反应速率的影响。
(3)利用实验Ⅲ中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=___________ 。
(4)有同学在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。某同学认为是放热导致溶液温度升高所致,重做Ⅰ号实验,测定过程中溶液不同时间的温度,结果温度没有明显变化。由此你得出的结论是:
①___________ 不是反应速率突然加快的原因;
②可能是反应产物有催化作用。Ⅳ号实验是为验证你的猜测,实验中要加入的少量某种物质是___________ 。
| 实验编号 | 0.01mol•L﹣1 酸性KMnO4溶液 | 0.1mol•L﹣1 H2C2O4溶液 | 水 | 某种物质 | 反应温度/℃ | 反应时间(min) |
| Ⅰ | 2ml | 2ml | 0 | 0 | 20 | 2.1 |
| Ⅱ | V1ml | 2ml | 1ml | 0 | 20 | 5.5 |
| Ⅲ | V2 ml | 2ml | 0 | 0 | 50 | 0.5 |
| Ⅳ | 2ml | 2ml | 0 | 少量 | 20 | 0.2 |
(1)实验计时方法是从溶液混合开始记时,至
(2)V1=
(3)利用实验Ⅲ中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=
(4)有同学在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。某同学认为是放热导致溶液温度升高所致,重做Ⅰ号实验,测定过程中溶液不同时间的温度,结果温度没有明显变化。由此你得出的结论是:
①
②可能是反应产物有催化作用。Ⅳ号实验是为验证你的猜测,实验中要加入的少量某种物质是
您最近一年使用:0次
解题方法
5 . 50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。实验数据如下表。
(1)①从实验装置看,图中还缺少的一种玻璃仪器是___________ 。在实验过程中,该仪器搅拌的正确操作方法是:___________ 。
②近似认为0.55 mol·L-1NaOH溶液和0.50 mol·L-1HCl溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1.则中和热ΔH=___________ (取小数点后一位)。中和热测定时采用稍过量的氢氧化钠的原因:___________ 。
③测定稀硫酸和稀氢氧化钠中和热(中和热为57.3kJ/mol)的实验装置如图所示。某兴趣小组的实验数值结果小于57.3kJ/mol原因可能是___________ (填字母)。
A.实验装置保温、隔热效果差
B.读取混合液的最高温度记为终点温度
C.一次就把NaOH溶液全倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度
④用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和反应的中和热的数值与57.3kJ•mol-1相比较
会___________ (填“偏大”“偏小”或“无影响”)。
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如图:
反应Ⅲ:S(s)+O2(g)=SO2(g) △H3=-297kJ•mol-1
反应Ⅱ的热化学方程式:___________ 。
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能。已知表中所列键能数据:
则N2(g)+3H2(g)═2NH3(g) △H=___________ kJ•mol-1(用小写字母表示)。
(4)一定条件下,在水溶液均为1mol以下离子Cl-、ClO-、ClO 、ClO
、ClO 、ClO
、ClO 的能量(kJ)相对大小如图所示,则3ClO-(aq)=ClO
的能量(kJ)相对大小如图所示,则3ClO-(aq)=ClO +2Cl-(aq)的△H=
+2Cl-(aq)的△H=___________ kJ•mol-1。
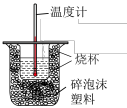
起始温度t1/℃ | 终止温度t2/℃ | 温度差(t1-t2)/℃ | |||
HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(1)①从实验装置看,图中还缺少的一种玻璃仪器是
②近似认为0.55 mol·L-1NaOH溶液和0.50 mol·L-1HCl溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1.则中和热ΔH=
③测定稀硫酸和稀氢氧化钠中和热(中和热为57.3kJ/mol)的实验装置如图所示。某兴趣小组的实验数值结果小于57.3kJ/mol原因可能是
A.实验装置保温、隔热效果差
B.读取混合液的最高温度记为终点温度
C.一次就把NaOH溶液全倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度
④用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和反应的中和热的数值与57.3kJ•mol-1相比较
会
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如图:
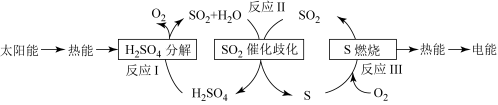
反应Ⅲ:S(s)+O2(g)=SO2(g) △H3=-297kJ•mol-1
反应Ⅱ的热化学方程式:
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能。已知表中所列键能数据:
| 化学键 | H-H | N-H | N≡N |
| 键能kJ/mol | a | b | c |
(4)一定条件下,在水溶液均为1mol以下离子Cl-、ClO-、ClO
 、ClO
、ClO 、ClO
、ClO 的能量(kJ)相对大小如图所示,则3ClO-(aq)=ClO
的能量(kJ)相对大小如图所示,则3ClO-(aq)=ClO +2Cl-(aq)的△H=
+2Cl-(aq)的△H=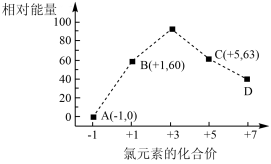
您最近一年使用:0次
名校
6 . 室温下6种稀溶液:①HCl、② 、③
、③ 、④
、④ 、⑤氨水、⑥NaOH;回答下列问题:
、⑤氨水、⑥NaOH;回答下列问题:
(1)中和等体积、pH相同的①②③溶液消耗NaOH最多的是______ (用序号填写)
(2)将等体积、等物质的量浓度的③、⑥混合,则溶液的pH______ 7(填“>”、“<”或“=”)。
(3)常温下,aL pH=13的⑥溶液与bLpH=2的②溶液混合所得混合溶液pH=12(混合过程中溶液体积变化忽略不计),则a∶b=______ 。
(4)已知:HClO的 ;
; 的
的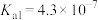 ,
, 。写出向NaClO溶液中通入少量
。写出向NaClO溶液中通入少量 时发生反应的离子方程式:
时发生反应的离子方程式:______ 。
(5)盐碱地(含较多 、NaCl)不利于植物生长,已知
、NaCl)不利于植物生长,已知 的
的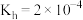 ,当
,当 溶液中
溶液中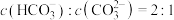 时,溶液的
时,溶液的
______ 。
 、③
、③ 、④
、④ 、⑤氨水、⑥NaOH;回答下列问题:
、⑤氨水、⑥NaOH;回答下列问题:(1)中和等体积、pH相同的①②③溶液消耗NaOH最多的是
(2)将等体积、等物质的量浓度的③、⑥混合,则溶液的pH
(3)常温下,aL pH=13的⑥溶液与bLpH=2的②溶液混合所得混合溶液pH=12(混合过程中溶液体积变化忽略不计),则a∶b=
(4)已知:HClO的
 ;
; 的
的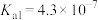 ,
, 。写出向NaClO溶液中通入少量
。写出向NaClO溶液中通入少量 时发生反应的离子方程式:
时发生反应的离子方程式:(5)盐碱地(含较多
 、NaCl)不利于植物生长,已知
、NaCl)不利于植物生长,已知 的
的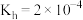 ,当
,当 溶液中
溶液中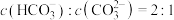 时,溶液的
时,溶液的
您最近一年使用:0次
名校
7 .  为阿伏加德罗常数的值。下列叙述错误的是
为阿伏加德罗常数的值。下列叙述错误的是
 为阿伏加德罗常数的值。下列叙述错误的是
为阿伏加德罗常数的值。下列叙述错误的是A.1mol 中 中 键的个数为 键的个数为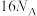 |
B.46g 中 中 杂化的碳原子数为 杂化的碳原子数为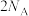 |
C.1L 的HCN溶液中, 的HCN溶液中,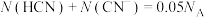 |
D.1mol 晶体中含有 晶体中含有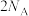 共价键 共价键 |
您最近一年使用:0次
名校
8 . 将 与过量氨水、氯化铵、双氧水混合发生反应,可生成
与过量氨水、氯化铵、双氧水混合发生反应,可生成 或
或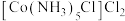 。下列说法正确的是
。下列说法正确的是
 与过量氨水、氯化铵、双氧水混合发生反应,可生成
与过量氨水、氯化铵、双氧水混合发生反应,可生成 或
或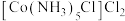 。下列说法正确的是
。下列说法正确的是A.沸点: |
B.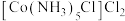 的配位数:5 的配位数:5 |
C. 的VSEPR模型为四面体,分子构型也为四面体 的VSEPR模型为四面体,分子构型也为四面体 |
D.等物质的量的 和 和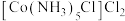 分别与足量 分别与足量 溶液反应生成沉淀的物质的量相等 溶液反应生成沉淀的物质的量相等 |
您最近一年使用:0次
名校
9 . 化学与生活、科学、技术、环境密切相关,下列说法不正确的是
A.实验室配制 溶液时,常将 溶液时,常将 晶体溶入较浓的盐酸中,然后再加水稀释到所需的浓度。 晶体溶入较浓的盐酸中,然后再加水稀释到所需的浓度。 |
| B.农业生产中不能同时使用铵态氮肥和草木灰 |
| C.等离子体和液晶均可做显示屏,其原理相同 |
| D.“暖贴”工作时的能量变化由化学能转化为热能 |
您最近一年使用:0次
10 . 氯化钠(NaCl)是生活中常用的化学品,也是重要的化工生产原料。
Ⅰ.实验室研究氯化钠的性质及制备
(1)下图表示NaCl在水中溶解过程的微观状态示意图。___________ 。
a.干燥的NaCl固体不导电,是由于其中不存在Na+和Cl-
b.由上图可知,水分子在形成自由移动的Na+和Cl-中起到了至关重要的作用
c.NaCl溶液能导电,是由于在电流作用下,其可解离出自由移动的Na+和Cl-
(2)某同学用含钠元素的不同类别物质制备NaCl。化学反应方程式如下:
a.2Na + Cl2 2NaCl
2NaCl
b.NaOH + HCl = NaCl + H2O
c.Na2O + 2HCl = 2NaCl + H2O
d.___________。
① 反应d可为某物质与HCl反应来制得氯化钠,该物质的化学式为___________ 。
② 反应d也可为两种盐溶液相互反应获得氯化钠,该反应的化学方程式为___________ 。
③ 反应c中的原料Na2O的物质类别是碱性氧化物,请依据其类别通性,再列举2个能与Na2O反应的其他物质(用化学式表示)___________ 。
Ⅱ.工业生产中氯化钠的制备
我国食盐的来源主要为海盐、湖盐、井矿盐。粗食盐中除了含泥沙等难溶性杂质外,还含有Ca2+、Mg2+、SO 等可溶性杂质。为得到精制食盐,某同学设计如下除杂流程,向粗盐中依次加入:过量BaCl2溶液、过量Na2CO3溶液、过量NaOH溶液,然后过滤,再在滤液中加入适量盐酸后加热蒸发结晶得纯净的NaCl。
等可溶性杂质。为得到精制食盐,某同学设计如下除杂流程,向粗盐中依次加入:过量BaCl2溶液、过量Na2CO3溶液、过量NaOH溶液,然后过滤,再在滤液中加入适量盐酸后加热蒸发结晶得纯净的NaCl。
(3)①过滤操作中所用到的玻璃仪器有烧杯、漏斗和___________ 。
②用离子方程式表示加入过量Na2CO3溶液的作用Ca2++CO =CaCO3↓和
=CaCO3↓和___________ 。
③ 用离子方程式表示盐酸的作用H+ + OH-=H2O 和___________ 。
Ⅰ.实验室研究氯化钠的性质及制备
(1)下图表示NaCl在水中溶解过程的微观状态示意图。

a.干燥的NaCl固体不导电,是由于其中不存在Na+和Cl-
b.由上图可知,水分子在形成自由移动的Na+和Cl-中起到了至关重要的作用
c.NaCl溶液能导电,是由于在电流作用下,其可解离出自由移动的Na+和Cl-
(2)某同学用含钠元素的不同类别物质制备NaCl。化学反应方程式如下:
a.2Na + Cl2
 2NaCl
2NaCl b.NaOH + HCl = NaCl + H2O
c.Na2O + 2HCl = 2NaCl + H2O
d.___________。
① 反应d可为某物质与HCl反应来制得氯化钠,该物质的化学式为
② 反应d也可为两种盐溶液相互反应获得氯化钠,该反应的化学方程式为
③ 反应c中的原料Na2O的物质类别是碱性氧化物,请依据其类别通性,再列举2个能与Na2O反应的其他物质(用化学式表示)
Ⅱ.工业生产中氯化钠的制备
我国食盐的来源主要为海盐、湖盐、井矿盐。粗食盐中除了含泥沙等难溶性杂质外,还含有Ca2+、Mg2+、SO
 等可溶性杂质。为得到精制食盐,某同学设计如下除杂流程,向粗盐中依次加入:过量BaCl2溶液、过量Na2CO3溶液、过量NaOH溶液,然后过滤,再在滤液中加入适量盐酸后加热蒸发结晶得纯净的NaCl。
等可溶性杂质。为得到精制食盐,某同学设计如下除杂流程,向粗盐中依次加入:过量BaCl2溶液、过量Na2CO3溶液、过量NaOH溶液,然后过滤,再在滤液中加入适量盐酸后加热蒸发结晶得纯净的NaCl。(3)①过滤操作中所用到的玻璃仪器有烧杯、漏斗和
②用离子方程式表示加入过量Na2CO3溶液的作用Ca2++CO
 =CaCO3↓和
=CaCO3↓和③ 用离子方程式表示盐酸的作用H+ + OH-=H2O 和
您最近一年使用:0次



