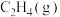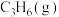1 . 下列实验中的颜色变化与氧化还原反应有关的是
A. 通入品红溶液中,溶液由红色变为无色 通入品红溶液中,溶液由红色变为无色 |
| B.KI溶液滴入AgCl浊液中,沉淀由白色变为黄色 |
C.稀硫酸滴入 溶液中,溶液由黄色变为橙色 溶液中,溶液由黄色变为橙色 |
| D.苯酚长时间放置在空气中,晶体由无色变为粉红色 |
您最近一年使用:0次
2 . 烟酰胺(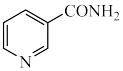 )美白功效一直以来都广受好评。以3-甲基吡啶(
)美白功效一直以来都广受好评。以3-甲基吡啶(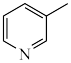 )为原料制取烟酰胺发生如下反应:
)为原料制取烟酰胺发生如下反应:
Ⅰ: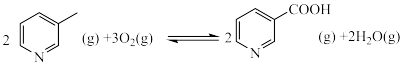


Ⅱ: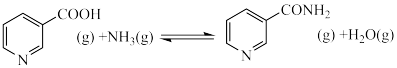

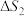
 表示,其中m代表参与形成大π键的原子数,n代表大π键中的电子数)
表示,其中m代表参与形成大π键的原子数,n代表大π键中的电子数)(2)

(3)若向绝热恒容容器中充入一定量的3-甲基吡啶(g)和
 (g),下列选项不能说明反应Ⅰ达到化学平衡状态的是___________(填选项字母)。
(g),下列选项不能说明反应Ⅰ达到化学平衡状态的是___________(填选项字母)。A.容器内 的物质的量不变 的物质的量不变 | B.容器内温度不变 |
| C.容器内气体的密度不变 | D.容器内气体的平均相对分子质量不变 |
(4)3-甲基吡啶的平衡转化率
 随反应温度或压强的变化如图,其中
随反应温度或压强的变化如图,其中 是
是 随
随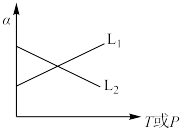
 (g)、
(g)、 (g)和He(g)发生反应I和II,达到平衡时He的分压为
(g)和He(g)发生反应I和II,达到平衡时He的分压为 kPa、烟酸的分压为10kPa。
kPa、烟酸的分压为10kPa。①该温度下,反应II的压强平衡常数

②若其它条件不变,初始时不充入He,而是按2∶3∶1的物质的量之比充入3-甲基吡啶(g)、
 (g)、
(g)、 (g),达到新平衡时,
(g),达到新平衡时, 的转化率将
的转化率将
您最近一年使用:0次
解题方法
3 . 铌被广泛应用于航空航天、电子、原子能、超导材料及新型功能材料等领域,是一种十分重要的战略物资。 常用于萃取稀土金属铌:
常用于萃取稀土金属铌:
 。某温度下,萃取过程中溶液中
。某温度下,萃取过程中溶液中 与时间的变化关系如图所示。下列叙述正确的是
与时间的变化关系如图所示。下列叙述正确的是
 常用于萃取稀土金属铌:
常用于萃取稀土金属铌:
 。某温度下,萃取过程中溶液中
。某温度下,萃取过程中溶液中 与时间的变化关系如图所示。下列叙述正确的是
与时间的变化关系如图所示。下列叙述正确的是
A.其他条件不变, 时萃取反应已停止 时萃取反应已停止 |
B. 增大,萃取反应平衡向左移动,平衡常数减小 增大,萃取反应平衡向左移动,平衡常数减小 |
C. min、 min、 min时萃取反应的正反应速率: min时萃取反应的正反应速率: |
D.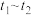 min内, min内,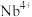 的平均反应速率 的平均反应速率 |
您最近一年使用:0次
2024-06-10更新
|
39次组卷
|
2卷引用:2024届河北省保定市九县一中高三下学期三模化学试题
名校
4 . 我国科学家在含铂高效催化剂作用下把二氧化碳高效转化为清洁液态燃料—甲醇,反应原理为 。回答下列问题:
。回答下列问题:
(1)已知:①
②
③
则 的反应热
的反应热
_______  。
。
(2)在绝热恒容的密闭容器中进行反应 ,下列示意图正确且能说明该反应进行到
,下列示意图正确且能说明该反应进行到 时刻达到平衡状态的是_______(填标号)。
时刻达到平衡状态的是_______(填标号)。
(3)在恒温恒容的密闭容器中进行反应 ,下列有利于提高
,下列有利于提高 的平衡转化率的措施有_______(填标号)。
的平衡转化率的措施有_______(填标号)。
(4)恒压下将 和
和 按体积比1:3混合,在不同催化剂作用下发生如下反应:
按体积比1:3混合,在不同催化剂作用下发生如下反应:
反应Ⅰ:
反应Ⅱ:
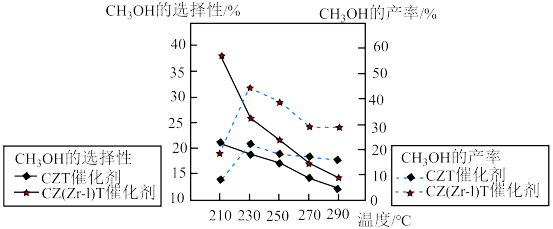
在相同的时间段内 的选择性和产率随温度的变化如图所示,其中
的选择性和产率随温度的变化如图所示,其中 的选择性=
的选择性= 。
。 产率随温度升高而下降的原因是
产率随温度升高而下降的原因是_______ 。
②在上述条件下合成甲醇的工业条件是_______ (填标号)。
A.CZ(Zr-1)T催化剂 B.210℃ C.230℃ D.CZT催化剂
(5)一定条件下,将2mol 和4mol
和4mol 充入密闭容器中,发生反应
充入密闭容器中,发生反应 。
。 的平衡转化率与温度、平衡总压强的关系如图所示。
的平衡转化率与温度、平衡总压强的关系如图所示。 、
、 、
、 由大到小的顺序为
由大到小的顺序为_______ 。
②255℃时,该反应的压强平衡常数
_______ 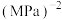 (
( 为以分压表示的平衡常数,分压=总压×物质的量分数。计算结果保留1位小数)。
为以分压表示的平衡常数,分压=总压×物质的量分数。计算结果保留1位小数)。
(6)利用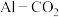 电池(工作原理如图所示)能有效地将
电池(工作原理如图所示)能有效地将 转化成化工原料草酸铝
转化成化工原料草酸铝 。电池的正极反应式为
。电池的正极反应式为 。正极反应过程中,
。正极反应过程中, 是催化剂,催化过程可表示为:①
是催化剂,催化过程可表示为:① ,②……。
,②……。_______ 。
 。回答下列问题:
。回答下列问题:(1)已知:①

②

③

则
 的反应热
的反应热
 。
。(2)在绝热恒容的密闭容器中进行反应
 ,下列示意图正确且能说明该反应进行到
,下列示意图正确且能说明该反应进行到 时刻达到平衡状态的是_______(填标号)。
时刻达到平衡状态的是_______(填标号)。A.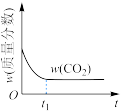 | B.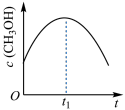 |
C.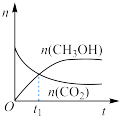 | D.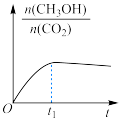 |
(3)在恒温恒容的密闭容器中进行反应
 ,下列有利于提高
,下列有利于提高 的平衡转化率的措施有_______(填标号)。
的平衡转化率的措施有_______(填标号)。| A.使用更加高效的催化剂 | B.充入少量氦气(He) |
C.减小起始投料比 | D.将水蒸气及时分离出来 |
(4)恒压下将
 和
和 按体积比1:3混合,在不同催化剂作用下发生如下反应:
按体积比1:3混合,在不同催化剂作用下发生如下反应:反应Ⅰ:

反应Ⅱ:

在相同的时间段内
 的选择性和产率随温度的变化如图所示,其中
的选择性和产率随温度的变化如图所示,其中 的选择性=
的选择性= 。
。
 产率随温度升高而下降的原因是
产率随温度升高而下降的原因是②在上述条件下合成甲醇的工业条件是
A.CZ(Zr-1)T催化剂 B.210℃ C.230℃ D.CZT催化剂
(5)一定条件下,将2mol
 和4mol
和4mol 充入密闭容器中,发生反应
充入密闭容器中,发生反应 。
。 的平衡转化率与温度、平衡总压强的关系如图所示。
的平衡转化率与温度、平衡总压强的关系如图所示。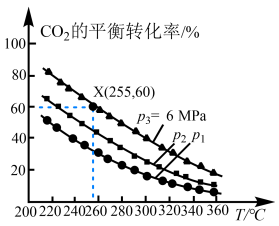
 、
、 、
、 由大到小的顺序为
由大到小的顺序为②255℃时,该反应的压强平衡常数

 (
( 为以分压表示的平衡常数,分压=总压×物质的量分数。计算结果保留1位小数)。
为以分压表示的平衡常数,分压=总压×物质的量分数。计算结果保留1位小数)。(6)利用
 电池(工作原理如图所示)能有效地将
电池(工作原理如图所示)能有效地将 转化成化工原料草酸铝
转化成化工原料草酸铝 。电池的正极反应式为
。电池的正极反应式为 。正极反应过程中,
。正极反应过程中, 是催化剂,催化过程可表示为:①
是催化剂,催化过程可表示为:① ,②……。
,②……。
您最近一年使用:0次
5 . 下列实验操作和现象及实验目的均正确的是
| 选项 | 实验操作和现象 | 实验目的 |
| A | 向40mL沸水中滴加20mLFeCl3饱和溶液,继续长时间煮沸,停止加热 | 制备Fe(OH)3胶体 |
| B | 将乙酸和等物质的量的乙醇混合,在浓硫酸、加热条件下充分反应后,向其中滴加石蕊溶液,溶液变红 | 证明乙酸和乙醇的酯化反应是可逆反应 |
| C | 将新鲜菠菜剪碎、研磨、溶解、过滤,向滤液中加入少量稀硝酸后,再加入几滴KSCN溶液,溶液变红 | 证明菠菜中含有铁元素 |
| D | 取少量碘仿(CHI3)于试管中,用稀硝酸酸化,加入硝酸银溶液,有黄色沉淀生成 | 检验碘仿中有碘元素 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
6 . 某温度下,向恒容密闭容器中充入等物质的量浓度的X(g)和Y(g),同时发生两个反应:① ,②
,② 。反应①的速率可表示为
。反应①的速率可表示为 ,反应②的速率可表示为
,反应②的速率可表示为 (
( 、
、 为速率常数)。反应体系中组分X(g)、W(g)的物质的量浓度c随时间的变化情况如图所示。下列说法正确的是
为速率常数)。反应体系中组分X(g)、W(g)的物质的量浓度c随时间的变化情况如图所示。下列说法正确的是
 ,②
,② 。反应①的速率可表示为
。反应①的速率可表示为 ,反应②的速率可表示为
,反应②的速率可表示为 (
( 、
、 为速率常数)。反应体系中组分X(g)、W(g)的物质的量浓度c随时间的变化情况如图所示。下列说法正确的是
为速率常数)。反应体系中组分X(g)、W(g)的物质的量浓度c随时间的变化情况如图所示。下列说法正确的是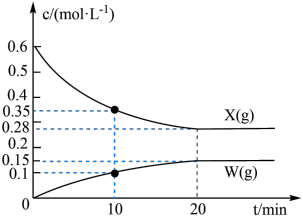
A.10min时,Y(g)的反应速率为0.025 |
| B.体系中W和M的浓度之比保持不变,说明反应已平衡 |
C.平衡时,反应②的平衡常数 |
| D.反应②的活化能比反应①的活化能更大 |
您最近一年使用:0次
名校
解题方法
7 . 探究金属及其化合物的性质,依据下列实验的现象所得出的结论正确的是
| 实验方案 | 现象 | 结论 | |
| A | 往 溶液中滴加浓的 溶液中滴加浓的 溶液 溶液 | 溶液变浑浊 |  难溶于水 难溶于水 |
| B | 往 溶液中滴加KSCN溶液,再加入少量 溶液中滴加KSCN溶液,再加入少量 固体 固体 | 溶液先变成血红色,后无明显变化 |  与 与 的反应不可逆 的反应不可逆 |
| C | 向无水硫酸铜白色粉末中滴加2-3滴蒸馏水 | 白色粉末变蓝 | 无水硫酸铜可用做干燥剂 |
| D | 向 溶液中通过量的 溶液中通过量的 | 溶液变浑浊 |  酸性强于 酸性强于 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
8 . 下列实验探究方案能达到探究目的的是
| 选项 | 探究方案 | 探究目的 |
| A | 室温下,向浓度均为 0.1mol·L-1的NaCl和 NaI的混合溶液中滴加几滴AgNO3溶液,观察生成沉淀的颜色 | 比较Ksp(AgCl)、Ksp(AgI)的大小 |
| B | 室温下,用pH计分别测量CH3COONa溶液和NaNO2溶液的pH,比较pH大小 | 比较CH3COO-、NO 结合 H+的能力 结合 H+的能力 |
| C | 室温下,取1 mL 0.1 mol·L-1 KI溶液和2 mL 0.1 mol·L-1 FeCl3溶液充分反应后,再加2 mL CCl4振荡、静置后,取上层清液滴加少量KSCN溶液,观察溶液颜色变化 | Fe3+和I-的反应有一定的限度 |
| D | 向淀粉溶液中加入少量稀硫酸,加热,再加入银氨溶液水浴加热,观察是否有银镜生成 | 淀粉水解产物具有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
9 . NA为阿伏加德罗常数的值,下列说法错误的是
| A.8g CH4含有中子数为3NA |
| B.标况下,11.2L乙烷和丙烯的混合气体中所含碳氢键数为3NA |
| C.12g NaHSO4中含有0.2NA个阳离子 |
| D.0.1mol H2和0.1 mol I2于密闭容器中充分反应后,分子总数为0.2NA |
您最近一年使用:0次
解题方法
10 . 我国科学家开发出了高效催化剂ZnZrOx,实现CO2催化还原合成乙烯和丙烯,反应原理如下:
Ⅰ.
 ;
;
Ⅱ.
 。
。
回答下列问题:
(1)在周期表中, 和
和 相邻,二者中第二电离能与第一电离能之差较大的是
相邻,二者中第二电离能与第一电离能之差较大的是_________ (填“ ”或“
”或“ ”)。
”)。
(2)已知几种可燃物的燃烧热如下:

 。则
。则
_________  。
。
(3)在密闭容器中充入适量CO2和H2,发生上述反应。CO2的平衡转化率与温度、投料比 的关系如图所示。代表CO2平衡转化率与投料比关系的曲线是
的关系如图所示。代表CO2平衡转化率与投料比关系的曲线是______ (填“①”或“②”),判断的依据是_________ 。 CO2和5
CO2和5 H2,同时发生反应Ⅰ和反应Ⅱ,测得单位时间内CO2的转化率与催化剂Cat1,Cat2及温度的关系如图所示。
H2,同时发生反应Ⅰ和反应Ⅱ,测得单位时间内CO2的转化率与催化剂Cat1,Cat2及温度的关系如图所示。_________ (填“Cat1”或“Cat2”);b点_________ (填“达到”或“未达到”)平衡状态,判断依据是_________ 。
②Cat1作用下,温度高于400℃时,b→c过程中CO2转化率降低,可能的原因是_________ 。
③400℃时,CO2转化率为75%,此时容器中H2O的物质的量为_________  。
。
(5)T℃时,在1L恒容密闭容器中充入1.0 CO2和2.5
CO2和2.5 H2,同时发生反应Ⅰ和反应Ⅱ,达到平衡时CO2转化率为50%,乙烯的选择性为50%,在该条件下反应Ⅰ的平衡常数
H2,同时发生反应Ⅰ和反应Ⅱ,达到平衡时CO2转化率为50%,乙烯的选择性为50%,在该条件下反应Ⅰ的平衡常数
_________  。提示:乙烯的选择性
。提示:乙烯的选择性 。
。
Ⅰ.

 ;
;Ⅱ.

 。
。回答下列问题:
(1)在周期表中,
 和
和 相邻,二者中第二电离能与第一电离能之差较大的是
相邻,二者中第二电离能与第一电离能之差较大的是 ”或“
”或“ ”)。
”)。(2)已知几种可燃物的燃烧热如下:
物质 |
|
|
|
燃烧热 | -285.8 | -1411.0 | -2058.0 |

 。则
。则
 。
。(3)在密闭容器中充入适量CO2和H2,发生上述反应。CO2的平衡转化率与温度、投料比
 的关系如图所示。代表CO2平衡转化率与投料比关系的曲线是
的关系如图所示。代表CO2平衡转化率与投料比关系的曲线是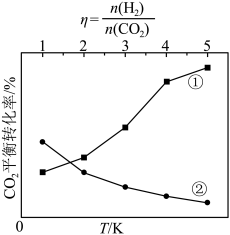
 CO2和5
CO2和5 H2,同时发生反应Ⅰ和反应Ⅱ,测得单位时间内CO2的转化率与催化剂Cat1,Cat2及温度的关系如图所示。
H2,同时发生反应Ⅰ和反应Ⅱ,测得单位时间内CO2的转化率与催化剂Cat1,Cat2及温度的关系如图所示。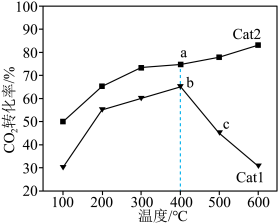
②Cat1作用下,温度高于400℃时,b→c过程中CO2转化率降低,可能的原因是
③400℃时,CO2转化率为75%,此时容器中H2O的物质的量为
 。
。(5)T℃时,在1L恒容密闭容器中充入1.0
 CO2和2.5
CO2和2.5 H2,同时发生反应Ⅰ和反应Ⅱ,达到平衡时CO2转化率为50%,乙烯的选择性为50%,在该条件下反应Ⅰ的平衡常数
H2,同时发生反应Ⅰ和反应Ⅱ,达到平衡时CO2转化率为50%,乙烯的选择性为50%,在该条件下反应Ⅰ的平衡常数
 。提示:乙烯的选择性
。提示:乙烯的选择性 。
。
您最近一年使用:0次