名校
1 . 甲烷水蒸气催化重整是制备高纯氢的方法之一、反应如下:
反应i.
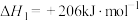 ;
;
反应ii.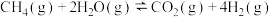
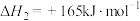 。
。
回答下列问题:
(1)反应iii. 的
的
________  ;若在一定温度下的容积固定的密闭容器中进行该反应,则可以提高CO2转化率的措施有
;若在一定温度下的容积固定的密闭容器中进行该反应,则可以提高CO2转化率的措施有________ ,下列说法可以证明该反应已达到平衡状态的是________ (填字母)。
a. b.容器内气体压强不再改变
b.容器内气体压强不再改变
c.H2的浓度不再改变 d.CO和H2O的浓度之比为1:1
(2)对于反应i,向体积为 的恒容密闭容器中,按
的恒容密闭容器中,按 投料。
投料。
①若在恒温条件下,反应达到平衡时CH4的转化率为50%,则平衡时容器内的压强与起始压强之比为___________ (最简单整数比)。
②其他条件相同时,在不同催化剂(I、Ⅱ、Ⅲ)作用下,反应相同时间,CH4的转化率随反应温度的变化如图所示。a点___________ (填“是”或“不是”)化学平衡状态。
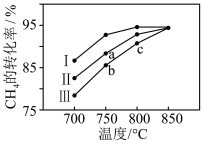
(3)某科研小组研究了反应ii的动力学,获得其速率方程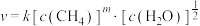 ,k为速率常数(只受温度影响),m为
,k为速率常数(只受温度影响),m为 的反应级数。在某温度下进行实验,测得各组分初浓度和反应初速率如下:
的反应级数。在某温度下进行实验,测得各组分初浓度和反应初速率如下:
CH4的反应级数m=___________ ,当实验2进行到某时刻,测得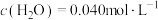 ,则此时的反应速率v=
,则此时的反应速率v=___________  (已知
(已知 )。
)。
(4)甲烷水蒸气催化重整制备高纯氢只发生反应i、反应ii.在恒温、恒压条件下,
 和
和
 反应达平衡时,
反应达平衡时, 的转化率为a,
的转化率为a, 的物质的量为
的物质的量为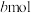 ,则反应i的平衡常数
,则反应i的平衡常数
___________ [写出含有a、b的计算式;对于反应 ,
,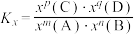 ,x为物质的量分数]。
,x为物质的量分数]。
反应i.

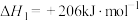 ;
;反应ii.
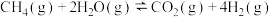
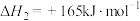 。
。回答下列问题:
(1)反应iii.
 的
的
 ;若在一定温度下的容积固定的密闭容器中进行该反应,则可以提高CO2转化率的措施有
;若在一定温度下的容积固定的密闭容器中进行该反应,则可以提高CO2转化率的措施有a.
 b.容器内气体压强不再改变
b.容器内气体压强不再改变c.H2的浓度不再改变 d.CO和H2O的浓度之比为1:1
(2)对于反应i,向体积为
 的恒容密闭容器中,按
的恒容密闭容器中,按 投料。
投料。①若在恒温条件下,反应达到平衡时CH4的转化率为50%,则平衡时容器内的压强与起始压强之比为
②其他条件相同时,在不同催化剂(I、Ⅱ、Ⅲ)作用下,反应相同时间,CH4的转化率随反应温度的变化如图所示。a点

(3)某科研小组研究了反应ii的动力学,获得其速率方程
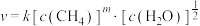 ,k为速率常数(只受温度影响),m为
,k为速率常数(只受温度影响),m为 的反应级数。在某温度下进行实验,测得各组分初浓度和反应初速率如下:
的反应级数。在某温度下进行实验,测得各组分初浓度和反应初速率如下:| 实验序号 |  |  |  |
| 1 | 0.100 | 0.100 |  |
| 2 | 0.100 | 0.200 |  |
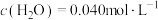 ,则此时的反应速率v=
,则此时的反应速率v= (已知
(已知 )。
)。(4)甲烷水蒸气催化重整制备高纯氢只发生反应i、反应ii.在恒温、恒压条件下,

 和
和
 反应达平衡时,
反应达平衡时, 的转化率为a,
的转化率为a, 的物质的量为
的物质的量为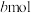 ,则反应i的平衡常数
,则反应i的平衡常数
 ,
,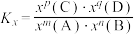 ,x为物质的量分数]。
,x为物质的量分数]。
您最近一年使用:0次
名校
2 . 将5 mL 0.005 mol·L-1 FeCl3溶液和5 mL 0.015 mol·L-1 KSCN溶液混合,达到平衡后呈红色,再将混合液分为5份,分别进行如下实验:
下列说法不正确的是
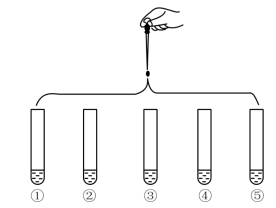 | 实验①:滴加四滴水,振荡 |
| 实验②:滴加四滴饱和的FeCl3溶液,振荡 | |
| 实验③:滴加四滴1 mol·L-1KCl溶液,振荡 | |
| 实验④:滴加四滴1 mol·L-1KSCN溶液,振荡 | |
| 实验⑤:滴加四滴1 mol·L-1NaOH 溶液,振荡 |
| A.对比实验①和②,为了证明增大反应物浓度,平衡正向移动 |
| B.对比实验①和③,为了证明增大生成物浓度,平衡逆向移动 |
| C.对比实验①和④,为了证明增大反应物浓度,平衡正向移动 |
| D.对比实验①和⑤,为了证明减小反应物浓度,平衡逆向移动 |
您最近一年使用:0次
2021-10-13更新
|
215次组卷
|
11卷引用:【区级联考】北京市海淀区2019届高三上学期期中考试化学试题
【区级联考】北京市海淀区2019届高三上学期期中考试化学试题江苏省2021届高三上学期新高考质量检测模拟考试化学试题福建省三明市四地四校2021-2022学年高二上学期期中联考协作卷化学试题上海财经大学附属中学2022-2023学年高二上学期期中考试化学试题(已下线)题型118 化学平衡移动的影响因素山西省太原市山西大学附属中学2019-2020学年高二上学期12月月考化学试题河北省石家庄市第二中学2019-2020高一下期末考试化学模拟试题(三)四川省成都市蒲江县蒲江中学2019-2020学年高二上学期12月月考化学试题福建省三明第一中学2021-2022学年高二上学期第一次月考化学试题福建省莆田市擢英中学2021-2022学年高二上学期第一次月考化学试卷作业(十一) 温度、浓度对化学平衡的影响
名校
3 . 将5 mL 0.005 mol/L FeCl3溶液和5 mL 0.015 mol/L KSCN溶液混合,达到平衡后呈红色。再将混合液分为5份,分别进行如下实验:

下列说法不正确的是

下列说法不正确的是
| A.对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动 |
| B.对比实验①和③,为了证明增加反应物浓度,平衡发生逆向移动 |
| C.对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动 |
| D.对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动 |
您最近一年使用:0次
2018-11-13更新
|
244次组卷
|
7卷引用:【区级联考】北京市海淀区2019届高三第一学期期中考试化学试题
【区级联考】北京市海淀区2019届高三第一学期期中考试化学试题【校级联考】甘肃省民乐一中、张掖二中2019届高三上学期第一次调研考试(12月)理科综合化学试题四川省广安市邻水实验学校2018-2019学年高二上学期第三次月考化学试题福建省南安第一中学2019-2020学年高二上学期第一次阶段考试化学试题四川省邻水市实验中学2019-2020学年高二12月月考化学试题(已下线)2019年12月25日《每日一题》人教版(选修4)—— 影响化学平衡的因素(已下线)2.3.1 浓度对化学平衡的影响(重点练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)
4 . 五氧化二钒( )广泛用作合金添加剂及有机化工催化剂。从废钒催化剂(含有
)广泛用作合金添加剂及有机化工催化剂。从废钒催化剂(含有 、
、 及少量
及少量 、
、 等杂质)回收
等杂质)回收 的部分工艺流程如下:
的部分工艺流程如下:

已知:
① 可溶于热水,不溶于乙醇;
可溶于热水,不溶于乙醇;
②常温下,部分含钒物质在水中的溶解性见下表;
③+5价钒在溶液中的主要存在形式与溶液pH的关系见下表;
回答下列问题:
(1)“一系列操作”包括过滤、洗涤、干燥等,洗涤时最好选用的试剂为___________(填字母)。
(2)“中和”时调节pH为7的目的,一是将 转化为
转化为 ;二是
;二是___________ 。
(3)“沉钒”前需将溶液先进行“离子交换”和“洗脱”,再加入 生成
生成 “离子交换”和“洗脱”两步操作可简单表示为:
“离子交换”和“洗脱”两步操作可简单表示为: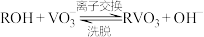 (ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈___________ (填“酸性”或“碱性”),理由是___________ 。
(4)“沉钒”析出的 晶体需要洗涤,证明
晶体需要洗涤,证明 已洗涤干净的实验操作及现象为
已洗涤干净的实验操作及现象为___________ 。
(5)写出“煅烧”中发生反应的化学方程式___________ 。
(6)钒(V)的某种氧化物的晶胞结构如图所示。该晶体的化学式为___________ 。

 )广泛用作合金添加剂及有机化工催化剂。从废钒催化剂(含有
)广泛用作合金添加剂及有机化工催化剂。从废钒催化剂(含有 、
、 及少量
及少量 、
、 等杂质)回收
等杂质)回收 的部分工艺流程如下:
的部分工艺流程如下:
已知:
①
 可溶于热水,不溶于乙醇;
可溶于热水,不溶于乙醇;②常温下,部分含钒物质在水中的溶解性见下表;
| 物质 |  |  |  |  |
| 溶解性 | 难溶 | 可溶 | 易溶 | 难溶 |
| pH | <6 | 6~8 | 8~10 | 10~12 |
| 主要离子 |  |  |  |  |
(1)“一系列操作”包括过滤、洗涤、干燥等,洗涤时最好选用的试剂为___________(填字母)。
| A.冷水 | B.热水 | C.乙醇 | D.NaOH溶液 |
(2)“中和”时调节pH为7的目的,一是将
 转化为
转化为 ;二是
;二是(3)“沉钒”前需将溶液先进行“离子交换”和“洗脱”,再加入
 生成
生成 “离子交换”和“洗脱”两步操作可简单表示为:
“离子交换”和“洗脱”两步操作可简单表示为: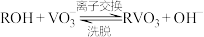 (ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈(4)“沉钒”析出的
 晶体需要洗涤,证明
晶体需要洗涤,证明 已洗涤干净的实验操作及现象为
已洗涤干净的实验操作及现象为(5)写出“煅烧”中发生反应的化学方程式
(6)钒(V)的某种氧化物的晶胞结构如图所示。该晶体的化学式为

您最近一年使用:0次
名校
解题方法
5 . 资料显示,I2-KI溶液可以清洗银镜。某小组同学设计实验探究银镜在I2-KI溶液中的溶解情况。
已知:I2微溶于水,易溶于KI溶液,并发生反应I2+I− I
I (棕色),I2和I
(棕色),I2和I 氧化性几乎相同;[Ag(S2O3)2]3−在水溶液中无色。
氧化性几乎相同;[Ag(S2O3)2]3−在水溶液中无色。
探究1:I2-KI溶液(向1mol·L−1KI溶液中加入I2至饱和)溶解银镜
【实验i】_____ 。
(2)能证明②中Ag已全部反应、未被包裹在黄色固体内的实验证据是_____ 。
探究2:I2-KI溶液能快速溶解银镜的原因
【实验ii~iv】向附着银镜的试管中加入相应试剂至浸没银镜,记录如下:
(3)ⅰi中,搅拌后银镜继续溶解的原因是_____ 。
(4)由i、iii可得到的结论是_____ 。
(5)设计iv的目的是_____ 。
探究3:I−的作用
【实验v】
说明:本实验中,检流计读数越大,说明氧化剂氧化性(或还原剂还原性)越强。
(6)步骤1接通电路后,正极的电极反应物为_____ 。
(7)补全步骤3的操作及现象:_____ ,_____ 。
(8)综合上述探究,从反应速率和物质性质的角度分析i中I2-KI溶液能快速全部溶解银镜的原因:_____ 。
已知:I2微溶于水,易溶于KI溶液,并发生反应I2+I−
 I
I (棕色),I2和I
(棕色),I2和I 氧化性几乎相同;[Ag(S2O3)2]3−在水溶液中无色。
氧化性几乎相同;[Ag(S2O3)2]3−在水溶液中无色。探究1:I2-KI溶液(向1mol·L−1KI溶液中加入I2至饱和)溶解银镜
【实验i】
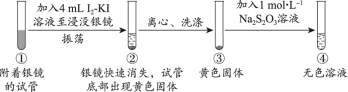
(2)能证明②中Ag已全部反应、未被包裹在黄色固体内的实验证据是
探究2:I2-KI溶液能快速溶解银镜的原因
【实验ii~iv】向附着银镜的试管中加入相应试剂至浸没银镜,记录如下:
| 序号 | 加入试剂 | 实验现象 |
| ⅰi | 4mL饱和碘水(向水中加入I2至饱和, | 30min后,银镜少部分溶解,溶液棕黄色变浅;放置24h后,与紫黑色固体接触部分银镜消失,紫黑色固体表面上有黄色固体,上层溶液接近无色;搅拌后,银镜继续溶解 |
| ⅱi | 4mL饱和碘水和0.66gKI固体(溶液中KI约1mol·L−1) | 15min后银镜部分溶解,溶液棕黄色变浅;放置24h后,试管壁上仍有未溶解的银镜,溶液无色 |
| iv | 4mL1mol·L−1KI溶液 | 放置24h,银镜不溶解,溶液无明显变化 |
(4)由i、iii可得到的结论是
(5)设计iv的目的是
探究3:I−的作用
【实验v】
| 实验装置 | 实验步骤及现象 |
| 1.按左图搭好装置,接通电路,检流计指针向 右微弱偏转,检流计读数为amA; 2.向石墨电极附近滴加饱和碘水,指针继续向 右偏转,检流计读数为bmA(b>a); 3.向左侧烧杯中加入_____,指针继续向右偏转,检流计读数cmA(c>b),有_____生成。 |
(6)步骤1接通电路后,正极的电极反应物为
(7)补全步骤3的操作及现象:
(8)综合上述探究,从反应速率和物质性质的角度分析i中I2-KI溶液能快速全部溶解银镜的原因:
您最近一年使用:0次
2024-04-13更新
|
433次组卷
|
3卷引用:北京市海淀区2023-2024学年高三下学期期中练习化学试题
解题方法
6 . 探究铁单质及其化合物的性质,由操作、现象能得出正确结论的是
| 选项 | 操作 | 现象 | 结论 |
| A. | 向2mL 0.1mol·L⁻¹FeCl3溶液加入 2mL 0.01mol·L⁻¹KI溶液,再滴入数滴AgNO3溶液 | 出现黄色浑浊 | 证明 FeCl3和 KI反应存在限度 |
| B. | 将Fe粉与S粉混合在惰性气体中加热,再将反应后的产物溶于稀硫酸 | 得到黑色固体,该固体溶于稀硫酸后得浅绿色溶液 | 证明Fe与S生成了FeS |
| C. | 向2mL 0.01mol·L⁻¹Fe(SCN)3溶液加入少量 Fe粉,振荡后静置 | 溶液的血红色变浅 | 证明Fe 粉与Fe3⁺反应,降低Fe3⁺浓度,使生成Fe(SCN)3平衡逆向移动 |
| D. | 将SO2气体通入 Fe(NO3)3和BaCl2的混合溶液 | 溶液的棕黄色变浅、产生白色沉淀 | 白色沉淀为 BaSO3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
7 .  溶于一定量水中,溶液a呈浅棕黄色。加入少量浓HCl,溶液b较溶液a黄色加深。
溶于一定量水中,溶液a呈浅棕黄色。加入少量浓HCl,溶液b较溶液a黄色加深。
已知: (黄色);浓度较小时
(黄色);浓度较小时 (用
(用 表示)几乎无色;
表示)几乎无色;
取溶液进行如下实验,对现象的分析不正确 的是
 溶于一定量水中,溶液a呈浅棕黄色。加入少量浓HCl,溶液b较溶液a黄色加深。
溶于一定量水中,溶液a呈浅棕黄色。加入少量浓HCl,溶液b较溶液a黄色加深。已知:
 (黄色);浓度较小时
(黄色);浓度较小时 (用
(用 表示)几乎无色;
表示)几乎无色;取溶液进行如下实验,对现象的分析
A.测溶液a的 ,证明 ,证明 发生了水解 发生了水解 |
B.向b中加入 后,不会产生白色沉淀 后,不会产生白色沉淀 |
C.向b中滴入KSCN溶液变血红色,说明 的配位键稳定性大于 的配位键稳定性大于 |
D.将溶液a滴入沸水中,加热,检测有丁达尔效应,说明加热能促进 水解 水解 |
您最近一年使用:0次
解题方法
8 . 草酸亚铁晶体( FeC2O4·2H2O,相对分子质量为180)呈淡黄色,可用作照相显影剂。某实验小组对其进行了一系列探究。
I.采用如下装置(可重复选用)进行实验探究纯净草酸亚铁晶体受热分解的产物。

(1)装置D的名称为___________ ,作用是_________________________________ 。
(2)按照气流从左到右的方向,上述装置的连接顺序为a→_____________ →d→e→b→c→尾气处理装置(填仪器接口的小字母编号)。
(3)能证明分解产物中存在CO的现象是_____________________ 。
II.将54.0g草酸亚铁晶体在氮气的氛围中加热分解,得到分解产物的热重曲线(样品质量随温度的变化情况)如图所示:

(4)B点时,固体只含有一种铁的氧化物,则所得固体的化学式为__________ 。
Ⅲ.文献表明:相同条件下,草酸根(C2O )的还原性强于Fe2+。为检验这一结论进行以下实验。
)的还原性强于Fe2+。为检验这一结论进行以下实验。
资料:ⅰ.草酸(H2C2O4)为二元弱酸。
ⅱ.三水三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O为翠绿色晶体,光照易分解。其水溶液中存在:[Fe(C2O4)3] 3− Fe3++ 3C2O
Fe3++ 3C2O K=6.3×10−21
K=6.3×10−21
通过Fe3+和C2O 在溶液中的反应比较Fe2+和C2O
在溶液中的反应比较Fe2+和C2O 的还原性强弱
的还原性强弱
(5)取实验中的少量晶体洗净,配成溶液,滴加KSCN溶液,不变红。继续加入硫酸,溶液变红。加硫酸后溶液变红的原因是__________________________________ 。
(6)经检验,翠绿色晶体为K3[Fe(C2O4)3]·3H2O。请设计实验,确认实验中没有发生氧化还原反应的操作和现象是_____________ 。
I.采用如下装置(可重复选用)进行实验探究纯净草酸亚铁晶体受热分解的产物。

(1)装置D的名称为
(2)按照气流从左到右的方向,上述装置的连接顺序为a→
(3)能证明分解产物中存在CO的现象是
II.将54.0g草酸亚铁晶体在氮气的氛围中加热分解,得到分解产物的热重曲线(样品质量随温度的变化情况)如图所示:

(4)B点时,固体只含有一种铁的氧化物,则所得固体的化学式为
Ⅲ.文献表明:相同条件下,草酸根(C2O
 )的还原性强于Fe2+。为检验这一结论进行以下实验。
)的还原性强于Fe2+。为检验这一结论进行以下实验。资料:ⅰ.草酸(H2C2O4)为二元弱酸。
ⅱ.三水三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O为翠绿色晶体,光照易分解。其水溶液中存在:[Fe(C2O4)3] 3−
 Fe3++ 3C2O
Fe3++ 3C2O K=6.3×10−21
K=6.3×10−21通过Fe3+和C2O
 在溶液中的反应比较Fe2+和C2O
在溶液中的反应比较Fe2+和C2O 的还原性强弱
的还原性强弱| 操作 | 现象 |
| 在避光处,向10mL0.5mol∙L-1FeCl3溶液中缓慢加入0.5mol∙L-1K2C2O4溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤 | 得到翠绿色溶液和翠绿色晶体 |
(6)经检验,翠绿色晶体为K3[Fe(C2O4)3]·3H2O。请设计实验,确认实验中没有发生氧化还原反应的操作和现象是
您最近一年使用:0次
名校
解题方法
9 . 某小组利用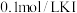 溶液和
溶液和 溶液通过实验验证
溶液通过实验验证 为可逆反应,回答下列问题:
为可逆反应,回答下列问题:
(1)配制 溶液,需称量固体KI
溶液,需称量固体KI___________  (精确到0.01)。
(精确到0.01)。
(2)实验验证:向 溶液加入
溶液加入 溶液,溶液颜色加深,充分反应后,再滴加
溶液,溶液颜色加深,充分反应后,再滴加___________ 溶液,观察到___________ 现象证明该反应为可逆反应。
(3)实验探究:向 溶液和
溶液和 溶液反应后溶液中加入
溶液反应后溶液中加入 ,振荡、静置,液体分层,下层溶液呈紫红色,上层溶液呈淡黄色,若要检验淡黄色溶液中是否含碘单质,可以进行的实验操作是
,振荡、静置,液体分层,下层溶液呈紫红色,上层溶液呈淡黄色,若要检验淡黄色溶液中是否含碘单质,可以进行的实验操作是___________ 。
(4)有小组同学采用电化学装置(如图所示)从平衡移动的角度进行了验证。

①向烧杯中分别加入相同体积的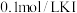 溶液、
溶液、
 溶液,观察到灵敏电流计指针向右偏转(电流方向为从左至右),则乙烧杯中加入的溶液是
溶液,观察到灵敏电流计指针向右偏转(电流方向为从左至右),则乙烧杯中加入的溶液是___________ 。
②随着反应的进行,灵敏电流计指针偏转幅度不断减小,一段时间后示数为0,此时向甲烧杯中加入一定量固体___________ (填标号),可观察到灵敏电流计指针向左偏转。
A. B.
B. C.铁粉
C.铁粉
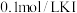 溶液和
溶液和 溶液通过实验验证
溶液通过实验验证 为可逆反应,回答下列问题:
为可逆反应,回答下列问题:(1)配制
 溶液,需称量固体KI
溶液,需称量固体KI (精确到0.01)。
(精确到0.01)。(2)实验验证:向
 溶液加入
溶液加入 溶液,溶液颜色加深,充分反应后,再滴加
溶液,溶液颜色加深,充分反应后,再滴加(3)实验探究:向
 溶液和
溶液和 溶液反应后溶液中加入
溶液反应后溶液中加入 ,振荡、静置,液体分层,下层溶液呈紫红色,上层溶液呈淡黄色,若要检验淡黄色溶液中是否含碘单质,可以进行的实验操作是
,振荡、静置,液体分层,下层溶液呈紫红色,上层溶液呈淡黄色,若要检验淡黄色溶液中是否含碘单质,可以进行的实验操作是(4)有小组同学采用电化学装置(如图所示)从平衡移动的角度进行了验证。

①向烧杯中分别加入相同体积的
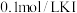 溶液、
溶液、
 溶液,观察到灵敏电流计指针向右偏转(电流方向为从左至右),则乙烧杯中加入的溶液是
溶液,观察到灵敏电流计指针向右偏转(电流方向为从左至右),则乙烧杯中加入的溶液是②随着反应的进行,灵敏电流计指针偏转幅度不断减小,一段时间后示数为0,此时向甲烧杯中加入一定量固体
A.
 B.
B. C.铁粉
C.铁粉
您最近一年使用:0次
10 . 碳和氮的氧化物的综合处理可以缓解环境压力,有利于加快实现“绿水青山”的目标。回答下列问题:
(1)一种利用一氧化碳脱硝的方法涉及如下反应:
ⅰ.2NO(g) N2(g)+O2(g) △H=-180kJ·mol-1
N2(g)+O2(g) △H=-180kJ·mol-1
ⅱ.2NO(g)+O2(g) 2NO2(g) △H=-98kJ·mol-1
2NO2(g) △H=-98kJ·mol-1
ⅲ.CO(g)+NO2(g) NO(g)+CO2(g) △H=-234kJ·mol-1
NO(g)+CO2(g) △H=-234kJ·mol-1
①一氧化碳与一氧化氮反应生成无污染气体的热化学方程式为___________ 。
②反应ⅲ的速率方程为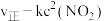 (k为只受温度影响的速率常数),则既能加快反应ⅲ的速率,又能增大
(k为只受温度影响的速率常数),则既能加快反应ⅲ的速率,又能增大 产量的措施是
产量的措施是___________ 。
③一定温度下,向 恒容密闭容器中充入
恒容密闭容器中充入 和
和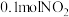 ,
, 末达到平衡。实验测得反应前容器内气体压强为
末达到平衡。实验测得反应前容器内气体压强为 ,平衡时容器内气体压强为
,平衡时容器内气体压强为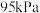 ,
,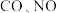 的分压均为
的分压均为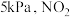 分压为
分压为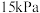 。则
。则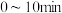 内平均反应速率
内平均反应速率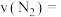
___________  ;反应ⅱ的平衡常数
;反应ⅱ的平衡常数
___________  (
( 是用分压表示的平衡常数)。
是用分压表示的平衡常数)。
④平衡体系中 的体积分数随温度的变化关系如图1所示。下列说法正确的是
的体积分数随温度的变化关系如图1所示。下列说法正确的是___________ (填选项字母)。
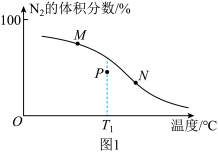
A.反应物的有效碰撞几率:
B.改变催化剂,可以提高 的平衡体积分数
的平衡体积分数
C.若在起始温度为 的绝热容器中重复实验,
的绝热容器中重复实验, 的平衡体积分数可能达到P点数值
的平衡体积分数可能达到P点数值
(2)实验证明:亚铁的氨酸鳌合物因对 有很强的络合活性前用于湿法脱硝,其原理为Fe(II)-EDTA+NO
有很强的络合活性前用于湿法脱硝,其原理为Fe(II)-EDTA+NO Fe(II)-EDTA(NO)。若体系中存在
Fe(II)-EDTA(NO)。若体系中存在 ,脱硝效率明显降低的原因为
,脱硝效率明显降低的原因为___________ ;避免脱硝效率降低的措施为___________ 。
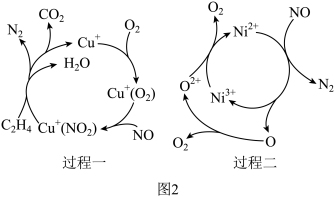
(3)我国科研工作者提出 脱除可通过如图2所示两种过程完成。实际生产中更适宜选择过程二的原因为
脱除可通过如图2所示两种过程完成。实际生产中更适宜选择过程二的原因为___________ 。
(1)一种利用一氧化碳脱硝的方法涉及如下反应:
ⅰ.2NO(g)
 N2(g)+O2(g) △H=-180kJ·mol-1
N2(g)+O2(g) △H=-180kJ·mol-1ⅱ.2NO(g)+O2(g)
 2NO2(g) △H=-98kJ·mol-1
2NO2(g) △H=-98kJ·mol-1ⅲ.CO(g)+NO2(g)
 NO(g)+CO2(g) △H=-234kJ·mol-1
NO(g)+CO2(g) △H=-234kJ·mol-1①一氧化碳与一氧化氮反应生成无污染气体的热化学方程式为
②反应ⅲ的速率方程为
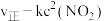 (k为只受温度影响的速率常数),则既能加快反应ⅲ的速率,又能增大
(k为只受温度影响的速率常数),则既能加快反应ⅲ的速率,又能增大 产量的措施是
产量的措施是③一定温度下,向
 恒容密闭容器中充入
恒容密闭容器中充入 和
和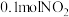 ,
, 末达到平衡。实验测得反应前容器内气体压强为
末达到平衡。实验测得反应前容器内气体压强为 ,平衡时容器内气体压强为
,平衡时容器内气体压强为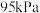 ,
,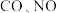 的分压均为
的分压均为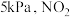 分压为
分压为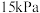 。则
。则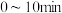 内平均反应速率
内平均反应速率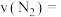
 ;反应ⅱ的平衡常数
;反应ⅱ的平衡常数
 (
( 是用分压表示的平衡常数)。
是用分压表示的平衡常数)。④平衡体系中
 的体积分数随温度的变化关系如图1所示。下列说法正确的是
的体积分数随温度的变化关系如图1所示。下列说法正确的是
A.反应物的有效碰撞几率:

B.改变催化剂,可以提高
 的平衡体积分数
的平衡体积分数C.若在起始温度为
 的绝热容器中重复实验,
的绝热容器中重复实验, 的平衡体积分数可能达到P点数值
的平衡体积分数可能达到P点数值(2)实验证明:亚铁的氨酸鳌合物因对
 有很强的络合活性前用于湿法脱硝,其原理为Fe(II)-EDTA+NO
有很强的络合活性前用于湿法脱硝,其原理为Fe(II)-EDTA+NO Fe(II)-EDTA(NO)。若体系中存在
Fe(II)-EDTA(NO)。若体系中存在 ,脱硝效率明显降低的原因为
,脱硝效率明显降低的原因为(3)我国科研工作者提出
 脱除可通过如图2所示两种过程完成。实际生产中更适宜选择过程二的原因为
脱除可通过如图2所示两种过程完成。实际生产中更适宜选择过程二的原因为
您最近一年使用:0次




