名校
解题方法
1 .  可被用于治疗消化道疾病。某学习探究小组在实验室进行了制备
可被用于治疗消化道疾病。某学习探究小组在实验室进行了制备 以及含量测定的实验。已知:常温下
以及含量测定的实验。已知:常温下 不溶于水,较稳定,与酸反应生成
不溶于水,较稳定,与酸反应生成 ;加热时会分解生成
;加热时会分解生成 和
和 。
。
请回答下列问题:
(1)灼烧。灼烧 制
制 时,可使用的实验装置有
时,可使用的实验装置有___________ (填字母)。 中先加入稳定剂和
中先加入稳定剂和 溶液,充分反应后,过滤、洗涤、干燥,可得粗品
溶液,充分反应后,过滤、洗涤、干燥,可得粗品 。
。
①写出制备 时发生反应的化学方程式:
时发生反应的化学方程式:___________ 。
②“转化”阶段有大量热量放出,为了提高 的产率,添加
的产率,添加 溶液时,比较理想的操作方法为
溶液时,比较理想的操作方法为___________ 。
(3)测定。某研究小组拟用下图装置测定样品(含 杂质)中
杂质)中 的含量。
的含量。 溶液的作用是
溶液的作用是___________ (用化学方程式表示)。
②为了减小实验误差,在每次读数前需要进行的操作是___________ 、___________ 。
③该小组记录的实验数据如下:样品的质量为 ;反应开始前量气管的读数为
;反应开始前量气管的读数为 ;反应结束冷却到室温后量气管的读数为
;反应结束冷却到室温后量气管的读数为 ,已知:室温条件下气体摩尔体积为
,已知:室温条件下气体摩尔体积为 ,则样品中过氧化镁的质量分数为
,则样品中过氧化镁的质量分数为___________  (用含
(用含 的代数式表示);若反应结束后读取量气管中气体的体积时,液面左低右高,则测得
的代数式表示);若反应结束后读取量气管中气体的体积时,液面左低右高,则测得 的质量分数
的质量分数___________ (填“偏大”“偏小”或“无影响”)。
 可被用于治疗消化道疾病。某学习探究小组在实验室进行了制备
可被用于治疗消化道疾病。某学习探究小组在实验室进行了制备 以及含量测定的实验。已知:常温下
以及含量测定的实验。已知:常温下 不溶于水,较稳定,与酸反应生成
不溶于水,较稳定,与酸反应生成 ;加热时会分解生成
;加热时会分解生成 和
和 。
。请回答下列问题:
(1)灼烧。灼烧
 制
制 时,可使用的实验装置有
时,可使用的实验装置有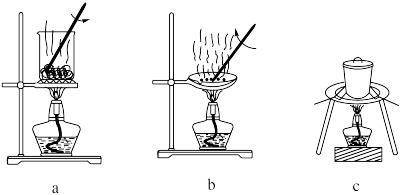
 中先加入稳定剂和
中先加入稳定剂和 溶液,充分反应后,过滤、洗涤、干燥,可得粗品
溶液,充分反应后,过滤、洗涤、干燥,可得粗品 。
。①写出制备
 时发生反应的化学方程式:
时发生反应的化学方程式:②“转化”阶段有大量热量放出,为了提高
 的产率,添加
的产率,添加 溶液时,比较理想的操作方法为
溶液时,比较理想的操作方法为(3)测定。某研究小组拟用下图装置测定样品(含
 杂质)中
杂质)中 的含量。
的含量。
 溶液的作用是
溶液的作用是②为了减小实验误差,在每次读数前需要进行的操作是
③该小组记录的实验数据如下:样品的质量为
 ;反应开始前量气管的读数为
;反应开始前量气管的读数为 ;反应结束冷却到室温后量气管的读数为
;反应结束冷却到室温后量气管的读数为 ,已知:室温条件下气体摩尔体积为
,已知:室温条件下气体摩尔体积为 ,则样品中过氧化镁的质量分数为
,则样品中过氧化镁的质量分数为 (用含
(用含 的代数式表示);若反应结束后读取量气管中气体的体积时,液面左低右高,则测得
的代数式表示);若反应结束后读取量气管中气体的体积时,液面左低右高,则测得 的质量分数
的质量分数
您最近一年使用:0次
2023-10-06更新
|
806次组卷
|
6卷引用:广西南宁市第二中学2023-2024学年高二上学期11月期中考试化学试题
2 . 通过控制化学反应条件,可以使化学反应速率按我们的需求变化。下列现象的反应速率需要减小的是
| A.用白醋清理水壶中的水垢 | B.作肥料的厨余垃圾的腐败 |
| C.轮胎的老化 | D.汽车尾气的净化 |
您最近一年使用:0次
名校
解题方法
3 . 化学反应速率和限度与生产、生活密切相关。
(1)某温度下, 恒容密闭容器中,X、Y、Z三种物质的物质的量随反应时间的变化曲线如图所示。
恒容密闭容器中,X、Y、Z三种物质的物质的量随反应时间的变化曲线如图所示。 内,用
内,用 的浓度变化表示的平均反应速率为
的浓度变化表示的平均反应速率为_______ mol·L-1·min-1。
②该反应的化学方程式为_______ 。
③若 均为气体,在
均为气体,在 时,向容器中通入氩气(容器体积不变),
时,向容器中通入氩气(容器体积不变), 的反应速率将
的反应速率将_______ (填“变大”、“不变”或“变小”)。
④若 均为气体,下列能说明该反应达到平衡状态的是
均为气体,下列能说明该反应达到平衡状态的是_______ (填字母)。
a. 三种气体的浓度相等
三种气体的浓度相等
b.混合气体的质量不随时间变化
c.混合气体的密度不随时间变化
d.单位时间内消耗X和 的物质的量之比为
的物质的量之比为
(2)实验室用 溶液与
溶液与 溶液反应探究条件的改变对化学反应速率的影响,设计的实验方案如下表(已知
溶液反应探究条件的改变对化学反应速率的影响,设计的实验方案如下表(已知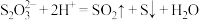 ):
):
①对比实验1和2可探究_______ 因素对化学反应速率的影响。
②对比实验1和3来探究浓度对化学反应速率的影响,则
_______ ,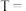
_______ 。
(1)某温度下,
 恒容密闭容器中,X、Y、Z三种物质的物质的量随反应时间的变化曲线如图所示。
恒容密闭容器中,X、Y、Z三种物质的物质的量随反应时间的变化曲线如图所示。
 内,用
内,用 的浓度变化表示的平均反应速率为
的浓度变化表示的平均反应速率为②该反应的化学方程式为
③若
 均为气体,在
均为气体,在 时,向容器中通入氩气(容器体积不变),
时,向容器中通入氩气(容器体积不变), 的反应速率将
的反应速率将④若
 均为气体,下列能说明该反应达到平衡状态的是
均为气体,下列能说明该反应达到平衡状态的是a.
 三种气体的浓度相等
三种气体的浓度相等b.混合气体的质量不随时间变化
c.混合气体的密度不随时间变化
d.单位时间内消耗X和
 的物质的量之比为
的物质的量之比为
(2)实验室用
 溶液与
溶液与 溶液反应探究条件的改变对化学反应速率的影响,设计的实验方案如下表(已知
溶液反应探究条件的改变对化学反应速率的影响,设计的实验方案如下表(已知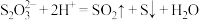 ):
):| 实验序号 | 体积/ | 温度/ | 溶液出现浑浊的时间/s | ||
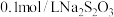 溶液 溶液 | 水 | 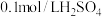 溶液 溶液 | |||
| 1 | 2.0 | 0.0 | 2.0 | 25 |  |
| 2 | 2.0 | 0.0 | 2.0 | 50 |  |
| 3 | 1.0 | V | 2.0 | T |  |
②对比实验1和3来探究浓度对化学反应速率的影响,则

您最近一年使用:0次
2023-07-28更新
|
382次组卷
|
4卷引用:广西南宁市第八中学2023-2024学年高二上学期开学考化学试题
广西南宁市第八中学2023-2024学年高二上学期开学考化学试题湖南师大附中博才实验中学2022-2023年高一下学期期末考试化学试题(已下线)重难点04 化学反应速率及平衡图像问题的分析-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(人教版2019必修第二册)名校期末好题汇编-化学反应与能量(非选择题)
名校
解题方法
4 . 关于合成氨反应
 ,下列说法不正确的是
,下列说法不正确的是

 ,下列说法不正确的是
,下列说法不正确的是| A.使用高效催化剂能减小反应活化能 |
B.为了提高原料利用率, 和 和 循环使用 循环使用 |
C.工业合成氨温度为700K是因为升高温度有利于提高 的平衡转化率 的平衡转化率 |
| D.恒温恒容下,若体系的总压强不再改变,说明该反应已达平衡状态 |
您最近一年使用:0次
2023-07-16更新
|
230次组卷
|
3卷引用:广西百色市德保高中2023-2024学年高二上学期11月期中考试化学试题
广西百色市德保高中2023-2024学年高二上学期11月期中考试化学试题(已下线)专题05 化学反应的方向 化学反应的调控 -【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)福建省宁德市区域性学业质量检测2022-2023学年高二上学期2月期末考试化学试题
名校
解题方法
5 . 工业上以软锰矿(主要成分为 ,还含有少量
,还含有少量 )和辉钼矿(主要成分为为
)和辉钼矿(主要成分为为 ,还含有少量Si、Ni的氧化物)为原料,制备四钼酸铵晶体
,还含有少量Si、Ni的氧化物)为原料,制备四钼酸铵晶体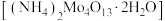 和硫酸锰晶体的工艺流程如下。
和硫酸锰晶体的工艺流程如下。

已知: ,常温下,NiS和MnS的
,常温下,NiS和MnS的 分别为19.4和12.6;
分别为19.4和12.6; 。
。
回答下列问题:
(1)为了提高焙烧效率,可以采取的措施有___________ (写一条即可);“高温焙烧”时 、
、 转化为
转化为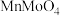 、
、 ,写出该反应的化学方程式
,写出该反应的化学方程式___________ 。
(2)“酸浸”时,硫酸浓度对Mo、Mn浸出率的影响如图所示。

“酸浸”时硫酸的最佳浓度为___________  ,理由是
,理由是___________ 。
(3)黄钠铁矾的化学式为 ,生成黄钠铁矾的离子方程式为
,生成黄钠铁矾的离子方程式为___________ ;“除铁”后的溶液中 ,当溶液中可溶组分浓度
,当溶液中可溶组分浓度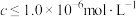 时,可认为已除尽,则“除镍”应控制溶液pH的范围是
时,可认为已除尽,则“除镍”应控制溶液pH的范围是___________ [已知 ,该溶液中
,该溶液中 和pH的关系为
和pH的关系为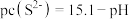 ;忽略溶液体积变化]。
;忽略溶液体积变化]。
(4)“萃取”的原理为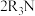 (叔胺)
(叔胺)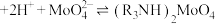 ,则“反萃取”中的试剂X最适宜选用
,则“反萃取”中的试剂X最适宜选用___________ (填标号)。
a.稀硫酸 b. 溶液 c.NaOH溶液 d.氨水
溶液 c.NaOH溶液 d.氨水
从“母液”中回收的副产品主要是___________ (填名称)。
 ,还含有少量
,还含有少量 )和辉钼矿(主要成分为为
)和辉钼矿(主要成分为为 ,还含有少量Si、Ni的氧化物)为原料,制备四钼酸铵晶体
,还含有少量Si、Ni的氧化物)为原料,制备四钼酸铵晶体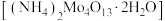 和硫酸锰晶体的工艺流程如下。
和硫酸锰晶体的工艺流程如下。
已知:
 ,常温下,NiS和MnS的
,常温下,NiS和MnS的 分别为19.4和12.6;
分别为19.4和12.6; 。
。回答下列问题:
(1)为了提高焙烧效率,可以采取的措施有
 、
、 转化为
转化为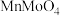 、
、 ,写出该反应的化学方程式
,写出该反应的化学方程式(2)“酸浸”时,硫酸浓度对Mo、Mn浸出率的影响如图所示。

“酸浸”时硫酸的最佳浓度为
 ,理由是
,理由是(3)黄钠铁矾的化学式为
 ,生成黄钠铁矾的离子方程式为
,生成黄钠铁矾的离子方程式为 ,当溶液中可溶组分浓度
,当溶液中可溶组分浓度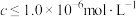 时,可认为已除尽,则“除镍”应控制溶液pH的范围是
时,可认为已除尽,则“除镍”应控制溶液pH的范围是 ,该溶液中
,该溶液中 和pH的关系为
和pH的关系为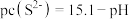 ;忽略溶液体积变化]。
;忽略溶液体积变化]。(4)“萃取”的原理为
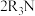 (叔胺)
(叔胺)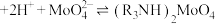 ,则“反萃取”中的试剂X最适宜选用
,则“反萃取”中的试剂X最适宜选用a.稀硫酸 b.
 溶液 c.NaOH溶液 d.氨水
溶液 c.NaOH溶液 d.氨水从“母液”中回收的副产品主要是
您最近一年使用:0次
2023-05-12更新
|
599次组卷
|
2卷引用:广西南宁市第二中学2023-2024学年高三10月教学质量调研化学试题
名校
6 . 工业合成氨的反应: ,是正向放热的可逆反应,该反应在密闭容器中进行。下列有关说法错误的是
,是正向放热的可逆反应,该反应在密闭容器中进行。下列有关说法错误的是
 ,是正向放热的可逆反应,该反应在密闭容器中进行。下列有关说法错误的是
,是正向放热的可逆反应,该反应在密闭容器中进行。下列有关说法错误的是| A.使用催化剂是为了增大反应速率,提高生产效率 |
B.在上述条件下, 可以实现100%转化 可以实现100%转化 |
| C.提高反应温度,可以加快反应速率 |
| D.通过调控反应条件,可以提高反应进行的程度 |
您最近一年使用:0次
2021-05-06更新
|
600次组卷
|
5卷引用:广西来宾市示范性高中2022-2023学年高一下学期6月期末考试化学试题
广西来宾市示范性高中2022-2023学年高一下学期6月期末考试化学试题天津市部分区2020-2021学年高一下学期期中考试化学试题天津市第二南开学校2021-2022学年高一年级下学期期中阶段性质量调查化学试题(已下线)第05讲 化学反应的速率与限度-【寒假自学课】2024年高一化学寒假提升学与练(人教版2019)6.2.2 化学反应的限度 随堂练习
解题方法
7 . 硫酸工业生产中,为了有利于SO2氧化成SO3,且能充分利用热能,采用了中间有热交换器的接触室(如图)。下列说法不正确的是


| A.a、b两处的混合气体成分含量相同,温度不同 |
| B.c、d两处的混合气体成分含量相同,温度不同 |
| C.热交换器的作用是预热待反应的气体,冷却反应后的气体 |
| D.SO2氧化成SO3的反应是放热过程 |
您最近一年使用:0次
2020-12-27更新
|
273次组卷
|
2卷引用:广西钦州市第四中学2023-2024学年高二上学期10月考试化学试卷
8 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:_________________________________________ 。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
p2_______ p 1(填“>”或“<”),得出该结论的理由是________________ 。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+===S↓+2I2+2H2O
ii.I2+2H2O+_________ ===_________ +_______ +2I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
①B是A的对比实验,则a=__________ 。
②比较A、B、C,可得出的结论是______________________ 。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________ 。
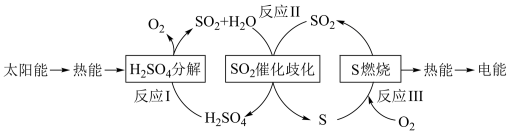
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
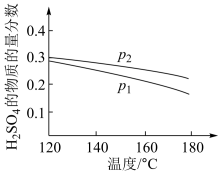
p2
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+===S↓+2I2+2H2O
ii.I2+2H2O+
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
A | B | C | D | |
| 试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
②比较A、B、C,可得出的结论是
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:
您最近一年使用:0次
2018-06-09更新
|
6541次组卷
|
28卷引用:广西壮族自治区钦州市第四中学2022-2023学年高一下学期3月月考化学试卷
广西壮族自治区钦州市第四中学2022-2023学年高一下学期3月月考化学试卷北京市第八中学2022-2023学年高二上学期期末考试化学试题北京市第一○一中学2023-2024学年高二上学期统练一化学试题浙江省杭州第十四中学2023-2024学年高二上学期 期中考试化学试卷北京市广渠门中学2023-2024学年高二上学期期中考试化学试题 北京市铁路第二中学2023-2024学年高二上学期期中考试化学试题2018年全国普通高等学校招生统一考试化学(北京卷)(已下线)2018年高考题及模拟题汇编 专题14 化学反应原理综合【校级联考】安徽省江南片2019届高三上学期入学摸底考试化学试题陕西安康市紫阳县紫阳中学2019届高三上学期入学调研考试化学试题福建省泉州第五中学2019届高三入学调研考试化学试题【全国百强校】山西省太原市第五中学2018-2019学年高二(理)上学期10月月考化学试题江西省丰城中学2018-2019学年高一上学期课改期末考试化学试题云南省富宁县民族中学2020届高三上学期开学考试化学试题福建省福州市第三中学2019-2020学年高三10月月考化学试题(已下线)考点24 元素与理论综合——《备战2020年高考精选考点专项突破题集》(已下线)考点12 化学反应速率化学平衡——《备战2020年高考精选考点专项突破题集》2020届人教版高三专题基础复习专题7《化学反应速率与化学平衡》测试卷四川省成都市实验中学2019-2020学年高三下学期第三次周测化学试题(已下线)专题6.3 化学原理题(必考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第3节 化学反应的速率北京东城区2019-2020学年高二下学期期中考试化学试题(已下线)北京市第四中学2021-2022学年高三上学期期中考试化学试题安徽省黄山市屯溪第一中学2021-2022学年高二上学期期中考试化学试题北京市陈经纶中学2022-2023学年高二10月月考化学试题北京市铁路第二中学2022-2023学年高二上学期期中检测化学试题(已下线)化学(上海C卷)-学易金卷:2023年高考第一次模拟考试卷10-2023新东方高二上期中考化学



