名校
1 . 下列事实能用化学平衡移动原理解释的是
①光照新制的氯水时,溶液的pH逐渐减小
②在铂铑合金催化下缩短N2和H2合成氨的时间
③可用浓氨水和氢氧化钠固体快速制取氨气
④红棕色的NO2,加压后颜色先变深后变浅
⑤对容积可变的密闭容器中已达平衡的HI、I2、H2混合气体进行压缩,混合气体颜色变深
⑥打开可乐瓶盖后看到有大量气泡逸出
⑦实验室中常用排饱和食盐水的方法收集氯气
①光照新制的氯水时,溶液的pH逐渐减小
②在铂铑合金催化下缩短N2和H2合成氨的时间
③可用浓氨水和氢氧化钠固体快速制取氨气
④红棕色的NO2,加压后颜色先变深后变浅
⑤对容积可变的密闭容器中已达平衡的HI、I2、H2混合气体进行压缩,混合气体颜色变深
⑥打开可乐瓶盖后看到有大量气泡逸出
⑦实验室中常用排饱和食盐水的方法收集氯气
| A.①②④⑤⑦ | B.①③④⑥⑦ |
| C.①③④⑤⑥⑦ | D.①④⑤⑥⑦ |
您最近一年使用:0次
2021-09-26更新
|
424次组卷
|
2卷引用:吉林省延边第二中学2021-2022学年高二上学期第一次阶段检测化学试题
名校
解题方法
2 . CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。请回答下列问题:
I.工业上可以利用CO2和H2合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。该反应在起始温度和体积均相同(T℃、1L)的两个密闭容器中分别进行,反应物起始物质的量见下表:
(1)达到平衡时,反应a,b对比:CO2的体积分数φ(a)_______ φ(b)(填“>”、“<”或“=”))。
(2)下列能说明反应a达到平衡状态的是_______ (填字母)。
A.v正(CO2)=3v逆(H2)
B.混合气体的平均摩尔质量不再改变
C.c(CH3OH)=c(H2O)
D.容器内压强不再改变
II.我国科学家研究了不同反应温度对含碳产物组成的影响。
已知:反应1:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH<0
反应2:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0
在密闭容器中通入3mol的的H2和1mol的CO2,分别在1MPa和10MPa下进行反应。实验中对平衡体系组成的三种物质(CO2、CO、CH4)进行分析,其中温度对CO和CH4的影响如图所示。
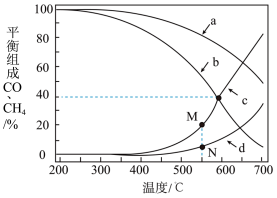
(3)1MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是_______ 和_______ 。M点平衡组成含量高于N点的原因是_______ 。
(4)图中当CH4和CO平衡组成均为40%时,若容器的体积为1L,该温度下反应1的平衡常数K的值为_______ 。
III.在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的的CO和H2,发生反应CO(g)+2H2(g) ⇌ CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如下图所示。
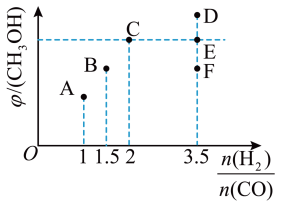
(5)当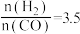 时,达到平衡后,CH3OH的体积分数可能是图象中的
时,达到平衡后,CH3OH的体积分数可能是图象中的_______ (填“D”、“E”或“F”)点。
(6) =
=_______ 时,CH3OH的体积分数最大。
I.工业上可以利用CO2和H2合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。该反应在起始温度和体积均相同(T℃、1L)的两个密闭容器中分别进行,反应物起始物质的量见下表:
| CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应a(恒温恒容) | 1 | 3 | 0 | 0 |
| 反应b(绝热恒容) | 0 | 0 | 1 | 1 |
(2)下列能说明反应a达到平衡状态的是
A.v正(CO2)=3v逆(H2)
B.混合气体的平均摩尔质量不再改变
C.c(CH3OH)=c(H2O)
D.容器内压强不再改变
II.我国科学家研究了不同反应温度对含碳产物组成的影响。
已知:反应1:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH<0
反应2:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0
在密闭容器中通入3mol的的H2和1mol的CO2,分别在1MPa和10MPa下进行反应。实验中对平衡体系组成的三种物质(CO2、CO、CH4)进行分析,其中温度对CO和CH4的影响如图所示。

(3)1MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是
(4)图中当CH4和CO平衡组成均为40%时,若容器的体积为1L,该温度下反应1的平衡常数K的值为
III.在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的的CO和H2,发生反应CO(g)+2H2(g) ⇌ CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如下图所示。

(5)当
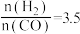 时,达到平衡后,CH3OH的体积分数可能是图象中的
时,达到平衡后,CH3OH的体积分数可能是图象中的(6)
 =
=
您最近一年使用:0次
2021-03-04更新
|
821次组卷
|
4卷引用:吉林省延边州2021届高三下学期教学质量检测(2月底) 理综化学试题
吉林省延边州2021届高三下学期教学质量检测(2月底) 理综化学试题(已下线)第21讲 化学平衡状态 化学平衡的移动(精练)-2022年高考化学一轮复习讲练测江苏省扬州中学2021-2022学年高二上学期期中考试化学试题(已下线)第21讲 化学平衡状态 化学平衡的移动(练)-2023年高考化学一轮复习讲练测(全国通用)
名校
解题方法
3 . 工业制硫酸中的一步重要反应是SO2在400-500℃下的催化氧化: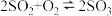 ,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中
,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中不正确 的是
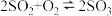 ,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中
,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中| A.在上述条件下,SO2不可能100%地转化为SO3 |
| B.使用催化剂是为了加快反应速率,提高生产效率 |
| C.达到平衡时,SO2与O2的浓度比始终保持2:1 |
| D.为了提高SO2的转化率,可以适当提高O2的浓度 |
您最近一年使用:0次
2020-09-08更新
|
358次组卷
|
3卷引用:吉林省延边第二中学2020-2021学年高一下学期期末考试化学试题
名校
4 . 某同学研究浓度对化学平衡的影响,下列说法正确的是
已知: (aq)(橙色) + H2O(l)⇌2
(aq)(橙色) + H2O(l)⇌2 (aq) (黄色)+ 2H+(aq) △H=+13.8 kJ/mol
(aq) (黄色)+ 2H+(aq) △H=+13.8 kJ/mol
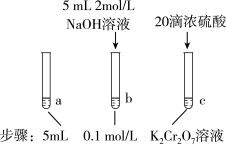 | 待试管b中颜色不变后与试管a比较,溶液颜色变浅。滴加浓硫酸,试管c温度略有升高,溶液颜色与试管 a 相比,变深。 |
已知:
 (aq)(橙色) + H2O(l)⇌2
(aq)(橙色) + H2O(l)⇌2 (aq) (黄色)+ 2H+(aq) △H=+13.8 kJ/mol
(aq) (黄色)+ 2H+(aq) △H=+13.8 kJ/mol| A.该反应为氧化还原反应 |
B.待试管 b 中溶液颜色不变的目的是使 完全反应 完全反应 |
| C.试管c中的现象说明影响平衡的主要因素是温度 |
| D.该实验不能证明减小生成物浓度平衡正向移动 |
您最近一年使用:0次
2020-07-03更新
|
127次组卷
|
5卷引用:吉林省汪清县汪清四中2021-2022学年高二上学期第一次阶段考试化学试题
13-14高二·全国·课时练习
名校
5 . 某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g) 4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是
 4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是| A.前2 min,D的平均反应速率为0.2 mol·L-1·min-1 |
| B.此时,B的平衡转化率是40% |
| C.增大该体系的压强,平衡不移动 |
| D.增加B,平衡向右移动,B的平衡转化率增大 |
您最近一年使用:0次
2020-05-28更新
|
539次组卷
|
21卷引用:吉林省延边第二中学2019-2020学年高二12月月考化学试题
吉林省延边第二中学2019-2020学年高二12月月考化学试题(已下线)2014年高中化学人教版选修四第二章 化学反应速率与化学平衡练习卷2015-2016学年黑龙江省牡丹江高级中学高二上期末化学卷山东省济南第一中学2017-2018学年高二上学期期中考试化学试题河南省滑县第二高级中学2017-2018学年高二12月月考化学试题【全国百强校】山东省济南第一中学2018-2019学年高二上学期期中考试化学试题江西省遂川中学2017-2018学年高二上学期第三次月考化学试题云南省大理市下关一中2018-2019学年高二上学期期中考试化学试题广东省广州市2019-2020学年高二上学期期中模拟测试化学试题(二)安徽省滁州市定远县育才学校2019-2020学年高二上学期期中考试(普通班)化学试题山东省德州市陵城区第一中学2019-2020学年高二上学期期中考试化学试题黑龙江省双鸭山市第一中学2019-2020学年高二上学期期末考试化学试题广东省第二师范学院番禺附属中学2019-2020学年高二下学期期中段考化学试题(已下线)2.3.2 压强变化对化学平衡的影响(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)福建省泰宁第一中学2018-2019学年高二上学期第二阶段考试化学(理)试题贵州省遵义市航天高级中学2020-2021学年高二上学期第一次月考化学(理)试题河南省安阳市第一中学2020-2021学年高二上学期第一次阶段考试化学试题内蒙古呼伦贝尔市阿荣旗第一中学2020-2021学年高二上学期月考化学试题福建省三明市泰宁县福建省泰宁第一中学2019-2020学年高二上学期第二次阶段考试化学试题安徽省宿州市砀山中学2021-2022学年高二上学期第一次质量检测化学试题广西浦北中学2021-2022学年高二上学期第一次月考化学试题



