名校
解题方法
1 . 利用如下实验研究Fe3+与I—的反应。
步骤1:向烧杯中加入10mL0.1mol·L-1的KI溶液,再滴加2mL0.1mol·L-1的Fe2(SO4)3溶液,振荡,把溶液分为四等份于编号为①②③④的四支试管中。
步骤2:向试管①中加入淀粉溶液,观察到溶液变蓝。
步骤3:向试管②中滴加15%KSCN溶液5~6滴,观察到溶液变红。
步骤4:向试管③、试管④中分别加入1mL2.0mol·L-1的FeSO4溶液和1mL的蒸馏水,振荡,观察到试管③中溶液颜色比试管④中溶液颜色浅。
下列说法不正确的是
步骤1:向烧杯中加入10mL0.1mol·L-1的KI溶液,再滴加2mL0.1mol·L-1的Fe2(SO4)3溶液,振荡,把溶液分为四等份于编号为①②③④的四支试管中。
步骤2:向试管①中加入淀粉溶液,观察到溶液变蓝。
步骤3:向试管②中滴加15%KSCN溶液5~6滴,观察到溶液变红。
步骤4:向试管③、试管④中分别加入1mL2.0mol·L-1的FeSO4溶液和1mL的蒸馏水,振荡,观察到试管③中溶液颜色比试管④中溶液颜色浅。
下列说法不正确的是
| A.试管①中的现象说明此条件下Fe3+的氧化性大于I2 |
| B.试管②中的现象说明Fe3+与I—的反应为可逆反应 |
| C.步骤4的现象能说明此条件下I2能将Fe2+氧化成Fe3+ |
| D.试管②中红色物质的组成为[Fe(SCN)n(H2O)6—n]3—n,此微粒中心离子的配位数为n |
您最近一年使用:0次
2022-03-01更新
|
156次组卷
|
2卷引用:江苏省苏州市相城区陆慕高级中学2021-2022学年高三上学期阶段性诊断测试化学试题
名校
2 . 地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。水体除 主要有电化学法、催化还原法等。
主要有电化学法、催化还原法等。
(1)电化学去除弱酸性水体中 的反应原理如图所示:
的反应原理如图所示:

①作负极的物质是___________ 。
②正极的电极反应式是___________ 。
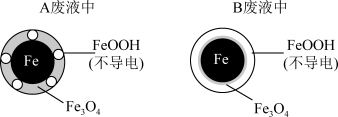
③取两份完全相同的含 废液A和B,调节废液A、B的pH分别为2.5和4.5,向废液A、B中加入足量铁粉,经相同时间充分反应后,废液A、B均接近中性。废液A、B中铁的最终物质存在形态分别如图所示。溶液的初始pH对铁的氧化产物有影响,具体影响为
废液A和B,调节废液A、B的pH分别为2.5和4.5,向废液A、B中加入足量铁粉,经相同时间充分反应后,废液A、B均接近中性。废液A、B中铁的最终物质存在形态分别如图所示。溶液的初始pH对铁的氧化产物有影响,具体影响为___________ 。废液中 的去除率较低的是
的去除率较低的是___________ (“废液A”和“废液B”), 的去除率低的原因是
的去除率低的原因是___________ 。
(2)纳米Fe-Ni去除废液中的 (Ni不参与反应)。
(Ni不参与反应)。
①在酸性条件下,Fe与 反应生成Fe2+和
反应生成Fe2+和 ,则反应的离子方程式为
,则反应的离子方程式为___________ 。
②初始pH=2.0的废液,加入一定量的纳米Fe-Ni,反应一段时间后,废液中出现大量白色絮状沉淀物,过滤后白色沉淀物在空气中逐渐变成红褐色。产生上述现象的原因是___________ 。
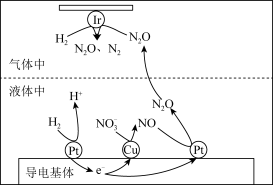
(3)在金属Pt、Cu和Ir(铱)的催化作用下,H2可高效转化酸性溶液中的 ,其工作原理如图所示。H2在金属Pt和Cu的催化作用下将
,其工作原理如图所示。H2在金属Pt和Cu的催化作用下将 转化为液体中N2O的过程可描述为
转化为液体中N2O的过程可描述为___________ 。
 主要有电化学法、催化还原法等。
主要有电化学法、催化还原法等。(1)电化学去除弱酸性水体中
 的反应原理如图所示:
的反应原理如图所示:
①作负极的物质是
②正极的电极反应式是
③取两份完全相同的含
 废液A和B,调节废液A、B的pH分别为2.5和4.5,向废液A、B中加入足量铁粉,经相同时间充分反应后,废液A、B均接近中性。废液A、B中铁的最终物质存在形态分别如图所示。溶液的初始pH对铁的氧化产物有影响,具体影响为
废液A和B,调节废液A、B的pH分别为2.5和4.5,向废液A、B中加入足量铁粉,经相同时间充分反应后,废液A、B均接近中性。废液A、B中铁的最终物质存在形态分别如图所示。溶液的初始pH对铁的氧化产物有影响,具体影响为 的去除率较低的是
的去除率较低的是 的去除率低的原因是
的去除率低的原因是
(2)纳米Fe-Ni去除废液中的
 (Ni不参与反应)。
(Ni不参与反应)。①在酸性条件下,Fe与
 反应生成Fe2+和
反应生成Fe2+和 ,则反应的离子方程式为
,则反应的离子方程式为②初始pH=2.0的废液,加入一定量的纳米Fe-Ni,反应一段时间后,废液中出现大量白色絮状沉淀物,过滤后白色沉淀物在空气中逐渐变成红褐色。产生上述现象的原因是
(3)在金属Pt、Cu和Ir(铱)的催化作用下,H2可高效转化酸性溶液中的
 ,其工作原理如图所示。H2在金属Pt和Cu的催化作用下将
,其工作原理如图所示。H2在金属Pt和Cu的催化作用下将 转化为液体中N2O的过程可描述为
转化为液体中N2O的过程可描述为
您最近一年使用:0次
名校
3 . 下列有关反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH<0的说法正确的是
| A.ΔS<0 |
| B.使用催化剂,可以降低该反应的活化能 |
C.该反应的平衡常数可表示为K= |
D.其他条件不变时,增大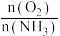 ,NH3的转化率下降 ,NH3的转化率下降 |
您最近一年使用:0次
4 . 中国首次实现了利用二氧化碳人工合成淀粉,为全球的“碳达峰”、“碳中和”起到重大的支撑作用。其中最关键的一步是以CO2为原料制CH3OH。在某CO2催化加氢制CH3OH的反应体系中,发生的主要反应有:
I.CO2(g)+H2(g) CO(g)+H2O(g) ΔH1=+41.1kJ·mol-1
CO(g)+H2O(g) ΔH1=+41.1kJ·mol-1
II.CO(g)+2H2(g) CH3OH(g) ΔH2=-90.0kJ·mol-1
CH3OH(g) ΔH2=-90.0kJ·mol-1
(1)CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH=
CH3OH(g)+H2O(g)ΔH=___ 。
(2)5Mpa时,往某密闭容器中按投料比n(H2)∶n(CO2)=3∶1充入H2和CO2。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图1所示。
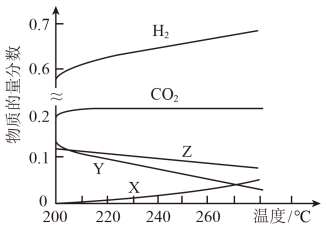
①图中X代表___ 。(填化学式)。
②体系中H2的物质的量分数随温度的增大而升高,试分析原因___ 。
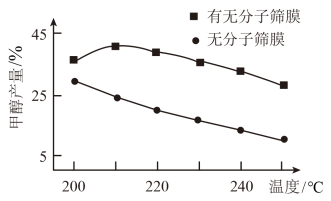
(3)H2和CO2起始物质的量比为3∶1时,该反应在有、无分子筛膜时甲醇的平衡产率随温度的变化如图2所示,其中分子筛膜能选择性分离出H2O。温度低于210℃时,随着温度升高,有分子筛膜的甲醇产率升高的可能原因是___ 。
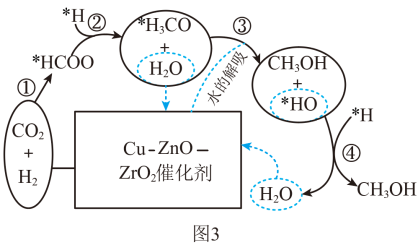
(4)我国科研人员研究出在Cu—ZnO—ZrO2催化剂上CO2氢化合成甲醇的反应历程如图3所示。反应③的化学方程式为___ ;分析在反应气中加入少量的水能够提升甲醇产率的可能原因是___ 。
I.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH1=+41.1kJ·mol-1
CO(g)+H2O(g) ΔH1=+41.1kJ·mol-1II.CO(g)+2H2(g)
 CH3OH(g) ΔH2=-90.0kJ·mol-1
CH3OH(g) ΔH2=-90.0kJ·mol-1(1)CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)ΔH=
CH3OH(g)+H2O(g)ΔH=(2)5Mpa时,往某密闭容器中按投料比n(H2)∶n(CO2)=3∶1充入H2和CO2。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图1所示。

①图中X代表
②体系中H2的物质的量分数随温度的增大而升高,试分析原因
(3)H2和CO2起始物质的量比为3∶1时,该反应在有、无分子筛膜时甲醇的平衡产率随温度的变化如图2所示,其中分子筛膜能选择性分离出H2O。温度低于210℃时,随着温度升高,有分子筛膜的甲醇产率升高的可能原因是

(4)我国科研人员研究出在Cu—ZnO—ZrO2催化剂上CO2氢化合成甲醇的反应历程如图3所示。反应③的化学方程式为

您最近一年使用:0次
名校
5 . 在两个容积均为2L恒温密闭容器中,起始时均充入 ,控制不同温度和分别在有、无
,控制不同温度和分别在有、无 催化时进行
催化时进行 的分解实验[反应为:
的分解实验[反应为: ]。测得的结果如下图所示(曲线II、III表示经过相同时间且未达到化学平衡时
]。测得的结果如下图所示(曲线II、III表示经过相同时间且未达到化学平衡时 的转化率)。
的转化率)。
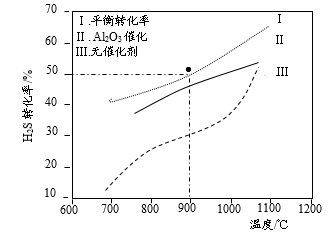
下列说法正确的是
 ,控制不同温度和分别在有、无
,控制不同温度和分别在有、无 催化时进行
催化时进行 的分解实验[反应为:
的分解实验[反应为: ]。测得的结果如下图所示(曲线II、III表示经过相同时间且未达到化学平衡时
]。测得的结果如下图所示(曲线II、III表示经过相同时间且未达到化学平衡时 的转化率)。
的转化率)。
下列说法正确的是
A. 分解为放热反应 分解为放热反应 |
B.加入 可提高 可提高 的平衡转化率 的平衡转化率 |
C.900℃反应 的平衡常数 的平衡常数 |
D.约1100℃曲线II、III几乎重合,说明 可能几乎失去催化活性 可能几乎失去催化活性 |
您最近一年使用:0次
名校
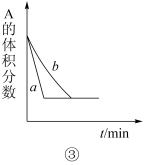
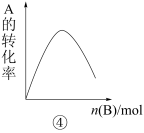
6 . 下列是有关外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是
 |  |
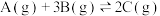 |  |
 |  |
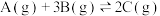 | 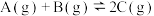 |
A.①是其他条件一定时,反应速率随温度变化的图像,则正反应 |
| B.②是在平衡体系的溶液中溶入少量KCl晶体后,化学反应速率随时间变化的图像 |
| C.③是在有无催化剂存在条件下,建立平衡过程的图像,a是使用催化剂时的曲线 |
| D.④是一定条件下,向含有一定量A的恒容密闭容器中逐渐加入B,达平衡时A的转化率的图像 |
您最近一年使用:0次
7 . 脱除烟气中的氮氧化物(主要是指NO和 )可净化空气、改善环境,是环境保护的主要课题。
)可净化空气、改善环境,是环境保护的主要课题。
(1) 的消除。可以用碳酸钠溶液来进行吸收,在产生
的消除。可以用碳酸钠溶液来进行吸收,在产生 的同时,会生成
的同时,会生成 等物质,
等物质, 是工业盐的主要成分,在漂白、电镀等方面应用广泛。写出碳酸钠溶液消除
是工业盐的主要成分,在漂白、电镀等方面应用广泛。写出碳酸钠溶液消除 的化学方程式:
的化学方程式:_______ 。
(2)NO的消除。
① 可有效脱除NO,但
可有效脱除NO,但 不稳定,实际应用中常用其盐。
不稳定,实际应用中常用其盐。 和
和 制取漂白粉的化学方程式是
制取漂白粉的化学方程式是_______ 。
次氯酸盐溶液脱除NO的主要过程如下:
a.
b.
c.
②下列分析正确的是_______ 。
A.烟气中含有少量 能提高NO的脱除率
能提高NO的脱除率
B. 单独存在时不能被脱除
单独存在时不能被脱除
C.脱除过程中,次氯酸盐溶液的 下降
下降
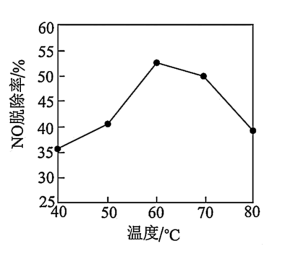
③研究不同温度下 溶液对NO脱除率的影响,结果如图所示。脱除过程中往往有
溶液对NO脱除率的影响,结果如图所示。脱除过程中往往有 产生,原因是
产生,原因是_______ 。(用离子方程式表示); 脱除率下降的原因是
脱除率下降的原因是_______ 。
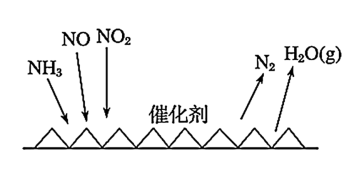
(3) 催化还原氮氧化物(
催化还原氮氧化物( )技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示。当
)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示。当 与NO的物质的量之比为
与NO的物质的量之比为 时,与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为
时,与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为_______ 。
(4)利用电化学装置可消除氮氧化物污染,变废为宝。如图为电解NO制备 的装置,该装置中阳极的电极反应式为
的装置,该装置中阳极的电极反应式为_______ 。

 )可净化空气、改善环境,是环境保护的主要课题。
)可净化空气、改善环境,是环境保护的主要课题。(1)
 的消除。可以用碳酸钠溶液来进行吸收,在产生
的消除。可以用碳酸钠溶液来进行吸收,在产生 的同时,会生成
的同时,会生成 等物质,
等物质, 是工业盐的主要成分,在漂白、电镀等方面应用广泛。写出碳酸钠溶液消除
是工业盐的主要成分,在漂白、电镀等方面应用广泛。写出碳酸钠溶液消除 的化学方程式:
的化学方程式:(2)NO的消除。
①
 可有效脱除NO,但
可有效脱除NO,但 不稳定,实际应用中常用其盐。
不稳定,实际应用中常用其盐。 和
和 制取漂白粉的化学方程式是
制取漂白粉的化学方程式是次氯酸盐溶液脱除NO的主要过程如下:
a.

b.

c.

②下列分析正确的是
A.烟气中含有少量
 能提高NO的脱除率
能提高NO的脱除率B.
 单独存在时不能被脱除
单独存在时不能被脱除C.脱除过程中,次氯酸盐溶液的
 下降
下降③研究不同温度下
 溶液对NO脱除率的影响,结果如图所示。脱除过程中往往有
溶液对NO脱除率的影响,结果如图所示。脱除过程中往往有 产生,原因是
产生,原因是 脱除率下降的原因是
脱除率下降的原因是
(3)
 催化还原氮氧化物(
催化还原氮氧化物( )技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示。当
)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示。当 与NO的物质的量之比为
与NO的物质的量之比为 时,与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为
时,与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为
(4)利用电化学装置可消除氮氧化物污染,变废为宝。如图为电解NO制备
 的装置,该装置中阳极的电极反应式为
的装置,该装置中阳极的电极反应式为
您最近一年使用:0次
8 . 对于反应2SO2(g)+ O2(g) 2SO3(g),下列有关说法
2SO3(g),下列有关说法正确 的是
 2SO3(g),下列有关说法
2SO3(g),下列有关说法| A.只要选择适宜的条件,SO2和O2就能全部转化为SO3 |
| B.升高温度有利于提高SO2的平衡转化率 |
| C.使用 V2O5作催化剂,降低了反应的活化能,增大了单位体积内活化分子的数目 |
D.提高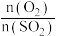 的值可增大O2的转化率 的值可增大O2的转化率 |
您最近一年使用:0次
2021-11-17更新
|
144次组卷
|
5卷引用:江苏省扬州市邗江区2021-2022学年高二上学期期中检测化学试题
9 . 对于反应CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH<0。下列有关说法不正确的是
CH4(g)+2H2O(g) ΔH<0。下列有关说法不正确的是
 CH4(g)+2H2O(g) ΔH<0。下列有关说法不正确的是
CH4(g)+2H2O(g) ΔH<0。下列有关说法不正确的是| A.CH4既是氧化产物,又是还原产物 |
B.提高 的值可增大H2的转化率 的值可增大H2的转化率 |
| C.升高温度有利于提高CO2的平衡转化率 |
| D.提高CO2转化为CH4的转化率,需研发在低温区高效催化剂 |
您最近一年使用:0次
2021-11-12更新
|
327次组卷
|
5卷引用:江苏省盐城市2021-2022学年高三上学期期中考试化学试题
江苏省盐城市2021-2022学年高三上学期期中考试化学试题(已下线)第七单元 化学反应速率与化学平衡(A卷 新题基础练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)押江苏卷第8题 化学反应速率与化学平衡、热化学 -备战2022年高考化学临考题号押题(江苏卷)江苏省南京师范大学苏州实验学校2022-2023学年高二上学期9月月考化学试题(已下线)第08讲 化学反应的调控-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)
名校
10 . 勒夏特列原理是平衡移动问题的指挥棒,下列事实不能用勒夏特列原理解释的是
| A.打开碳酸饮料会有大量气泡冒出,实验室用排饱和食盐水的方法收集氯气 |
B.对于2HI(g) H2(g)+I2(g),达到平衡后,缩小容器体积可使体系颜色变深 H2(g)+I2(g),达到平衡后,缩小容器体积可使体系颜色变深 |
C.反应CO(g)+NO2(g) CO2(g)+NO(g)(正反应为放热反应),达到平衡后,升高温度体系颜色变深 CO2(g)+NO(g)(正反应为放热反应),达到平衡后,升高温度体系颜色变深 |
D.工业制取金属钾Na(l)+KCl(l) NaCl(l)+K(g),选取适宜的温度,使钾成蒸气从反应混合物中分离出来 NaCl(l)+K(g),选取适宜的温度,使钾成蒸气从反应混合物中分离出来 |
您最近一年使用:0次
2021-11-01更新
|
223次组卷
|
3卷引用:江苏省南通市海安李堡中学2021-2022学年高二上学期期中考试化学试题



